

Feiba Nf

Consulta con un médico sobre la receta médica de Feiba Nf

Cómo usar Feiba Nf
Hoja de instrucciones del paquete: información para el usuario
FEIBA NF, 500 UI, polvo y disolvente para la preparación de una solución para inyección
Conjunto de factores de coagulación contra el inhibidor del factor VIII
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para una persona. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es FEIBA NF y para qué se utiliza
- 2. Información importante antes de usar FEIBA NF
- 3. Cómo usar FEIBA NF
- 4. Posibles efectos adversos
- 5. Cómo conservar FEIBA NF
- 6. Contenido del paquete y otra información
1. Qué es FEIBA NF y para qué se utiliza
FEIBA NF es un medicamento obtenido del plasma humano que permite la coagulación de la sangre en caso de deficiencia o ausencia de algunos factores de coagulación. FEIBA NF se utiliza para tratar y prevenir hemorragias en pacientes con hemofilia A y hemofilia B con inhibidores de factores de coagulación. Además, FEIBA NF puede ser utilizado para tratar y prevenir hemorragias en personas sin hemofilia pero con inhibidores adquiridos de factores VIII, IX y XI. También hay informes de casos de uso de FEIBA NF en el tratamiento de pacientes con inhibidores adquiridos de factores X y XIII. FEIBA NF también se utiliza en combinación con concentrado de factor VIII durante el tratamiento a largo plazo para eliminar los inhibidores del factor VIII y permitir el tratamiento regular con concentrado de factor VIII, al igual que en pacientes sin inhibidores.
2. Información importante antes de usar FEIBA NF
Debe informar a su médico si tiene alguna alergia. Debe informar a su médico si está siguiendo una dieta baja en sodio.
Cuándo no usar FEIBA NF
En las situaciones enumeradas a continuación, FEIBA NF solo debe ser utilizado cuando no se puedan esperar resultados del tratamiento con otros concentrados de factores de coagulación adecuados, por ejemplo, debido a un título de inhibidor muy alto y una hemorragia que pone en peligro la vida o un riesgo de hemorragia (traumática, postoperatoria).
- Si el paciente tiene alergia (hipersensibilidad) al conjunto de factores de coagulación contra el inhibidor del factor VIII o a cualquier otro componente de FEIBA NF.
- Si se produce coagulación intravascular diseminada (CID, coagulopatía de consumo, estado que pone en peligro la vida, asociado con coagulación masiva de la sangre con formación de coágulos en los vasos. Esto conduce a un agotamiento general de los factores de coagulación.): cuando los resultados de las pruebas de laboratorio y (o) los síntomas clínicos indican daño hepático, existe un mayor riesgo de CID debido a la degradación retardada de los factores de coagulación activados;
- En caso de enfermedad coronaria, trombosis aguda y (o) embolia: FEIBA NF solo debe ser utilizado en episodios de hemorragia que ponen en peligro la vida.
Precauciones y advertencias
Antes de usar FEIBA NF, debe comunicarse con su médico, ya que al igual que con otros productos de plasma humano administrados por vía intravenosa, es posible que se produzcan reacciones de hipersensibilidad tipo alérgico. El paciente debe ser capaz de reconocer los síntomas tempranos de una reacción de hipersensibilidad, como:
- enrojecimiento
- erupción cutánea
- erupción cutánea picazón (urticaria)
- picazón
- hinchazón de los labios y la lengua
- respiración silbante
- sensación de opresión en el pecho
- malestar
- mareo
- caída repentina de la presión arterial para reconocer lo antes posible una reacción alérgica.
Otros síntomas de reacciones de hipersensibilidad a medicamentos derivados del plasma incluyen somnolencia y agitación. En caso de que se produzca uno o más de estos síntomas, debe interrumpir inmediatamente el uso del medicamento y comunicarse con su médico. Estos síntomas pueden ser signos tempranos de un shock anafiláctico. Los síntomas graves de hipersensibilidad requieren tratamiento de emergencia inmediato. En caso de que el paciente tenga sospecha de hipersensibilidad al medicamento o a alguno de sus componentes, el médico decidirá sobre la administración repetida de FEIBA NF solo después de una consideración cuidadosa del riesgo y los beneficios esperados y (o) cuando no se puedan esperar resultados del tratamiento con otra terapia preventiva o medidas alternativas.
- si el paciente experimenta cambios significativos en la presión arterial o la frecuencia cardíaca, dificultades para respirar, tos o dolor en el pecho. Debe interrumpir inmediatamente la infusión y comunicarse con su médico. El médico tomará las medidas diagnósticas y terapéuticas adecuadas.
- en pacientes con hemofilia y presencia de inhibidor o inhibidores adquiridos de factores de coagulación. Durante el tratamiento con FEIBA NF en estos pacientes, puede ocurrir una mayor tendencia a hemorragias y, al mismo tiempo, un mayor riesgo de trombosis.
Durante el tratamiento con FEIBA NF, se han producido trastornos trombóticos, incluyendo coagulación intravascular diseminada (CID), trombosis venosa, embolia pulmonar, infarto de miocardio y accidente cerebrovascular. Algunos trastornos trombóticos ocurrieron con el uso de dosis altas de FEIBA NF. La administración concomitante de factor VIIa recombinante puede aumentar el riesgo de trastornos trombóticos. Se han notificado casos de microangiopatía trombótica en un estudio clínico de emicizumab, en el que los pacientes recibieron FEIBA NF como parte del esquema de tratamiento de hemorragia de ruptura. En el caso de medicamentos producidos a partir de sangre o plasma humano, se toman medidas específicas para prevenir infecciones transmitidas a los pacientes. Estas medidas incluyen una selección cuidadosa de los donantes de sangre y plasma para asegurarse de que aquellos que están en grupo de riesgo de transmisión de infecciones sean excluidos, así como la verificación de muestras individuales de sangre donada y del lote de plasma recolectado para detectar virus/infecciones. Los fabricantes de estos productos también incluyen etapas en el proceso de tratamiento de la sangre y el plasma para inactivar o eliminar los virus. A pesar de estas medidas, en el caso de la administración de medicamentos producidos a partir de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmisión de una infección. Esto incluye infecciones desconocidas o recientemente detectadas. Las medidas tomadas se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH, que causa el SIDA), el virus de la hepatitis B y el virus de la hepatitis C, así como contra el virus de la hepatitis A sin envoltura. Las medidas pueden tener un valor limitado contra los virus sin envoltura, como el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección del feto) y en personas con deficiencia de inmunidad o con eritropoyesis aumentada (por ejemplo, anemia hemolítica). En pacientes que reciben regularmente o en varias ocasiones factor VIII obtenido de plasma humano, debe considerarse la administración de vacunas adecuadas (contra la hepatitis A y B). Después de la administración de dosis altas de FEIBA NF, el aumento transitorio de anticuerpos pasivamente transferidos contra el antígeno de superficie del virus de la hepatitis B puede dar lugar a resultados falsos positivos en las pruebas serológicas. El medicamento contiene isoaglutininas, anticuerpos contra los glóbulos rojos, que pueden dar lugar a resultados engañosos en las pruebas serológicas cuando se transfieren pasivamente. Se recomienda encarecidamente que durante cada administración de una dosis de FEIBA NF al paciente, se registre el nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados.
FEIBA NF y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que está tomando actualmente o ha tomado recientemente, incluso aquellos que se pueden obtener sin receta.
No se han realizado estudios adecuados y bien controlados sobre el tratamiento combinado o secuencial con FEIBA NF y factor VIIa recombinante, medicamentos que inhiben la fibrinolisis o emicizumab. Debe considerarse la posibilidad de incidentes trombóticos en caso de uso concomitante de medicamentos que inhiben la fibrinolisis, como el ácido tranexámico y el ácido aminocaproico, en combinación con FEIBA NF. Por lo tanto, los medicamentos que inhiben la fibrinolisis no deben ser utilizados durante aproximadamente 6 a 12 horas después de la administración de FEIBA NF. En relación con los datos disponibles de estudios in vitro y observaciones clínicas, en caso de uso concomitante de factor VIIa recombinante, no se puede excluir la posibilidad de una interacción medicamentosa que pueda dar lugar a un incidente trombótico. Si se considera el tratamiento con FEIBA NF después de que el paciente haya recibido emicizumab, el paciente debe ser estrechamente monitoreado por su médico. Al igual que con todos los productos medicamentosos de factores de coagulación, no se debe mezclar FEIBA NF con otros medicamentos antes de la administración; esto puede afectar adversamente la eficacia y la seguridad del medicamento. Se recomienda que antes y después de la administración de FEIBA NF, se enjuague la vía de administración intravenosa con una solución salina isotónica.
Embarazo, lactancia y fertilidad
El médico decidirá si se puede usar FEIBA NF durante el embarazo o la lactancia. Debido al mayor riesgo de trombosis durante el embarazo, FEIBA NF solo debe ser utilizado bajo control médico estricto y cuando esté claramente indicado.
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto en la capacidad de conducir vehículos o operar máquinas.
FEIBA NF contiene sodio
El medicamento contiene 80 mg de sodio (principal componente de la sal común) en cada vial. Esto corresponde al 4% de la dosis diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar FEIBA NF
El polvo liofilizado FEIBA NF se disuelve en el disolvente adjunto y se administra por vía intravenosa. FEIBA NF debe ser utilizado estrictamente según las indicaciones de su médico. En caso de dudas, debe consultar a su médico o farmacéutico. El médico determina la dosis y la frecuencia de administración individualmente para cada paciente, teniendo en cuenta la gravedad del trastorno de coagulación, la ubicación y la extensión de la hemorragia, así como el estado general del paciente y su respuesta al medicamento. No debe cambiar la dosificación del medicamento establecida por su médico, ni interrumpir su administración. Si el paciente siente que el medicamento está actuando demasiado fuerte o demasiado débil, debe comunicarse con su médico o farmacéutico. Antes de la administración, debe calentar el medicamento a temperatura ambiente o temperatura corporal, si es necesario. FEIBA NF debe ser preparado justo antes de la administración. La solución preparada debe ser utilizada de inmediato (el medicamento no contiene conservantes). Mezcle suavemente con un movimiento rotativo hasta que el polvo se disuelva por completo. Asegúrese de que FEIBA NF se haya disuelto completamente; de lo contrario, menos unidades de FEIBA pasarán a través del filtro del dispositivo. No use la solución si está turbia o contiene sedimento. No use la solución de viales previamente abiertos. Use solo el disolvente proporcionado (agua estéril para inyección) y el conjunto para la preparación de la solución. Si se utiliza un conjunto diferente para la preparación y administración que el proporcionado con FEIBA NF, asegúrese de usar un filtro con un tamaño de poro de al menos 149 µm. No use el medicamento si el sistema de mantenimiento de la esterilidad o el paquete del medicamento están dañados o deteriorados. Anote la administración del medicamento en la etiqueta adhesiva adjunta. Todos los residuos no utilizados del medicamento o sus desechos deben ser eliminados de acuerdo con las regulaciones locales.
Administración con jeringa:
Debe seguir las reglas de asepsia durante todo el procedimiento.
- 1. Caliente el vial cerrado que contiene el disolvente (agua estéril para inyección) a temperatura ambiente, si es necesario, por ejemplo, usando un baño de agua durante unos minutos (máximo 37°C).
- 2. Retire las tapas protectoras de los viales que contienen el polvo y el disolvente, y desinfecte los tapones de goma de ambos viales.
- 3. Gire y retire la cubierta de la aguja de doble punta adjunta (fig. A) e inserte la punta expuesta en el tapón de goma del vial que contiene el disolvente (fig. B).
- 4. Retire la cubierta del otro extremo de la aguja de doble punta, teniendo cuidado de no tocar la parte expuesta.
- 5. Invierta el vial que contiene el disolvente sobre el vial que contiene el polvo y inserte el extremo libre de la aguja de doble punta en el tapón de goma del vial que contiene el polvo (fig. D). El disolvente será succionado hacia el vial que contiene el polvo por succión.
- 6. Separe los dos viales retirando la aguja del vial que contiene el polvo (fig. E). Agite suavemente o gire el vial que contiene el polvo para acelerar el proceso de disolución.
- 7. Después de que el polvo se haya disuelto, inserte la aguja con el dispositivo de ventilación (fig. F) y la espuma desaparecerá. Retire la aguja con el dispositivo de ventilación.
Administración/in fusión:
Debe seguir las reglas de asepsia durante todo el procedimiento.
- 1. Retire la cubierta de la aguja con filtro adjunta girándola y conecte la aguja a una jeringa estéril de un solo uso. Aspire la solución hacia la jeringa (fig. G).
- 2. Desconecte la aguja con filtro de la jeringa y, después de conectar el conjunto de infusión con la aguja de mariposa (o una aguja de inyección de un solo uso), inyecte la solución lentamente por vía intravenosa. Se puede utilizar una bomba de jeringa para controlar la velocidad de administración.
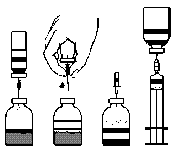
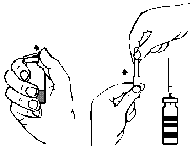
fig. A fig. B fig. C fig. D fig. E fig. F fig. G
Administración con BAXJECT II Hi-Flow
Preparación de la solución para inyección
Debe seguir las reglas de asepsia durante todo el procedimiento.
- 1. Lleve el vial que contiene el disolvente (agua estéril para inyección) a temperatura ambiente, si es necesario, por ejemplo, usando un baño de agua durante unos minutos (máximo 37°C).
- 2. Retire las tapas protectoras de los viales que contienen el polvo y el disolvente, y desinfecte los tapones de goma de ambos viales. Coloque los viales en una superficie plana.
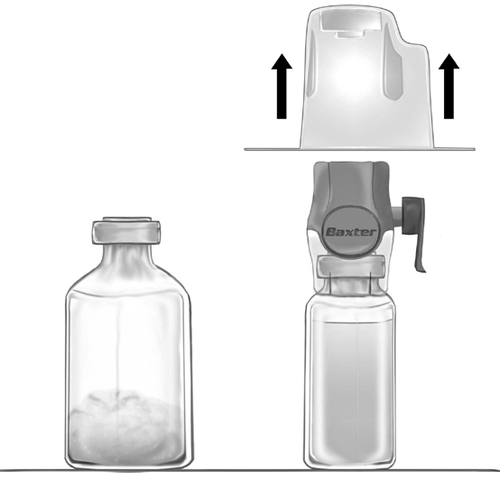
- 3. Abra el paquete del dispositivo BAXJECT II Hi-Flow retirando la tapa de papel, sin tocar el interior (fig. a). No retire el dispositivo del paquete.
- 4. Invierta el paquete y pase la punta de plástico transparente a través del tapón del vial que contiene el disolvente (fig. b). Sostenga el paquete por los bordes y retírelo del dispositivo BAXJECT II Hi-Flow (fig. c). No retire el tapón azul del dispositivo BAXJECT II Hi-Flow.
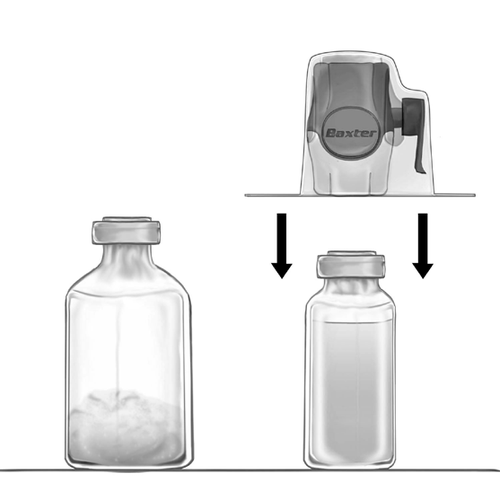
- 5. Conecte el dispositivo BAXJECT II Hi-Flow con el vial que contiene el disolvente e inviértalo de modo que el vial que contiene el disolvente esté sobre el dispositivo. Pase la punta blanca de plástico a través del tapón del vial que contiene el polvo FEIBA NF. El disolvente será succionado hacia el vial que contiene el polvo FEIBA NF por succión (fig. d).
- 6. Mezcle suavemente, con un movimiento rotativo, pero sin agitar, hasta que el producto se disuelva por completo. Asegúrese de que FEIBA NF se haya disuelto por completo; de lo contrario, el principio activo no pasará a través del filtro del dispositivo.
fig. a
fig. b
fig. c

Administración/in fusión
Debe seguir las reglas de asepsia durante todo el procedimiento
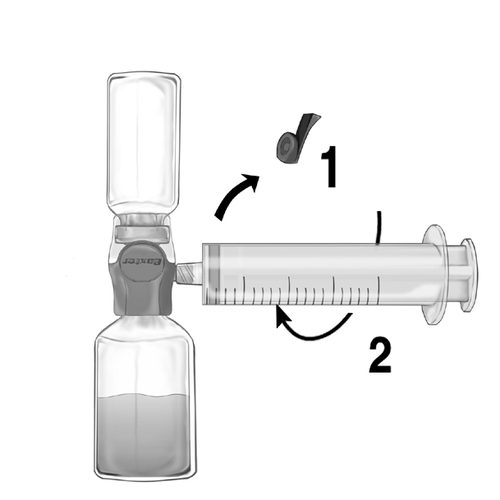
- 1. Retire el tapón azul del dispositivo BAXJECT II Hi-Flow. Conecte firmemente la jeringa al dispositivo BAXJECT II Hi-Flow (NO ASPIRE AIRE EN LA JERINGA) Para asegurar una conexión hermética entre la jeringa y el dispositivo BAXJECT II Hi-Flow, se recomienda especialmente el uso de una jeringa con conector de tipo luer (al conectar la jeringa, gírela en el sentido de las agujas del reloj hasta que se detenga) (fig. e).
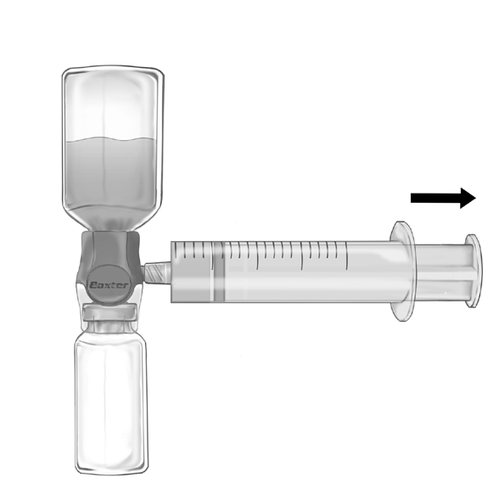
- 2. Invierta el conjunto de modo que la solución esté en la parte superior. Aspire la solución hacia la jeringa, PULLING lentamente el émbolo hacia atrás y asegurándose de que la conexión entre la jeringa y el dispositivo BAXJECT II Hi-Flow sea hermética y la jeringa esté sujeta durante todo el proceso de aspiración (fig. f).
- 3. Desconecte la jeringa.
- 4. Si se produce espuma en la jeringa, debe esperar hasta que la espuma desaparezca. Administre la solución lentamente por vía intravenosa usando el conjunto de infusión (o una aguja de inyección de un solo uso). Se puede utilizar una bomba de jeringa para controlar la velocidad de administración.
fig. d
fig. e
fig. f

No se debe exceder la velocidad de 2 unidades de FEIBA por kg de peso corporal por minuto.
En caso de sobredosis:
Debe informar inmediatamente a su médico. La sobredosis de FEIBA NF puede aumentar el riesgo de efectos adversos, como trastornos trombóticos (formación de coágulos de sangre que se desplazan en los vasos sanguíneos), coagulopatía de consumo (trastorno de la coagulación de la sangre) o infarto de miocardio.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Si se agrava alguno de los efectos adversos o si se producen efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico.
Se han utilizado las siguientes frecuencias para evaluar los efectos adversos:
Muy frecuentes: puede afectar a más de 1 de cada 10 personas
Frecuentes: puede afectar hasta 1 de cada 10 personas
Poco frecuentes: puede afectar hasta 1 de cada 100 personas
Raros: puede afectar a 1 de cada 1.000 personas
Muy raros: puede afectar a menos de 1 de cada 10.000 personas
Desconocidos: la frecuencia no puede ser estimada a partir de los datos disponibles
En los estudios clínicos, se han notificado los siguientes efectos adversos como frecuentes:
Hipersensibilidad,
Dolor de cabeza,
Mareo,
Hipotensión,
Erupción cutánea
Resultado positivo de anticuerpos contra el antígeno de superficie del virus de la hepatitis B.
En los estudios realizados después de la comercialización del medicamento, se han notificado los siguientes efectos adversos con una frecuencia desconocida:
Trastornos de la sangre y el sistema linfático: coagulación intravascular diseminada (CID); aumento del título de inhibidor
Trastornos del sistema inmunológico: reacciones alérgicas, erupción cutánea picazón en todo el cuerpo (urticaria)
Trastornos del sistema nervioso: sensación de entumecimiento en las extremidades (hormigueo), sensación anormal o disminuida (parestesia), accidente cerebrovascular (accidente cerebrovascular trombótico, accidente cerebrovascular embólico), somnolencia, trastornos del gusto
Trastornos cardíacos: infarto de miocardio (infarto de miocardio), palpitaciones (taquicardia)
Trastornos vasculares: formación de coágulos que se desplazan en los vasos sanguíneos (eventos trombóticos), aumento de la presión arterial (hipertensión), enrojecimiento repentino
Trastornos respiratorios, torácicos y mediastínicos: embolia pulmonar (tromboembolismo pulmonar), broncoespasmo (constricción de las vías respiratorias), respiración silbante, tos, falta de aliento (disnea)
Trastornos gastrointestinales: vómitos, diarrea, malestar abdominal, náuseas
Trastornos de la piel y el tejido subcutáneo: sensación de entumecimiento en la cara, hinchazón de la cara, la lengua y los labios (edema angioneurótico), erupción cutánea picazón en todo el cuerpo (urticaria), picazón (prurito)
Trastornos generales y en el lugar de administración: dolor en el lugar de administración, malestar general, sensación de calor, escalofríos, fiebre, dolor en el pecho, malestar en el pecho
Pruebas diagnósticas: caída de la presión arterial
La administración rápida por vía intravenosa puede causar un dolor punzante y entumecimiento en la cara y las extremidades, así como una caída de la presión arterial. Los infartos de miocardio han ocurrido después de la administración de dosis que exceden la dosis diaria máxima y (o) después de un uso prolongado y (o) en caso de factores de riesgo que predisponen a trastornos trombóticos.
Notificación de efectos adversos
Si se producen efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden ser notificados directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas Al. Jerozolimskie 181C 02-222 Varsovia Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Página web: https://smz.ezdrowie.gov.pl Los efectos adversos también pueden ser notificados al titular de la autorización de comercialización. Al notificar los efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar FEIBA NF
Conservar en un lugar fuera del alcance de los niños. No conservar a una temperatura superior a 25°C. No congelar. Conservar el medicamento en su embalaje original para protegerlo de la luz. No use FEIBA NF después de la fecha de caducidad impresa en el embalaje. La fecha de caducidad es el último día del mes indicado. No deseche los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene FEIBA NF?
Polvo
- El principio activo es factor VIII con actividad que evita el inhibidor. 1 vial contiene 500 UI de factor VIII con actividad que evita el inhibidor en 200-600 mg de proteína del plasma humano.
- FEIBA NF también contiene factores II, IX y X, principalmente en forma no activada, así como factor VII activado. El antígeno coagulante del factor VIII (F VIII C:Ag) y los factores del sistema calicreína-quinina están presentes solo en cantidades trazas o no están presentes en absoluto.
- Los demás componentes del medicamento son cloruro de sodio y citrato de sodio
Disolvente
- Agua para inyección
Cómo se presenta FEIBA NF y qué contiene el paquete?
El medicamento se presenta en forma de polvo liofilizado o sustancia sólida fina de color blanco o verde pálido. El polvo y el disolvente se suministran en viales de vidrio cerrados con tapones de goma. El pH de la solución después de la reconstitución es de 6,8 a 7,6.
Tamaño del paquete: 1 conjunto
Contenido del paquete (con agujas):
1 vial con 500 UI de FEIBA NF, cerrado con un tapón de goma
1 vial con 20 ml de agua para inyección, cerrado con un tapón de goma
1 aguja de doble punta
1 aguja con dispositivo de ventilación
1 jeringa de un solo uso
1 aguja para inyección
1 aguja con filtro
1 aguja de mariposa (conjunto de infusión con aguja de mariposa)
Contenido del paquete (con BAXJECT II Hi-Flow):
1 vial con 500 UI de FEIBA NF, cerrado con un tapón de goma
1 vial con 20 ml de agua para inyección, cerrado con un tapón de goma
1 BAXJECT II Hi-Flow - dispositivo de transferencia sin aguja para transferir y mezclar medicamentos en dos viales
1 jeringa de un solo uso
1 aguja para inyección
1 aguja de mariposa (conjunto de infusión con aguja de mariposa)
Titular de la autorización de comercialización y fabricante:
Titular de la autorización de comercialización:
Takeda Pharma Sp. z o.o. ul. Prosta 68 00-838 Varsovia
Fabricante:
Baxter AG, Industriestrasse 67, A-1220 Viena, Austria Takeda Manufacturing Austria AG, Industriestrasse 67, 1221 Viena, Austria
Fecha de la última actualización de la hoja de instrucciones:
-----------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
El tratamiento debe ser iniciado y supervisado por un médico con experiencia en el tratamiento de la hemofilia.
Dosificación
La dosificación y la duración del tratamiento dependen de la gravedad del trastorno de coagulación, la ubicación y la extensión de la hemorragia, así como del estado clínico del paciente. La dosis, así como la frecuencia de administración, deben estar siempre orientadas a la eficacia clínica en cada caso. En general, se recomienda una dosis de 50-100 UI de FEIBA por kg de peso corporal, sin embargo, no se debe exceder la dosis única de 100 UI/kg de peso corporal, ni la dosis diaria máxima de 200 UI/kg de peso corporal, a menos que la gravedad de la hemorragia requiera y justifique el uso de dosis más altas. Debido a factores específicos del paciente, la respuesta a la actividad que evita el inhibidor del factor VIII puede variar, y en un caso determinado de hemorragia en un paciente en el que la respuesta a uno de los factores es insuficiente, debe considerarse el uso de otro factor. Niños y adolescentesLa experiencia con el uso en niños menores de 6 años es limitada; el esquema de dosificación es el mismo que para los adultos, debe adaptarse al estado clínico del niño.
- 1)
Hemorragias espontáneas
Hemorragias en las articulaciones, los músculos y los tejidos blandos
En caso de hemorragias pequeñas o moderadas, se recomienda una dosis de 50-75 UI/kg cada 12 horas. El tratamiento debe continuar hasta que se observe una mejora clínica significativa, como la desaparición del dolor, la reducción del edema o la movilización de la articulación. En caso de hemorragias grandes en los músculos y los tejidos blandos, como las hemorragias en el espacio retroperitoneal, se recomienda una dosis de 100 UI/kg cada 12 horas.
Hemorragias de las membranas mucosas
Se recomienda una dosis de 50 UI/kg cada 6 horas, con una observación cuidadosa del paciente (observación de la superficie hemorrágica, pruebas de hematocrito repetidas en el paciente). Si la hemorragia no se detiene, la dosis puede ser aumentada a 100 UI/kg. No se debe exceder la dosis diaria máxima de 200 UI/kg.
Otras hemorragias graves
En caso de hemorragias graves, como las hemorragias en el sistema nervioso central, se recomienda una dosis de 100 UI/kg cada 12 horas. En casos individuales, se puede administrar FEIBA NF cada 6 horas hasta que se observe una mejora clínica significativa. No se debe exceder la dosis diaria máxima de 200 UI/kg.
- 2)
Procedimientos quirúrgicos
Administre 50-100 UI/kg cada 6 horas, teniendo en cuenta que no se exceda la dosis diaria máxima.
- 3)
Profílaxis
- Tratamiento profiláctico de hemorragias en pacientes con un título de inhibidor alto y hemorragias frecuentes, en los que la inducción de la tolerancia inmunológica (ITI) no ha sido exitosa o no se considera: se recomienda una dosis de 70-100 UI/kg cada 2 días. Si la hemorragia del paciente no se detiene, la dosis puede ser aumentada a 100 UI/kg administrados diariamente, o reducida gradualmente.
- Tratamiento profiláctico de hemorragias en pacientes con un título de inhibidor alto durante la inducción de la tolerancia inmunológica (ITI): FEIBA NF puede ser administrado en combinación con concentrados de factor VIII, en dosis de 50-100 UI/kg dos veces al día, hasta que el título de inhibidor del factor VIII disminuya a <2 ui ml*.< li>
Monitoreo
Debido a su mecanismo de acción complejo, no hay un método directo para monitorear los principios activos. Las pruebas de coagulación, como el tiempo de coagulación de la sangre (WBCT), el tromboelastograma (TEG, r-índice) y el aPTT, generalmente muestran cambios pequeños y pueden no reflejar la mejora clínica. Por lo tanto, estas pruebas tienen un valor muy limitado en el monitoreo del tratamiento con FEIBA NF.
Vía de administración
FEIBA NF debe ser administrado lentamente por vía intravenosa (no más rápido que 2 UI/kg de peso corporal por minuto). FEIBA NF debe ser preparado justo antes de la administración. La solución debe ser utilizada de inmediato (no contiene conservantes). No use la solución si está turbia o contiene sedimento. Los residuos no utilizados de la solución deben ser eliminados de acuerdo con el procedimiento vigente.
Monitoreo del tratamiento
No se debe exceder la dosis única de 100 UI/kg de peso corporal, ni la dosis diaria máxima de 200 UI/kg de peso corporal. Los pacientes que reciben más de 100 UI/kg de peso corporal deben ser monitoreados para detectar la coagulación intravascular diseminada (CID) y (o) la enfermedad coronaria aguda. Las dosis altas de FEIBA NF solo deben ser administradas durante el período necesario para detener la hemorragia. En caso de cambios significativos en la presión arterial, la frecuencia cardíaca, la respiración, el dolor en el pecho y la tos, debe interrumpir inmediatamente la administración del medicamento y aplicar las medidas diagnósticas y terapéuticas adecuadas. Los resultados de laboratorio que indican CID son: disminución de la fibrinogenemia, disminución del recuento de plaquetas y presencia de productos de degradación de la fibrina/fibrinógeno (FDP). Otros signos de CID son el prolongamiento significativo del tiempo de trombina, protrombina o aPTT. En pacientes con hemofilia con inhibidor o con inhibidores adquiridos de factores de coagulación, el aPTT puede estar prolongado debido al propio trastorno de coagulación. La administración de FEIBA NF a pacientes con inhibidores puede dar lugar a un aumento inicial del título de inhibidor. Bajo la administración continua de FEIBA NF, el título de inhibidor puede disminuir con el tiempo. Los datos clínicos y de la literatura indican que la eficacia de FEIBA NF no se reduce. Durante la administración de FEIBA NF, en pacientes con hemofilia con inhibidor o con inhibidores adquiridos de factores de coagulación, puede ocurrir una tendencia simultánea a hemorragias y un mayor riesgo de trombosis.
Pruebas de laboratorio y eficacia clínica
Los resultados de las pruebas de laboratorio in vitro para evaluar la eficacia del tratamiento, como el aPTT, el tiempo de coagulación de la sangre y el tromboelastograma (TEG), pueden no reflejar la mejora clínica. Por lo tanto, los intentos de restaurar los valores normales de estos parámetros mediante el aumento de las dosis de FEIBA NF pueden ser engañosos y deben ser evitados debido al riesgo de CID causado por la sobredosis.
Importancia del recuento de plaquetas
En caso de respuesta insuficiente al tratamiento con FEIBA NF, se recomienda determinar el recuento de plaquetas, ya que se requiere un número suficiente de plaquetas funcionales para la eficacia de FEIBA NF.
Información adicional sobre el dispositivo Baxject II Hi-Flow:
- El dispositivo está esterilizado por radiación gamma.
- Para uso único.
- No contiene látex.

No use en caso de daño en el paquete. BAXJECT y FEIBA son marcas registradas de Baxalta Incorporated.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Feiba NfForma farmacéutica: Polvo, 1000 UI (1000 UI FEIBA), 50 UI/mlPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere recetaForma farmacéutica: Polvo, 500 UI (500 UI FEIBA), 50 UI/mlPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere recetaForma farmacéutica: Polvo, 2500 UI (2500 UI FEIBA), 50 UI/mlPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere receta
Alternativas a Feiba Nf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Feiba Nf en España
Médicos online para Feiba Nf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Feiba Nf – sujeta a valoración médica y normativa local.














