

Feiba Nf

Consulta con un médico sobre la receta médica de Feiba Nf

Cómo usar Feiba Nf
Hoja de instrucciones del paquete: información para el usuario
FEIBA NF, 500 UI (50 UI/ml), polvo y disolvente para preparar una solución para inyección
Conjunto de factores de coagulación contra el inhibidor del factor VIII
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es FEIBA NF y para qué se utiliza
- 2. Información importante antes de usar FEIBA NF
- 3. Cómo usar FEIBA NF
- 4. Posibles efectos adversos
- 5. Cómo conservar FEIBA NF
- 6. Contenido del paquete y otra información
1. Qué es FEIBA NF y para qué se utiliza
FEIBA NF es un medicamento obtenido del plasma humano que permite la coagulación de la sangre en caso de deficiencia o ausencia de algunos factores de coagulación.
FEIBA NF se utiliza para tratar y prevenir hemorragias en pacientes con hemofilia A complicada con la presencia de inhibidores del factor VIII y con hemofilia B complicada con la presencia de inhibidores del factor IX.
Además, FEIBA NF puede ser utilizado para tratar y prevenir hemorragias en personas que no padecen hemofilia pero tienen inhibidores adquiridos de los factores VIII, IX y XI.
FEIBA NF también se utiliza en combinación con concentrado de factor VIII durante el tratamiento a largo plazo para eliminar completamente y de manera permanente los inhibidores del factor VIII, lo que permite el tratamiento regular con concentrado de factor VIII, al igual que en pacientes sin inhibidores.
En casos aislados, se ha utilizado FEIBA NF en pacientes con inhibidor del factor de von Willebrand.
2. Información importante antes de usar FEIBA NF
Debe informar a su médico si tiene alguna alergia.
Debe informar a su médico si está siguiendo una dieta baja en sodio.
Cuándo no usar FEIBA NF
En las siguientes situaciones, no debe usar FEIBA NF, a menos que no haya otra opción de tratamiento:
- si el paciente es alérgico al conjunto de factores de coagulación contra el inhibidor del factor VIII o a cualquier otro componente de este medicamento (enumerados en el punto 6).
- si el paciente tiene coagulación intravascular diseminada (CID, coagulopatía de consumo, estado que amenaza la vida, asociado con coagulación masiva de la sangre con formación de coágulos en los vasos). Esto conduce a un agotamiento general de los factores de coagulación.
- si el paciente tiene trombosis o embolia aguda (incluyendo infarto de miocardio).
Véase el punto "Advertencias y precauciones".
Advertencias y precauciones
Antes de comenzar a usar FEIBA NF, debe discutirlo con su médico.
Este medicamento puede causar reacciones de hipersensibilidad de tipo alérgico, que incluyen urticaria, angioedema, síntomas gastrointestinales, espasmo bronquial y hipotensión; estas reacciones pueden ser graves y sistémicas (por ejemplo, reacción anafiláctica con urticaria y angioedema, espasmo bronquial y shock circulatorio). También se han informado otras reacciones relacionadas con la infusión, como escalofríos, fiebre y hipertensión.
Si aparecen los primeros signos o síntomas de reacción a la infusión/reacción de hipersensibilidad (véase el punto 4), debe interrumpir la administración de este medicamento y comenzar la atención médica adecuada.
En caso de que el paciente tenga sospecha de hipersensibilidad al medicamento o a alguno de sus componentes, el médico decidirá sobre la readministración de FEIBA NF solo después de una evaluación cuidadosa del riesgo y los beneficios esperados y (o) cuando no se puedan esperar resultados del tratamiento con otra terapia preventiva o medidas alternativas.
Durante el tratamiento con FEIBA NF, se han producido trastornos tromboembólicos, incluyendo coagulación intravascular diseminada (CID), trombosis venosa, embolia pulmonar, infarto de miocardio y accidente cerebrovascular.
Si aparecen los primeros signos o síntomas de trastornos tromboembólicos (véase el punto 4), debe interrumpir la infusión de inmediato y comenzar las medidas diagnósticas y terapéuticas adecuadas.
Algunos trastornos tromboembólicos se han producido en casos de administración de dosis altas de FEIBA NF o en pacientes con otros factores de riesgo que predisponen a trastornos tromboembólicos, incluyendo CID, enfermedad coronaria avanzada, trauma contuso o sepsis. La administración concomitante de factor VIIa recombinante puede aumentar el riesgo de trastornos tromboembólicos. En pacientes con hemofilia congénita o adquirida, siempre debe considerarse la posibilidad de que estén presentes estos factores de riesgo.
El medicamento debe usarse con precaución en pacientes con riesgo de CID, trombosis arterial o venosa.
Se han informado casos de microangiopatía trombótica en un estudio clínico de emicizumab, en el que los pacientes recibieron FEIBA NF como parte del esquema de tratamiento de hemorragia de ruptura.
En pacientes con hemofilia y presencia de inhibidores o inhibidores adquiridos de factores de coagulación, durante el tratamiento con FEIBA NF puede ocurrir una tendencia aumentada a hemorragias y, al mismo tiempo, un riesgo aumentado de trombosis.
- Coagulación intravascular diseminada (CID).
- Daño hepático: debido a la eliminación retardada de factores de coagulación activos en pacientes con función hepática alterada, existe un riesgo aumentado de CID.
- Enfermedad coronaria, trombosis aguda y (o) embolia. Véase el punto "Cuándo no usar FEIBA NF".
En el caso de medicamentos producidos a partir de sangre o plasma humano, se toman medidas para prevenir infecciones transmitidas a los pacientes. Estas medidas incluyen la selección cuidadosa de donantes de sangre y plasma para asegurarse de que aquellos que están en grupos de riesgo de transmisión de infecciones sean excluidos, así como la verificación de muestras individuales de sangre donada y de plasma recolectado para detectar virus/infecciones. Los fabricantes de estos productos también incorporan etapas en el proceso de tratamiento de la sangre y el plasma para inactivar o eliminar virus. A pesar de estas medidas, no se puede excluir completamente la posibilidad de transmisión de infecciones en el caso de la administración de medicamentos producidos a partir de sangre o plasma humano. Esto incluye virus desconocidos o recientemente descubiertos u otros tipos de infecciones.
Las medidas tomadas se consideran efectivas contra virus con envoltura, como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, así como contra el virus de la hepatitis A sin envoltura. Las medidas tomadas pueden tener un valor limitado contra virus sin envoltura, como el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección del feto) y en personas con deficiencia de inmunidad o con eritropoyesis aumentada (por ejemplo, anemia hemolítica).
En pacientes que reciben regularmente o en varias ocasiones factor VIII obtenido de plasma humano, debe considerarse la administración de vacunas adecuadas (contra la hepatitis A y B).
Después de la administración de dosis altas de FEIBA NF, puede ocurrir un aumento transitorio de anticuerpos pasivamente transferidos contra el antígeno de superficie del virus de la hepatitis B, lo que puede resultar en resultados falsos positivos de las pruebas serológicas.
El medicamento contiene isoaglutininas, anticuerpos contra glóbulos rojos, que pueden influir en los resultados de las pruebas serológicas para detectar anticuerpos contra glóbulos rojos, como la prueba de antiglobulina (prueba de Coombs).
En cada administración de una dosis de FEIBA NF, debe registrarse claramente el nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados.
FEIBA NF y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté tomando actualmente o recientemente, incluso aquellos que se pueden obtener sin receta.
No se han realizado estudios adecuados y bien controlados sobre el tratamiento combinado o secuencial con FEIBA NF y factor VIIa recombinante, medicamentos que inhiben la fibrinolisis o emicizumab (véase "Advertencias y precauciones").
Debe considerarse la posibilidad de incidentes tromboembólicos en caso de uso concomitante de medicamentos que inhiben la fibrinolisis de manera sistémica, como el ácido tranexámico y el ácido aminocaproico, en combinación con FEIBA NF. Por lo tanto, los medicamentos que inhiben la fibrinolisis no deben usarse durante aproximadamente 6 a 12 horas después de la administración de FEIBA NF.
Con respecto a los datos disponibles de estudios in vitro y observaciones clínicas, en caso de uso concomitante de factor VIIa recombinante, no se puede excluir la posibilidad de una interacción medicamentosa que pueda resultar en un incidente tromboembólico.
Si se considera el tratamiento con FEIBA NF después de que el paciente haya recibido emicizumab, el paciente debe ser monitoreado estrechamente por el médico que lo atiende.
Al igual que con todos los productos medicamentosos de factores de coagulación, no debe mezclarse FEIBA NF con otros medicamentos antes de la administración; esto puede afectar negativamente la eficacia y la seguridad del medicamento.
Se recomienda que antes y después de la administración de FEIBA NF, se enjuague la vía de administración con una solución salina isotónica.
Embarazo, lactancia y fertilidad
El médico decidirá si se puede usar FEIBA NF durante el embarazo o la lactancia. Debido al aumento del riesgo de trombosis durante el embarazo, FEIBA NF debe usarse solo bajo control médico estricto y cuando esté claramente indicado.
Con respecto al riesgo de infección por parvovirus B19, véase "Advertencias y precauciones".
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto en la capacidad de conducir vehículos o usar máquinas.
FEIBA NF contiene sodio
El medicamento contiene 40 mg de sodio (principal componente de la sal común) en cada ampolla. Esto corresponde al 2% de la dosis diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar FEIBA NF
El polvo liofilizado FEIBA NF se disuelve en el disolvente adjunto y se administra por vía intravenosa.
Este medicamento siempre debe usarse según las indicaciones de su médico. En caso de duda, debe consultar a su médico o farmacéutico.
El tratamiento debe iniciarse y supervisarse por un médico con experiencia en el tratamiento de trastornos de coagulación.
El médico determinará la dosis y la frecuencia de administración individualmente para cada paciente, teniendo en cuenta la gravedad del trastorno de coagulación, la ubicación y la extensión de la hemorragia, así como el estado general del paciente y su respuesta al medicamento. No debe cambiar la dosificación del medicamento establecida por su médico, ni interrumpir su administración.
Si el paciente siente que el medicamento está actuando demasiado fuerte o demasiado débil, debe comunicarse con su médico o farmacéutico.
Antes de la administración, debe calentar el medicamento a temperatura ambiente o a la temperatura del cuerpo, si es necesario.
FEIBA NF debe prepararse solo inmediatamente antes de la administración.
La solución preparada debe usarse de inmediato (el medicamento no contiene conservantes).
Debe mezclar suavemente con un movimiento rotatorio hasta que el polvo se disuelva. Debe asegurarse de que FEIBA NF se haya disuelto completamente; de lo contrario, menos unidades de FEIBA pasarán a través del filtro del dispositivo.
No debe usar la solución si está turbia o contiene sedimento. No debe usar la solución de ampollas previamente abiertas.
Debe usar solo el disolvente proporcionado (agua para inyección) y el conjunto para preparar la solución.
Si se utiliza un conjunto diferente para preparar y administrar que el proporcionado con FEIBA NF, debe asegurarse de que se use un filtro con un tamaño de poro de al menos 149 µm.
No debe usar si el sistema de mantenimiento de la esterilidad o el paquete del medicamento están dañados o deteriorados.
Debe registrar la administración del medicamento en la etiqueta adhesiva adjunta.
Debe eliminar cualquier residuo no utilizado del medicamento o sus desechos de acuerdo con las regulaciones locales.
Administración con aguja:
Preparación de la solución para inyección
Debe seguir las normas de asepsia durante todo el procedimiento.
- 1. Calentar la ampolla cerrada que contiene el disolvente (agua para inyección) a temperatura ambiente, si es necesario, por ejemplo, usando un baño de agua durante unos minutos (máximo 37°C).
- 2. Retirar las tapas protectoras de las ampollas que contienen el polvo y el disolvente (fig. A) y desinfectar los tapones de goma de ambas ampollas.
- 3. Girando y tirando, retirar la cubierta de un extremo de la aguja de doble punta adjunta (fig. B). Introducir la punta expuesta de la aguja en el tapón de goma de la ampolla que contiene el disolvente (fig. C).
- 4. Retirar la cubierta del otro extremo de la aguja de doble punta, teniendo cuidado de no tocar la parte expuesta.
- 5. Invertir la ampolla que contiene el disolvente hacia abajo sobre la ampolla que contiene el polvo y introducir el extremo libre de la aguja de doble punta en el tapón de goma de la ampolla que contiene el polvo (fig. D). El disolvente será succionado hacia la ampolla que contiene el polvo por succión.
- 6. Separar las dos ampollas retirando la aguja de la ampolla que contiene el polvo (fig. E). Agitar suavemente o girar la ampolla que contiene el polvo para acelerar el proceso de disolución.
- 7. Después de que el polvo se haya disuelto, introducir la aguja con el dispositivo de ventilación (fig. F) y la espuma desaparecerá. Retirar la aguja con el dispositivo de ventilación.
Inyección/infusión
Debe seguir las normas de asepsia durante todo el procedimiento.
- 1. Retirar la cubierta de la aguja adjunta con filtro, girándola y desenroscándola. Colocar la aguja en una jeringa estéril de un solo uso. Aspirar la solución a la jeringa (fig. G).
- 2. Desconectar la aguja con filtro de la jeringa y, después de colocar el conjunto de infusión adjunto con aguja de mariposa (o aguja de inyección de un solo uso), inyectar la solución lentamente por vía intravenosa. Para controlar la velocidad de administración, puede usarse una bomba de jeringa.
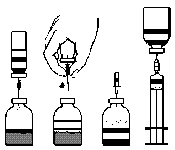
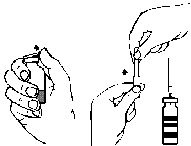
fig. A fig. B fig. C fig. D fig. E fig. F fig. G
No debe exceder la velocidad de 2 unidades de FEIBA por kg de peso corporal por minuto. Administración con BAXJECT II Hi-Flow:
Preparación de la solución para inyección
Debe seguir las normas de asepsia durante todo el procedimiento.
- 1. Llevar la ampolla que contiene el disolvente (agua para inyección) a temperatura ambiente, si es necesario, por ejemplo, usando un baño de agua durante unos minutos (máximo 37°C).
- 2. Retirar las tapas protectoras de las ampollas que contienen el polvo y el disolvente y desinfectar los tapones de goma de ambas ampollas. Colocar las ampollas en una superficie plana.
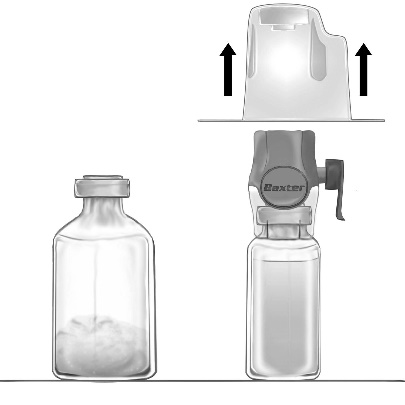
- 3. Abrir el paquete del dispositivo BAXJECT II Hi-Flow retirando la tapa de papel, sin tocar el interior (fig. a). No retirar el dispositivo del paquete.
- 4. Girar el paquete hacia abajo y perforar la punta de plástico transparente a través del tapón de la ampolla que contiene el disolvente (fig. b). Sostener el paquete por los bordes y retirarlo del dispositivo BAXJECT II Hi-Flow (fig. c). No retirar el tapón azul del dispositivo BAXJECT II Hi-Flow.
BAXJECT II Hi-Flow (fig. c)
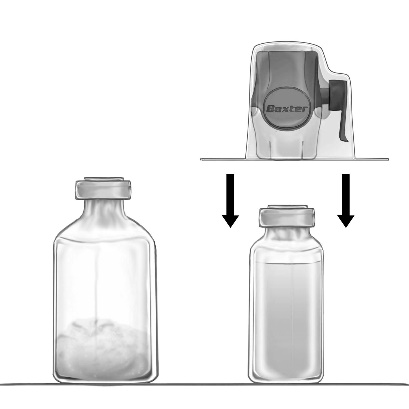
- 5. Conectar el dispositivo BAXJECT II Hi-Flow con la ampolla que contiene el disolvente, invirtiendo la ampolla de modo que el dispositivo BAXJECT II Hi-Flow quede sobre la ampolla. Perforar la punta de plástico morado a través del tapón de la ampolla que contiene el polvo FEIBA NF. El disolvente será succionado hacia la ampolla que contiene el polvo FEIBA NF por succión (fig. d).
- 6. Mezclar suavemente con un movimiento rotatorio, pero sin agitar, hasta que el producto se disuelva completamente. Debe asegurarse de que FEIBA NF se haya disuelto completamente; de lo contrario, la sustancia activa no pasará a través del filtro del dispositivo.
fig. a
fig. b
fig. c

Inyección/infusión
Debe seguir las normas de asepsia durante todo el procedimiento.
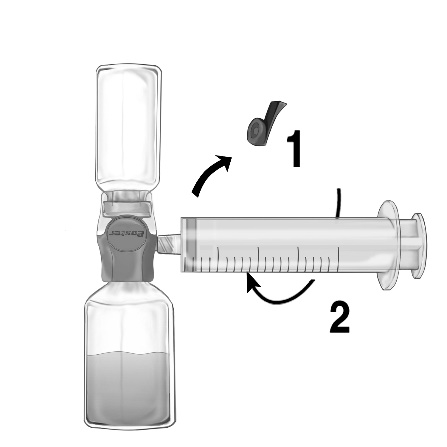
- 1. Retirar el tapón azul del dispositivo BAXJECT II Hi-Flow. Conectar estrechamente la jeringa con el dispositivo BAXJECT II Hi-Flow (NO ASPIRAR AIRE A LA JERINGA) Para asegurar una conexión hermética entre la jeringa y el dispositivo BAXJECT II Hi-Flow, se recomienda especialmente el uso de una jeringa con conector de tipo luer (al conectar la jeringa, girarla en el sentido de las agujas del reloj hasta que se detenga) (fig. e).
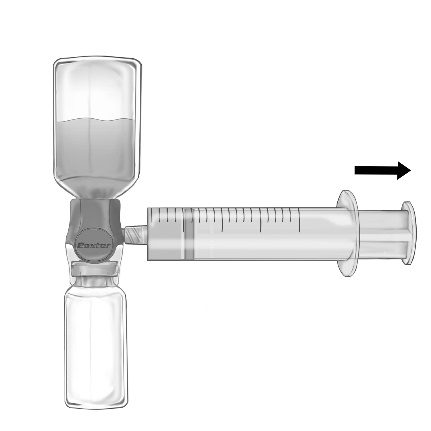
- 2. Invertir el conjunto de modo que la solución quede en la parte superior. Aspirar la solución a la jeringa, PULLANDO LENTAMENTE el émbolo hacia atrás y asegurándose de que la conexión entre la jeringa y el dispositivo BAXJECT II Hi-Flow sea hermética y la jeringa esté sujeta durante todo el tiempo de aspiración de la solución (fig. f).
- 3. Desconectar la jeringa.
- 4. Si aparece una solución espumosa en la jeringa, debe esperar hasta que la espuma desaparezca. Administrar la solución lentamente por vía intravenosa usando el conjunto de infusión (o aguja de inyección de un solo uso). Para controlar la velocidad de administración, puede usarse una bomba de jeringa.
fig. d
fig. e
fig. f

No debe exceder la velocidad de 2 unidades de FEIBA por kg de peso corporal por minuto.
Uso de una dosis mayor de la recomendada de FEIBA NF
Debe informar a su médico de inmediato. La sobredosis de FEIBA NF puede aumentar el riesgo de efectos adversos, como trastornos tromboembólicos (formación de coágulos de sangre que se desplazan en los vasos sanguíneos), coagulopatía de consumo (trastorno de la coagulación de la sangre) o infarto de miocardio.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe comunicarse con su médico de inmediatosi experimenta alguno de los siguientes síntomas:
- reacciones de hipersensibilidad: erupciones, erupciones pruriginosas (urticaria), picazón, edema de los labios y la lengua, respiración silbante, sensación de opresión en el pecho, síntomas gastrointestinales, mareos, caída repentina de la presión arterial, escalofríos, fiebre, hipertensión
- coagulación intravascular diseminada (CID): moretones que aparecen espontáneamente, equimosis, hemorragias intensas y simultáneas (por ejemplo, de heridas, sitios de punción, mucosas, tracto genital), fallo de órganos debido a su falta de riego sanguíneo (en el caso de los riñones, por ejemplo, anuria o oliguria; en los pulmones, dificultad para respirar, tos, hemoptisis; en el cerebro, trastornos de la orientación y problemas de concentración, convulsiones, trastornos de la conciencia, coma)
- trombosis venosa: dolor y edema de un miembro, generalmente unilateral, aumento de la temperatura de la extremidad, estado de subfebrilidad o fiebre
- embolia pulmonar: cambios significativos en la presión arterial o la frecuencia cardíaca, dificultad para respirar, tos o dolor en el pecho
- infarto de miocardio: dolor en el pecho que puede irradiar al hombro izquierdo o al brazo, a la mandíbula, al abdomen o a la espalda; dificultad para respirar, palpitaciones, mareos, pérdida de conocimiento, debilidad, ansiedad, temor
- accidente cerebrovascular: dolor de cabeza intenso y repentino, trastornos de la visión, caída unilateral de la comisura de los labios, dificultad para tragar y hablar, trastornos de la coordinación y el equilibrio, somnolencia, desorientación, pérdida de conciencia
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Hipersensibilidad
- Dolor de cabeza, mareos
- Hipotensión
- Erupciones
- Resultado positivo de anticuerpos contra el antígeno de superficie del virus de la hepatitis B, aumento de la concentración de D-dímeros de fibrina
Efectos adversos de frecuencia desconocida (no puede determinarse a partir de los datos disponibles):
- Coagulación intravascular diseminada (CID), aumento del título del inhibidor
- Reacción anafiláctica (reacción de hipersensibilidad que comienza rápidamente y es potencialmente mortal), erupción pruriginosa generalizada (urticaria)
- Sensación de entumecimiento de las extremidades (hormigueo), sensación anormal o disminuida (parestesia), accidente cerebrovascular (accidente cerebrovascular isquémico, accidente cerebrovascular embólico), somnolencia, trastornos del gusto
- Infarto de miocardio (ataque al corazón), palpitaciones
- Formación de coágulos (trombosis venosa, trombosis arterial), que se desplazan en los vasos sanguíneos (eventos tromboembólicos), aumento de la presión arterial (hipertensión), enrojecimiento repentino
- Embolia pulmonar (tromboembolismo pulmonar), estrechamiento de las vías respiratorias (broncoespasmo), silbido al respirar, tos, dificultad para respirar (disnea)
- Vómitos, diarrea, malestar abdominal, náuseas
- Sensación de entumecimiento de la cara, edema de la cara, la lengua y los labios (edema angioneurótico), erupción pruriginosa generalizada (urticaria), picazón (prurito)
- Dolor en el lugar de la inyección, malestar general, sensación de calor, escalofríos, fiebre, dolor en el pecho, malestar en el pecho
- Caida de la presión arterial
Los síntomas de reacción de hipersensibilidad después de la administración de medicamentos obtenidos de plasma humano también incluyen coma y ansiedad.
Notificación de efectos adversos
Si experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar FEIBA NF
Debe conservar el medicamento en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe conservar a una temperatura superior a 25°C. No debe congelar.
Debe conservar el medicamento en el paquete exterior para protegerlo de la luz.
No debe usar este medicamento después de la fecha de caducidad indicada en el paquete.
La fecha de caducidad es el último día del mes indicado.
No debe desechar los medicamentos por el desagüe o en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene FEIBA NF?
Polvo
- El principio activo es un conjunto de factores de coagulación contra el inhibidor del factor VIII. Después de la reconstitución en 10 ml del disolvente adjunto (agua para inyección), 1 ml contiene aproximadamente 50 UI del conjunto de factores de coagulación contra el inhibidor del factor VIII. 1 ampolla contiene 500 UI de factor VIII con actividad que omite el inhibidor en 200-600 mg de proteína del plasma humano.
- FEIBA NF también contiene factores II, IX y X, principalmente en forma no activada, así como factor VII activado. El antígeno coagulante del factor VIII (F VIII C:Ag) está presente en una concentración de hasta 0,1 UI por 1 UI de FEIBA. Los factores del sistema calicreína-quinina están presentes solo en cantidades trazas o no están presentes en absoluto.
- Los demás componentes del medicamento son cloruro de sodio y citrato de sodio.
Disolvente
- Agua para inyección
Cómo se presenta FEIBA NF y qué contiene el paquete?
El medicamento se presenta en forma de polvo liofilizado o sustancia sólida fina de color blanco o verde pálido.
El polvo y el disolvente se suministran en ampollas de vidrio cerradas con tapones de goma.
El pH de la solución después de la reconstitución es de 6,8 a 7,6.
Tamaño del paquete: 1 conjunto
Contenido del paquete (con agujas):
1 ampolla que contiene 500 UI de FEIBA NF, cerrada con un tapón de goma
1 ampolla que contiene 10 ml de agua para inyección, cerrada con un tapón de goma
1 aguja de doble punta
1 aguja con dispositivo de ventilación
1 jeringa de un solo uso
1 aguja para inyección
1 aguja con filtro
1 aguja de mariposa (conjunto de infusión con aguja de mariposa)
Contenido del paquete (con BAXJECT II Hi-Flow):
1 ampolla que contiene 500 UI de FEIBA NF, cerrada con un tapón de goma
1 ampolla que contiene 10 ml de agua para inyección, cerrada con un tapón de goma
1 BAXJECT II Hi-Flow - dispositivo de transferencia sin aguja, para transferir y mezclar medicamentos contenidos en dos ampollas
1 jeringa de un solo uso
1 aguja para inyección
1 aguja de mariposa (conjunto de infusión con aguja de mariposa)
Título del responsable y fabricante
Responsable:
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Varsovia
Tel: +48 22 306 24 47
[email protected]
Fabricante:
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena, Austria
Fecha de la última actualización de la hoja de instrucciones:
-----------------------------------------------------------------------------------------------------------------
Información destinada solo al personal médico especializado:
El tratamiento debe iniciarse y supervisarse por un médico con experiencia en el tratamiento de la hemofilia.
Dosificación
La dosis y la duración del tratamiento dependen de la gravedad del trastorno de coagulación, la ubicación y la extensión de la hemorragia, así como del estado clínico del paciente.
La dosis, así como la frecuencia de administración, deben estar siempre orientadas a la eficacia clínica en cada caso.
En general, se recomienda una dosis de 50-100 UI de FEIBA por kg de peso corporal, aunque no debe exceder la dosis única de 100 UI/kg de peso corporal, ni la dosis diaria máxima de 200 UI/kg de peso corporal, a menos que la gravedad de la hemorragia justifique y requiera el uso de dosis más altas.
Debido a factores específicos del paciente, la respuesta al conjunto de factores con actividad que omite el inhibidor del factor VIII puede variar, y en un caso determinado de hemorragia en un paciente que responde insuficientemente a uno de los factores, debe considerarse el uso de otro factor.
Niños y adolescentes
La experiencia con el uso en niños menores de 6 años es limitada; el esquema de dosificación, igual que para los adultos, debe adaptarse al estado clínico del niño.
- 1)
Hemorragias espontáneas
Hemorragias en las articulaciones, los músculos y los tejidos blandos
En casos de hemorragias pequeñas o moderadas, se recomienda una dosis de 50-75 UI/kg cada 12 horas. El tratamiento debe continuar hasta que se observe una mejora clínica significativa, como la desaparición del dolor, la reducción del edema o la movilidad de la articulación.
En casos de hemorragias grandes en los músculos y los tejidos blandos, como las hemorragias en el espacio retroperitoneal, se recomienda una dosis de 100 UI/kg cada 12 horas.
Hemorragias de las mucosas
Se recomienda una dosis de 50 UI/kg cada 6 horas, con una observación cuidadosa del paciente (observación de la superficie hemorrágica, recuento de hematocrito repetido en el paciente). Si la hemorragia no cesa, la dosis puede aumentarse a 100 UI/kg. No debe exceder la dosis diaria máxima de 200 UI/kg.
Otras hemorragias graves
En hemorragias graves, como las hemorragias en el sistema nervioso central, se recomienda una dosis de 100 UI/kg cada 12 horas. En casos individuales, puede administrarse FEIBA NF cada 6 horas hasta que se observe una mejora clínica significativa. No debe exceder la dosis diaria máxima de 200 UI/kg.
- 2)
Procedimientos quirúrgicos
Administrar 50-100 UI/kg cada 6 horas, teniendo en cuenta que no se exceda la dosis diaria máxima.
- 3)
Profílaxis
Existen datos clínicos limitados sobre el uso de FEIBA NF para la profilaxis de hemorragias en pacientes con hemofilia.
- Tratamiento profiláctico de hemorragias en pacientes con título alto de inhibidor y hemorragias frecuentes, en los que la inducción de la tolerancia inmunológica (ITI) no ha tenido éxito o no se considera: se recomienda una dosis de 70-100 UI/kg cada 2 días. Si la hemorragia del paciente no cesa, la dosis puede aumentarse a 100 UI/kg administradas diariamente, o reducirse gradualmente.
- Tratamiento profiláctico de hemorragias en pacientes con título alto de inhibidores durante la inducción de la tolerancia inmunológica (ITI): FEIBA NF puede administrarse conjuntamente con concentrados de factor VIII, en dosis de 50-100 UI/kg dos veces al día, hasta que el título del inhibidor del factor VIII disminuya a <2 ui ml*.< li>
*1 UI de Bethesda se define como la cantidad de anticuerpo que reduce en un 50% la actividad del factor VIII en plasma humano normal fresco después de 2 horas de incubación a 37°C.
Método de administración
Véase también el punto "FEIBA NF y otros medicamentos" y el punto 3 de la hoja de instrucciones.
FEIBA NF debe administrarse lentamente por vía intravenosa (no más rápido que 2 UI/kg de peso corporal por minuto).
FEIBA NF debe prepararse justo antes de la administración.
La solución debe usarse de inmediato (no contiene conservantes).
No debe usar la solución si está turbia o contiene sedimento.
No debe usar si el dispositivo de transferencia sin aguja o la aguja de doble punta, el sistema de mantenimiento de la esterilidad o su paquete están dañados o deteriorados.
Los residuos no utilizados de la solución deben eliminarse de acuerdo con el procedimiento vigente.
Monitoreo del tratamiento
Debido al mecanismo de acción complejo, no hay un método directo para monitorear las sustancias activas.
Los resultados de las pruebas de laboratorio in vitro para evaluar la eficacia del tratamiento, como el tiempo de coagulación parcial activado (aPTT), el tiempo de coagulación de la sangre y el tromboelastograma (TEG), pueden no reflejar la mejora clínica. Por lo tanto, los intentos de restaurar los valores normales de estos parámetros mediante el aumento de las dosis de FEIBA NF pueden ser engañosos y deben evitarse debido al riesgo de coagulación intravascular diseminada (CID) causada por la sobredosis.
En caso de respuesta insuficiente al tratamiento con FEIBA NF, se recomienda determinar el recuento de plaquetas, ya que una cantidad suficiente de plaquetas funcionalmente competentes es necesaria para la eficacia de FEIBA NF.
No debe exceder las dosis únicas de 100 UI/kg de peso corporal y la dosis diaria de 200 UI/kg de peso corporal. Los pacientes que reciben más de 100 UI/kg de peso corporal deben ser monitoreados para detectar la posible aparición de CID y (o) enfermedad coronaria aguda. Las dosis altas de FEIBA NF deben administrarse solo durante el período necesario para controlar la hemorragia.
En caso de cambios significativos en la presión arterial, la frecuencia cardíaca, los trastornos respiratorios, el dolor en el pecho y la tos, debe interrumpir la administración del medicamento y aplicar las medidas diagnósticas y terapéuticas adecuadas.
Los resultados de las pruebas de laboratorio que indican CID son: disminución de la concentración de fibrinógeno, disminución del recuento de plaquetas y presencia de productos de degradación de la fibrina/fibrinógeno (FDP).
La administración de FEIBA NF a pacientes con inhibidores puede resultar en un aumento inicial del título del inhibidor. Bajo la influencia de la administración continua de FEIBA NF, el título del inhibidor puede disminuir con el tiempo. Los datos clínicos y de la literatura indican que la eficacia de FEIBA NF no se reduce.
Durante la administración de FEIBA NF, en pacientes con hemofilia complicada con la presencia de inhibidores o en pacientes con inhibidores adquiridos de factores de coagulación, puede ocurrir una tendencia simultánea a hemorragias y un riesgo aumentado de trombosis.
Véase también el punto "Advertencias y precauciones".
Información detallada sobre este medicamento está disponible en la Característica del Producto Médico en el sitio web de la Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Feiba NfForma farmacéutica: Polvo, 500 UI = 500 UI FEIBAPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere recetaForma farmacéutica: Polvo, 1000 UI (1000 UI FEIBA), 50 UI/mlPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere recetaForma farmacéutica: Polvo, 2500 UI (2500 UI FEIBA), 50 UI/mlPrincipio activo: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequiere receta
Alternativas a Feiba Nf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Feiba Nf en Spain
Médicos online para Feiba Nf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Feiba Nf – sujeta a valoración médica y normativa local.














