
Emoclot

Consulta con un médico sobre la receta médica de Emoclot

Cómo usar Emoclot
Hoja de instrucciones del paquete: información para el usuario
EMOCLOT, 500 UI, polvo y disolvente para preparar una solución
para inyección e infusión
EMOCLOT, 1000 UI, polvo y disolvente para preparar una solución
para inyección e infusión
Factor VIII de coagulación sanguínea humano
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene
información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es EMOCLOT y para qué se utiliza
- 2. Información importante antes de usar EMOCLOT
- 3. Cómo usar EMOCLOT
- 4. Posibles efectos adversos
- 5. Cómo conservar EMOCLOT
- 6. Contenido del paquete y otra información
1. Qué es EMOCLOT y para qué se utiliza
EMOCLOT es un concentrado de factor VIII de coagulación sanguínea humano altamente purificado obtenido
de plasma sanguíneo humano. El factor VIII es una proteína con acción antihemorrágica.
EMOCLOT se utiliza:
- en el tratamiento y la prevención de hemorragias en pacientes con deficiencia congénita de factor VIII (hemofilia A);
- en el tratamiento de hemorragias en pacientes con deficiencia adquirida de factor VIII;
- en el tratamiento de pacientes con hemofilia con anticuerpos contra el factor VIII (inhibidores).
Este medicamento no contiene una cantidad farmacológicamente efectiva de factor de von Willebrand, por lo que no está indicado para el tratamiento de la enfermedad de von Willebrand.
2. Información importante antes de usar EMOCLOT
Cuándo no usar EMOCLOT
si el paciente es alérgico al factor VIII humano o a alguno de los demás componentes de este
medicamento (enumerados en el punto 6).
Precauciones y advertencias
Antes de comenzar a usar EMOCLOT, debe discutirlo con su médico.
Hipersensibilidad
Es posible que ocurran reacciones de hipersensibilidad tipo alérgico asociadas con EMOCLOT.
EMOCLOT contiene cantidades residuales de proteínas humanas distintas del factor VIII. Los pacientes deben ser informados sobre los síntomas tempranos de reacciones de hipersensibilidad. La administración del medicamento debe interrumpirse inmediatamente si el paciente experimenta alguno de los siguientes síntomas que pueden indicar una reacción alérgica: erupción, urticaria generalizada, opresión en el pecho, respiración silbante, presión arterial baja y reacción alérgica aguda.
En caso de choque, debe interrumpirse la administración y seguir las pautas de tratamiento para el choque.
Anticuerpos
La formación de inhibidores (anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a concentraciones altas, interrumpen el tratamiento efectivo y el paciente debe ser monitoreado cuidadosamente para detectar la formación de estos inhibidores. Si la hemorragia del paciente no se controla adecuadamente después de usar EMOCLOT, debe informar a su médico de inmediato.
Eventos cardiovasculares
En pacientes con factores de riesgo de enfermedades cardiovasculares, el tratamiento sustitutivo con factor VIII puede aumentar el riesgo de trastornos cardiovasculares.
Complicaciones relacionadas con la administración por catéter
En caso de que sea necesario usar un dispositivo para la administración en una vena central, debe considerarse el riesgo de complicaciones relacionadas con su uso, incluyendo infecciones locales, bacteriemia y trombosis en el sitio de inserción del catéter.
Seguridad viral
En el caso de los medicamentos producidos a partir de sangre o plasma humano, se toman medidas preventivas adecuadas para evitar la transmisión de infecciones a los pacientes. Estas medidas incluyen:
- la selección cuidadosa de los donantes de sangre y plasma para asegurarse de que se excluyan las personas con riesgo de ser portadoras de infecciones;
- las pruebas de cada donación y lote de plasma (colección de donaciones) para detectar virus y infecciones.
- la inclusión en el proceso de procesamiento de la sangre o el plasma de procedimientos que inactivan o eliminan los virus. A pesar de estas medidas de precaución, no se puede excluir completamente la posibilidad de transmisión de agentes infecciosos a través de un medicamento preparado a partir de sangre o plasma humano. Esto también se aplica a los virus y patógenos desconocidos o recientemente descubiertos. Se considera que las medidas de precaución utilizadas son efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia adquirida (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), y los virus sin envoltura, como el virus de la hepatitis A (VHA). Estas medidas pueden tener una eficacia limitada contra los virus sin envoltura, como el parvovirus B19. La infección por parvovirus B19 puede ser perjudicial para las mujeres embarazadas (infección fetal) y para los pacientes con deficiencia de la inmunidad o ciertos tipos de anemia (por ejemplo, anemia falciforme o anemia hemolítica).
Se recomienda encarecidamente que cada vez que se administre EMOCLOT a un paciente, se registre
el nombre y el número de lote del producto para poder determinar en el futuro qué lote del producto recibió el paciente.
En pacientes que reciben regularmente o de manera repetida factor VIII derivado de plasma, debe considerarse la vacunación adecuada (contra la hepatitis A y B).
Niños y adolescentes
Las advertencias y precauciones mencionadas se aplican tanto a los adultos como a los niños.
Más información al final de la hoja de instrucciones en la sección destinada al personal médico especializado.
EMOCLOT y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
No se han reportado interacciones del factor VIII con otros medicamentos.
No hay datos especiales sobre el uso en niños.
Embarazo y lactancia
- Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de usar este medicamento.
- No se han realizado estudios sobre el efecto del factor VIII en la reproducción animal. Debido a la rareza de la hemofilia A en mujeres, no hay experiencia con el uso del factor VIII en mujeres embarazadas o en período de lactancia. Por lo tanto, el factor VIII solo debe usarse durante el embarazo y la lactancia si es estrictamente necesario.
Conducción de vehículos y uso de máquinas
EMOCLOT no afecta la capacidad de conducir vehículos o usar máquinas.
EMOCLOT contiene sodio
El medicamento contiene hasta 41 mg de sodio (principal componente de la sal común) por frasco de 10 ml. Esto equivale al 2,05% de la dosis diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar EMOCLOT
Este medicamento siempre debe usarse según las indicaciones de su médico. El tratamiento debe iniciarse
bajo la supervisión de un médico experimentado en el tratamiento de la hemofilia.
Dosis recomendada
La dosis y la duración del tratamiento sustitutivo dependen del grado de deficiencia de factor VIII, del
lugar y la extensión de la hemorragia y del estado clínico del paciente.
Tratamiento a demanda
Al determinar la cantidad y frecuencia de la administración, debe guiarse por la eficacia clínica en el caso individual.
Profílaxis
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia A grave, se suelen administrar dosis de 20 a 40 UI de factor VIII por kilogramo de peso corporal cada 2 a 3 días.
En algunos casos, especialmente en pacientes más jóvenes, puede ser necesario administrar el medicamento en intervalos de tiempo más cortos o en dosis más altas.
Los pacientes tratados con factor VIII deben ser monitoreados cuidadosamente y sometidos a pruebas para detectar la formación de anticuerpos.
Durante el tratamiento, debe evaluarse el nivel adecuado de factor VIII para ajustar la dosis y la frecuencia de las infusiones. Especialmente en casos de procedimientos quirúrgicos graves, es necesario un monitoreo preciso del tratamiento sustitutivo mediante pruebas de coagulación (actividad del factor VIII en suero).
Niños y adolescentes
EMOCLOT no se recomienda para su uso en niños menores de 12 años debido a la falta de datos sobre la seguridad y la eficacia.
Más información sobre la dosis y la duración del tratamiento se proporciona al final de esta hoja de instrucciones en la sección destinada a los médicos y al personal médico especializado.
Método de administración
El medicamento debe administrarse por vía intravenosa en inyección o infusión lenta.
En caso de inyección intravenosa, se recomienda respetar el tiempo de administración de 3 a 5 minutos,
comprobando la frecuencia cardíaca del paciente y deteniendo la administración o reduciendo la velocidad de infusión si la frecuencia cardíaca aumenta. La velocidad de infusión debe determinarse individualmente para cada paciente.
Debe usarse exclusivamente el conjunto de inyección o infusión suministrado, ya que la adsorción del factor VIII humano en las superficies internas de algunos conjuntos de inyección o infusión puede ser la causa de un fracaso terapéutico.
Incompatibilidades: debido a la falta de estudios de compatibilidad de este medicamento, no debe mezclarse con otros productos medicinales.
Reconstitución del polvo con el disolvente:
- 1. llevar el frasco con el polvo y el frasco con el disolvente a temperatura ambiente;
- 2. mantener la temperatura ambiente durante todo el proceso de reconstitución (como máximo 10 minutos);
- 3. retirar las cubiertas protectoras de los frascos con el polvo y el disolvente;
- 4. limpiar con alcohol la superficie del tapón de ambos frascos;
- 5. abrir el paquete del material médico para la reconstitución retirando la cubierta con cuidado para no tocar el dispositivo dentro del paquete (fig. A);
- 6. no retirar el dispositivo del paquete;
- 7. invertir el paquete con el dispositivo hacia arriba y clavar la punta de plástico a través del tapón del frasco con el disolvente para conectar la parte azul del dispositivo con el frasco del disolvente (fig. B);
- 8. sosteniendo el borde del paquete, retirarlo del dispositivo sin tocarlo (fig. C);
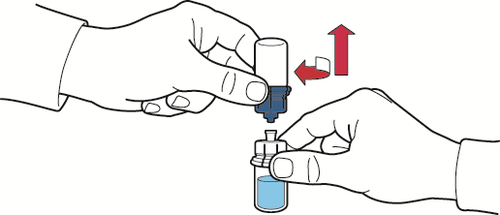
- 9. asegurarse de que el frasco con el polvo esté colocado en una superficie segura, invertir el dispositivo conectado y el frasco con el disolvente para que el frasco quede en la parte superior; presionar el adaptador transparente en el tapón del frasco con el polvo para que la punta de plástico del dispositivo pase a través del tapón; el disolvente fluirá automáticamente hacia el frasco con el polvo (fig. D);
- 10. después de que el disolvente haya fluido, retirar la parte azul del dispositivo de reconstitución con el frasco del disolvente conectado y desecharlo (fig. E);
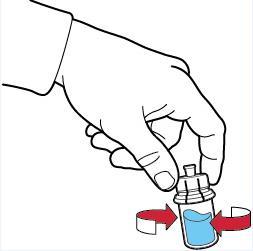
- 11. mezclar suavemente hasta que el polvo se disuelva completamente (fig. F);
- 12. no agitar enérgicamente, debe evitarse la formación de espuma en la solución.
Fig. A
Fig. B
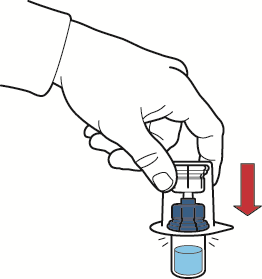
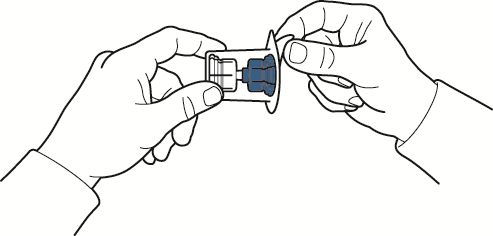
Fig. C
Fig. D
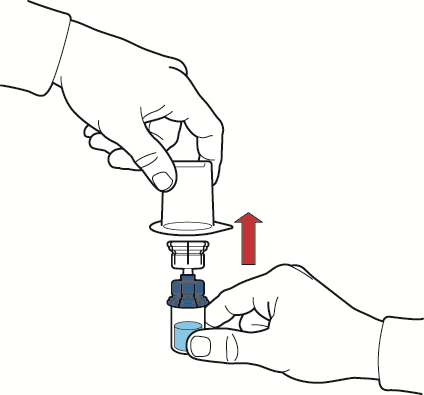
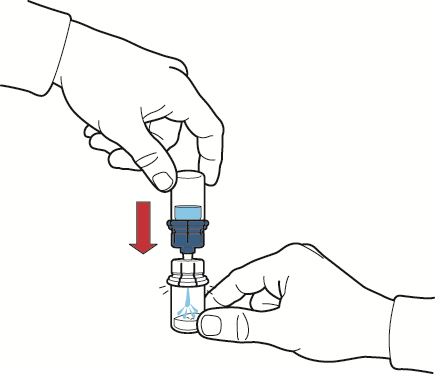
Fig. E
Fig. F
Administración de la solución
Después de la reconstitución, la solución puede contener algunos pequeños copos o partículas.
La solución reconstituida debe ser inspeccionada visualmente en busca de partículas sólidas o decoloración.
La solución debe ser transparente o ligeramente opalescente. No deben usarse soluciones turbias o que contengan sedimento.
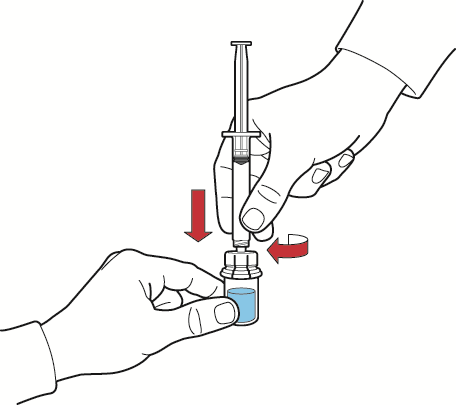
- 1. Llenar la jeringa con aire retirando el émbolo de la jeringa, conectar la jeringa al dispositivo y, presionando el émbolo de la jeringa, introducir aire en el frasco con la solución reconstituida (fig. G);
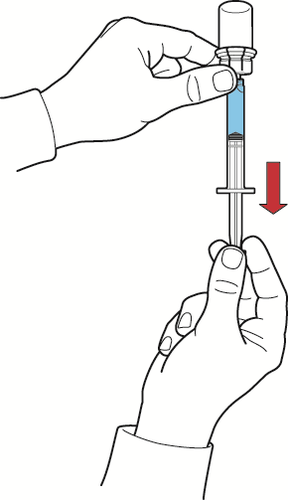
- 2. sosteniendo el émbolo de la jeringa inmóvil, invertir el frasco y la jeringa para que el frasco que contiene la solución reconstituida quede en la parte superior, y, retirando lentamente el émbolo, aspirar la solución a la jeringa (fig. H);
- 3. desconectar la jeringa girándola en sentido contrario a las agujas del reloj;
- 4. inspeccionar la solución en la jeringa, que debe ser transparente o ligeramente opalescente, sin partículas;
- 5. conectar la aguja alada a la jeringa y administrar en infusión o inyección intravenosa lenta.
Fig. G
Fig. H
Uso de una dosis mayor que la recomendada de EMOCLOT
No se conocen los síntomas de sobredosis de factor VIII humano.
En caso de ingestión accidental o sobredosis de EMOCLOT, debe acudir inmediatamente al hospital más cercano.
En caso de dudas adicionales relacionadas con el uso de este medicamento, debe consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de que ocurra alguno de los efectos adversos mencionados, debe informar a su médico o al hospital más cercano de inmediato:
- Reacciones alérgicas graves (hipersensibilidad): edema rápido de la piel y las mucosas alrededor de la boca y la cara (edema angioneurótico). Esta reacción se ha observado con poca frecuencia, pero en algunos casos puede empeorar hasta causar una reacción alérgica aguda, incluyendo choque.
- En pacientes con hemofilia A, pueden desarrollarse anticuerpos neutralizantes (inhibidores) contra el factor VIII, lo que se manifiesta por una respuesta clínica deficiente al tratamiento. En estos casos, se recomienda consultar a un centro especializado en el tratamiento de la hemofilia.
Otros posibles efectos adversos:
- Otras reacciones alérgicas (hipersensibilidad) pueden incluir:
- ardor y dolor en el lugar de la inyección;
- escalofríos, enrojecimiento facial súbito, urticaria generalizada (que ocurre en la piel de todo el cuerpo), erupción;
- dolor de cabeza
- caída de la presión arterial (hipotensión), ansiedad, latido cardíaco acelerado (taquicardia), opresión en el pecho, respiración silbante;
- somnolencia (letargo);
- náuseas, vómitos;
- sensación de hormigueo. Estas reacciones adversas se han observado en casos poco frecuentes después de la administración de medicamentos que contienen factor VIII, pero en algunos casos pueden empeorar hasta causar reacciones alérgicas agudas, incluyendo choque.
La frecuencia de los efectos adversos después de la comercialización de EMOCLOT es desconocida, lo que significa que no puede determinarse a partir de los datos disponibles.
También se ha observado la ocurrencia de fiebre.
En niños no tratados previamente con medicamentos que contienen factor VIII, los anticuerpos bloqueantes (ver punto 2) pueden desarrollarse muy a menudo (más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto ocurre, los medicamentos pueden dejar de funcionar adecuadamente en el paciente y puede ocurrir una hemorragia persistente. Si esto ocurre, debe comunicarse de inmediato con su médico.
Efectos adversos adicionales en niños
Aunque no hay datos especiales sobre la población pediátrica, algunos datos publicados sobre estudios de eficacia y seguridad no mostraron diferencias significativas entre adultos y niños con la misma afección.
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas:
Aleja Jerozolimskie 181C,
02-222 Varsovia,
tel: 22 4921301,
fax: 22 4921309,
Sitio web: https://smz.ezdrowie.gov.pl
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Información sobre la seguridad relacionada con la transmisión de agentes infecciosos, véase el punto 2.
5. Cómo conservar EMOCLOT
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños. No debe usarse después de la fecha de caducidad impresa en el paquete después de EXP. La fecha de caducidad es el último día del mes indicado.
Conservar en refrigerador (2°C - 8°C). No congelar. Conservar en el paquete exterior para protegerlo de la luz.
Antes de su uso y durante el período de validez del medicamento, el frasco con el polvo puede conservarse a temperatura ambiente, sin exceder los 25°C, durante un máximo de 6 meses consecutivos. Después de este tiempo, el medicamento debe desecharse. En ningún caso, el medicamento puede volver a colocarse en el refrigerador si ha sido conservado a temperatura ambiente.
En el paquete exterior (caja) debe anotarse la fecha inicial de conservación a temperatura ambiente.
Después de abrir los frascos, el contenido debe usarse de inmediato. El contenido de un frasco debe usarse para una sola administración del medicamento.
No debe desecharse por el desagüe ni en los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene EMOCLOT?
El principio activo del medicamento es el factor VIII de coagulación sanguínea humano.
| EMOCLOT 500 UI | EMOCLOT 1000 UI | |
| Factor VIII de coagulación sanguínea humano | 500 UI/frasco | 1000 UI/frasco |
| Factor VIII de coagulación sanguínea humano después de la reconstitución en agua para inyección | 50 UI/ ml (500 UI/10 ml) | 100 UI/ ml (1000 UI/10 ml) |
| Disolvente (agua para inyección) | 10 ml | 10 ml |
La potencia del producto (UI) se ha determinado mediante un método cromogénico de acuerdo con la Farmacopea Europea.
La actividad específica del medicamento es de aproximadamente 80 UI/mg de proteína.
El medicamento se produce a partir de plasma sanguíneo humano donado.
El medicamento contiene: factor de von Willebrand: actividad de cofactor de ristocetina (RCO) de al menos
10 UI/ml para el tamaño de 500 UI/10 ml y al menos 20 UI/ml para el tamaño de 1000 UI/10 ml.
Los demás componentes del medicamento son citrato de sodio, cloruro de sodio, glicina, cloruro de calcio.
Disolvente: agua para inyección.
Cómo se presenta EMOCLOT y qué contiene el paquete?
Polvo y disolvente para preparar una solución para inyección e infusión.
Después de la reconstitución, la solución puede contener algunos pequeños copos o partículas.
La solución reconstituida debe ser inspeccionada visualmente en busca de partículas sólidas o decoloración.
La solución debe ser transparente o ligeramente opalescente. No deben usarse soluciones turbias o que contengan sedimento.
El paquete de EMOCLOT contiene un frasco con el polvo, un frasco con el disolvente para preparar la solución para la administración, y un conjunto estéril para la reconstitución y la administración que consiste en un dispositivo de reconstitución, una jeringa de un solo uso y una aguja alada con tubo de PCV.
Emoclot, 500 UI/10 ml
1 frasco con el polvo + 1 frasco con el disolvente + conjunto para la reconstitución y la administración.
Emoclot, 1000 UI/10 ml,
1 frasco con el polvo + 1 frasco con el disolvente + conjunto para la reconstitución y la administración.
Título del responsable y fabricante Responsable
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), Italia
Fabricante
Kedrion S.p.A. - 55027 Bolognana, Gallicano (Lucca), Italia
Para obtener información más detallada, debe dirigirse al representante del titular de la autorización de comercialización
MB&S, ul. Chełmska 30/34, Varsovia
Tel/fax: 22 8515210
Fecha de la última actualización de la hoja de instrucciones:
Información destinada exclusivamente al personal médico especializado:
Monitoreo del tratamiento
Durante el tratamiento, debe evaluarse el nivel adecuado de factor VIII para ajustar la dosis y la frecuencia de las infusiones. La respuesta al factor VIII puede variar en cada paciente individual, con diferentes períodos de semivida y niveles de recuperación. La dosis basada en el peso corporal puede requerir ajustes en pacientes con bajo peso o sobrepeso.
Especially en casos de procedimientos quirúrgicos graves, es necesario un monitoreo preciso del tratamiento sustitutivo mediante pruebas de coagulación (actividad del factor VIII en suero) para determinar la dosis y la frecuencia de las infusiones exactas.
En caso de que se utilice una prueba de coagulación in vitrode una etapa basada en el tiempo de tromboplastina parcial activada (aPTT) para determinar la actividad del factor VIII en muestras de sangre de los pacientes, tanto el tipo de reactivo aPTT como el estándar de referencia utilizado en la prueba pueden tener un impacto significativo en los resultados de la determinación de la actividad del factor VIII en suero.
También pueden ocurrir diferencias significativas entre los resultados de la prueba de coagulación de una etapa basada en aPTT y los resultados de la prueba cromogénica realizada de acuerdo con la Farmacopea Europea. Esto es especialmente importante en caso de que se cambie el laboratorio y (o) los reactivos utilizados en la prueba.
Dosis
La dosis y la duración del tratamiento sustitutivo dependen del grado de deficiencia de factor VIII, del
lugar y la extensión de la hemorragia y del estado clínico del paciente.
La cantidad de unidades de factor VIII administradas se expresa en unidades internacionales (UI) equivalentes a los estándares actuales de la OMS para los productos de factor VIII. La actividad del factor VIII en suero se expresa como porcentaje (en relación con el suero sanguíneo humano normal) o en unidades internacionales (en relación con los estándares internacionales de factor VIII en suero).
Una unidad internacional (UI) de actividad de factor VIII es equivalente a la cantidad de factor VIII presente en 1 ml de suero sanguíneo humano normal.
Tratamiento a demanda
El cálculo de la dosis de factor VIII requerida se basa en datos empíricos que demuestran que 1 UI de factor VIII por kilogramo de peso corporal aumenta la actividad del factor VIII en suero en un 1,5% al 2%.
La dosis requerida se determina según la siguiente fórmula:
Número de unidades requeridas = peso corporal [kg] x aumento deseado de la actividad del factor VIII [%]
[UI/dl] x 0,4
Al determinar la cantidad y la frecuencia de la administración, siempre debe guiarse por la eficacia clínica en el caso individual.
En los siguientes casos de hemorragias, la actividad del factor VIII en suero no debe caer por debajo del valor indicado en el momento adecuado (en % de la norma o UI/dl).
La siguiente tabla puede servir de base para la dosis en episodios de hemorragia y procedimientos quirúrgicos:
Gravedad de la hemorragia / Tipo de procedimiento quirúrgico
Frecuencia de la dosis (horas)/
Duración del tratamiento (días)
Hemorragias:
Hemorragia temprana en la articulación,
hemorragia en el músculo o en la cavidad bucal
Nivel de factor VIII requerido (%) (UI/dl)
- 20 - 40 Repetir las infusiones cada 12 a 24 horas durante al menos 1 día, hasta que la hemorragia se controle, evaluada por la desaparición del dolor o la curación de la herida. Hemorragia más grave en la articulación, hemorragia en el músculo o hematoma
- 30 - 60 Repetir cada 12-24 horas durante 3-4 días o más hasta que el dolor o la discapacidad aguda se resuelvan. Hemorragias que ponen en peligro la vida
- 60 - 100 Repetir cada 8 a 24 horas hasta que el peligro se resuelva Procedimientos quirúrgicos: Procedimientos quirúrgicos menores, incluyendo la extracción de un diente
- 30 – 60 Repetir las infusiones cada 24 horas durante al menos 1 día, hasta que la herida se cure. Procedimientos quirúrgicos graves
- 80 – 100 (antes y después de la operación) Repetir cada 8 a 24 horas hasta que la herida se cure, y luego durante al menos 7 días para mantener la actividad del factor VIII en un nivel del 30% al 60% (30 UI/dl - 60 UI/dl).
Profílaxis
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia A grave, se suelen administrar dosis de 20 a 40 UI de factor VIII por kilogramo de peso corporal cada 2 a 3 días.
En algunos casos, especialmente en pacientes más jóvenes, puede ser necesario administrar el medicamento en intervalos de tiempo más cortos o en dosis más altas.
Niños y adolescentes
EMOCLOT no se recomienda para su uso en niños menores de 12 años debido a la falta de datos sobre la seguridad y la eficacia. La dosis en adolescentes (12-18 años) en cada indicación se calcula en función del peso corporal.
Método de administración
Administrar por vía intravenosa en inyección o infusión lenta.
En caso de inyección intravenosa, se recomienda respetar el tiempo de administración de 3 a 5 minutos,
comprobando la frecuencia cardíaca del paciente y deteniendo la administración o reduciendo la velocidad de infusión si la frecuencia cardíaca aumenta.
La velocidad de infusión debe determinarse individualmente para cada paciente.
La instrucción para la reconstitución del producto antes de la administración se encuentra en el punto 3. Cómo usar EMOCLOT.
Inhibidores
La importancia clínica de un inhibidor formado dependerá del título del inhibidor, siendo los inhibidores de bajo título menos problemáticos que los de alto título.
En general, todos los pacientes tratados con productos de factor VIII deben ser monitoreados cuidadosamente para detectar la formación de inhibidores, mediante la observación del estado clínico y la evaluación de las pruebas de laboratorio. Si, a pesar de la administración de la dosis adecuada, no se logra el nivel esperado de actividad del factor VIII en suero o no se puede controlar la hemorragia,
debe realizarse una prueba para detectar la presencia de inhibidores del factor VIII. En pacientes con una actividad inhibitoria significativa, el tratamiento con factor VIII puede ser ineficaz y debe considerarse otras opciones terapéuticas. El tratamiento de estos pacientes debe llevarse a cabo bajo la supervisión de médicos experimentados en el tratamiento de la hemofilia y los inhibidores del factor VIII.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorKedrion S.p.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a EmoclotForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Emoclot en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Emoclot en España
Alternativa a Emoclot en Ucrania
Médicos online para Emoclot
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Emoclot – sujeta a valoración médica y normativa local.














