
Curosurf

Consulta con un médico sobre la receta médica de Curosurf

Cómo usar Curosurf
Hoja de instrucciones incluida en el paquete: información para padres y cuidadores
Atención: Debe conservar la hoja de instrucciones. Información en el embalaje primario en un idioma extranjero.
Curosurf, 80 mg/ml (120 mg/1,5 ml), suspensión para administración intratraqueal y endobronquial
(Poractant alfa)
Fracción de fosfolípidos de pulmón de cerdo
Debe leer atentamente el contenido de la hoja de instrucciones antes de administrar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar al médico o enfermera. Véase el punto 3.
Índice de la hoja de instrucciones:
- 1. Qué es el medicamento Curosurf y para qué se utiliza
- 2. Cómo administrar el medicamento Curosurf
- 3. Posibles efectos adversos
- 4. Cómo almacenar el medicamento Curosurf
- 5. Contenido del embalaje y otra información
1. QUÉ ES EL MEDICAMENTO CUROSURF Y PARA QUÉ SE UTILIZA
El medicamento Curosurf se utiliza para tratar y prevenir el síndrome de dificultad respiratoria (en inglés,
Respiratory Distress Syndrome: RDS) en recién nacidos. En la mayoría de los recién nacidos, hay una sustancia en los pulmones llamada surfactante (factor de superficie). Esta sustancia cubre los alvéolos pulmonares, evita que se peguen y permite una respiración normal. Sin embargo, algunos recién nacidos, especialmente los prematuros, nacen con una deficiencia de surfactante, lo que lleva al desarrollo del RDS. El medicamento Curosurf es un surfactante natural que actúa de la misma manera que el surfactante producido por los recién nacidos y, por lo tanto, ayuda a los recién nacidos a respirar normalmente hasta que comiencen a producir su propio surfactante.
En el recién nacido pueden ocurrir otras afecciones que requieran un tratamiento diferente.
2. CÓMO SE ADMINISTRA EL MEDICAMENTO CUROSURF
Dosificación:
El médico elige la dosis adecuada del medicamento según el peso del niño. Si se administra el medicamento Curosurf para prevenir el RDS, debe administrarse dentro de los 15 minutos después del nacimiento.
Si se administra el medicamento Curosurf para tratar el RDS, debe administrarse lo antes posible después del diagnóstico. Si el niño necesita una dosis adicional de Curosurf, se administra 12 horas después de la primera dosis. Si es necesario, se puede administrar una tercera dosis después de otras 12 horas.
No se ha estudiado el uso del medicamento Curosurf en prematuros con insuficiencia hepática o renal.
Método de administración del medicamento:
El medicamento Curosurf se administra al niño en una incubadora por un médico o enfermera. El medicamento se calentará a temperatura ambiente y luego se administrará mediante una jeringa a través de un tubo endotraqueal en la tráquea del niño. Para ello, puede ser necesario desconectar al niño del respirador durante unos minutos.
También se puede utilizar un método de administración de surfactante menos invasivo a través de un catéter delgado (LISA, por sus siglas en inglés, Less Invasive Surfactant Administration).
El medicamento Curosurf contiene sodio
El medicamento contiene menos de 1 mmol (23 mg) de sodio por vial, es decir, el medicamento se considera "libre de sodio".
3. POSIBLES EFECTOS ADVERSOS
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los posibles efectos adversos se enumeran a continuación según su frecuencia de aparición:
En caso de duda sobre los efectos adversos, debe consultar a un médico.
No muy frecuentes(ocurren en menos de 1 de cada 100 pacientes):
- infección
- hemorragia cerebral
- aire en la cavidad torácica debido a daño pulmonar
Raros(ocurren en menos de 1 de cada 1000 pacientes):
- bradicardia
- hipotensión
- enfermedad pulmonar crónica
- disminución de la cantidad de oxígeno en el organismo
Además, se han notificado los siguientes efectos adversos:
- aumento de la cantidad de oxígeno en el organismo
- coloración azulada de la piel o las encías debido a la falta de oxígeno
- parada respiratoria
- complicaciones debido a la colocación de tubos en los pulmones
- disminución de la actividad cerebral
Durante la administración del medicamento Curosurf a través de un catéter delgado, se han notificado algunos efectos adversos leves y transitorios: bradicardia, apnea, disminución de la saturación de oxígeno en la sangre, espuma en la boca, tos, ahogamiento y estornudos.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar al médico o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos de la Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsovia, tel.: +48 22 49 21 301, fax: +48 22 49 21 309, sitio web: https://smz.ezdrowie.gov.pl
Gracias a la notificación de efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
4. CÓMO ALMACENAR EL MEDICAMENTO CUROSURF
- El medicamento debe almacenarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
- Almacenar en la nevera (2°C - 8°C). Almacenar en el embalaje original para protegerlo de la luz. Antes de administrarlo al niño, debe calentarse a temperatura ambiente.
- Las ampollas de medicamento Curosurf no abiertas y no utilizadas que se han calentado a temperatura ambiente pueden volver a almacenarse en la nevera durante 24 horas para su uso posterior. No debe calentarse el medicamento a temperatura ambiente y almacenarlo en la nevera más de una vez.
- No debe utilizarse este medicamento después de la fecha de caducidad indicada en la caja y la ampolla. La fecha de caducidad es el último día del mes indicado.
- Un contenedor debe usarse una sola vez, y los restos deben desecharse. El hospital debe asegurarse de que se eliminen de manera segura los restos no utilizados del medicamento Curosurf.
- No debe tirar los medicamentos por el desagüe. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
5. CONTENIDO DEL EMBALAJE Y OTRA INFORMACIÓN
Qué contiene el medicamento Curosurf?
- El principio activo es una mezcla de lípidos y proteínas obtenidas de los alvéolos pulmonares de cerdo.
- Los demás componentes son: cloruro de sodio, agua para inyección.
Cómo se presenta el medicamento Curosurf y qué contiene el embalaje?
El medicamento Curosurf es una suspensión estéril. Está disponible en ampollas de vidrio de un solo uso que contienen 1,5 ml (120 mg) de fracción de fosfolípidos obtenida de los alvéolos pulmonares de cerdo.
Cada mililitro de suspensión estéril contiene 80 mg de fracción de fosfolípidos de los alvéolos pulmonares de cerdo. En un embalaje hay 2 ampollas de 1,5 ml de suspensión del medicamento Curosurf.
Para obtener información más detallada, debe consultar al titular de la autorización de comercialización o al importador paralelo.
Titular de la autorización de comercialización en Rumania, país de exportación:
CHIESI FARMACEUTICI SpA
Via Palermo 26/A, 43122 Parma, Italia
Fabricante:
CHIESI FARMACEUTICI SpA
Via Palermo 26/A, 43122 Parma, Italia
CHIESI FARMACEUTICI S.p.A
Via San Leonardo 96, 43122 Parma, Italia
CHIESI PHARMACEUTICALS GmbH
Gonzagagasse 16/16, 1010 Viena, Austria
Importador paralelo:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Reempaquetado por:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Número de autorización en Rumania, país de exportación: 272/2007/01
Número de autorización de importación paralela: 85/19
Fecha de aprobación de la hoja de instrucciones:12.02.2024
[Información sobre la marca registrada]
Por favor, lea la información en el reverso de la hoja de instrucciones
------------------------------------------------------------------------------------------------------------------------
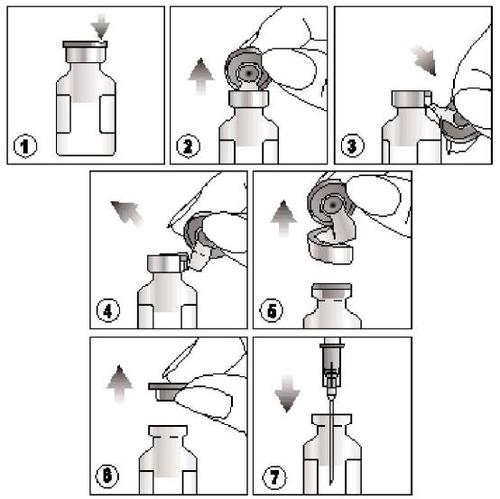
Cómo extraer el producto?
- 1) Encontrar la ranura en la tapa de plástico de color,
- 2) Levantar la tapa en la ranura y tirar de ella hacia arriba,
- 3) Tirar hacia abajo de la parte de plástico de la tapa junto con su parte de aluminio,
- 4) y 5) Quitar toda la tapa tirando del anillo de aluminio
- 6) y 7) Quitar el corcho de goma antes de extraer el contenido de la ampolla.
Para uso único. La suspensión no utilizada que queda en la ampolla debe desecharse.
No debe almacenarse la suspensión no utilizada para su reutilización.
Los restos del producto no utilizado o sus desechos deben eliminarse de acuerdo con las regulaciones.
- País de registro
- Principio activo
- Requiere recetaNo
- Titular de la autorización de comercialización (TAC, MAH)Chiesi Farmaceutici S.p.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a CurosurfForma farmacéutica: Suspensión, 80 mg, lo que corresponde a aproximadamente 74 mg de contenido total de fosfolípidos y 0,9 mg de proteínas hidrófobas de bajo peso molecular.Principio activo: natural phospholipidsNo requiere recetaForma farmacéutica: Suspensión, 80 mg/mlPrincipio activo: natural phospholipidsNo requiere recetaForma farmacéutica: Pastillas, 1500 mg + 125 mgPrincipio activo: NiketamidaFabricante: Przedsiębiorstwo Produkcyjno-Handlowe EWA S.A.No requiere receta
Alternativas a Curosurf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Curosurf en Ucrania
Alternativa a Curosurf en España
Médicos online para Curosurf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Curosurf – sujeta a valoración médica y normativa local.














