Cernevit

Consulta con un médico sobre la receta médica de Cernevit

Cómo usar Cernevit
Hoja de instrucciones del paquete: información para el usuario
CERNEVIT, polvo para preparar solución para inyección y perfusión
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de utilizar el medicamento, ya que contiene
información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es CERNEVIT y para qué se utiliza
- 2. Información importante antes de utilizar CERNEVIT
- 3. Cómo utilizar CERNEVIT
- 4. Posibles efectos adversos
- 5. Cómo conservar CERNEVIT
- 6. Contenido del paquete y otra información
1. Qué es CERNEVIT y para qué se utiliza
CERNEVIT es un polvo para preparar solución para inyección y perfusión.
Contiene 12 vitaminas:
| Principios activos | Equivalentes a | ||
| palmitato de retinol | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| coenzima tiamina | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| fosfato de riboflavina sódico | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| clorhidrato de piridoxina | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciánocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantoténico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
CERNEVIT proporciona vitaminas a pacientes que reciben nutrición parenteral (a través de una perfusión).
2. Información importante antes de utilizar CERNEVIT
Cuándo no debe utilizarse CERNEVIT
- si el paciente es alérgico (hipersensible) a los principios activos o a alguno de los demás componentes del medicamento, especialmente a la vitamina B6 o a los productos de soja y maní (véase el punto 6. Contenido del paquete y otra información)
- en pacientes menores de 11 años
- si el paciente tiene hipervitaminosis de alguna de las vitaminas contenidas en el preparado CERNEVIT
Advertencias y precauciones
Antes de iniciar el tratamiento con CERNEVIT, debe informar a su médico, farmacéutico o enfermera:
- si el paciente tiene enfermedad hepática
- si el paciente tiene enfermedad renal
- si el paciente tiene epilepsia
- si el paciente tiene enfermedad de Parkinson
CERNEVIT y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluyendo aquellos que se pueden obtener sin receta.
Debe tener especial cuidado si el paciente está tomando alguno de los siguientes tipos de medicamentos:
- L-Dopa (utilizado en el tratamiento de la enfermedad de Parkinson)
- fenobarbital, fenitoína y (o) primidona (utilizados en el tratamiento de la epilepsia) El médico puede controlar los niveles de estos medicamentos en la sangre del paciente y ajustar las dosis según sea necesario cuando el paciente comience o termine de tomar CERNEVIT.
Alteraciones de las pruebas de laboratorio
Cernevit contiene 69 microgramos de biotina por 5 ml. Si el paciente va a someterse a pruebas de laboratorio, debe informar a su médico o personal de laboratorio que ha tomado recientemente Cernevit, ya que la biotina puede alterar los resultados de dichas pruebas. Dependiendo de la prueba, los resultados pueden ser falsamente elevados o falsamente bajos debido a la biotina. El médico puede ordenar que se suspenda la administración de Cernevit antes de realizar las pruebas de laboratorio. También debe tenerse en cuenta que otros productos que se pueden tomar, como preparados multivitamínicos o suplementos dietéticos utilizados para mejorar el cabello, la piel y las uñas, también pueden contener biotina y afectar los resultados de las pruebas de laboratorio. Si el paciente toma dichos productos, debe informar a su médico o personal de laboratorio.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo
Si es necesario, este medicamento puede ser administrado a mujeres embarazadas siempre que se sigan estrictamente las indicaciones y la dosificación para evitar la sobredosis de vitaminas.
Lactancia
No se recomienda la administración de CERNEVIT durante la lactancia.
Si la paciente está lactando y recibe CERNEVIT, existe el riesgo de sobredosis de vitamina A en el lactante.
Fertilidad
No hay datos disponibles sobre el efecto de CERNEVIT en la fertilidad de hombres o mujeres.
3. Cómo utilizar CERNEVIT
CERNEVIT será administrado por personal médico especializado. Por lo general, se administra en forma de perfusión intravenosa.
La dosis recomendada es de 1 vial por día.
Sobredosis de CERNEVIT
En este caso, los síntomas de sobredosis de CERNEVIT son principalmente síntomas relacionados con la sobredosis de vitamina A:
- los síntomas de sobredosis aguda de vitamina A son:
- trastornos gastrointestinales (náuseas, vómitos)
- trastornos del sistema nervioso (dolor de cabeza, edema del nervio óptico, convulsiones) causados por el aumento de la presión intracraneal en el paciente
- trastornos psiquiátricos (irritabilidad)
- trastornos cutáneos (descamación retardada de la piel)
- los síntomas de sobredosis crónica de vitamina A son:
- dolor de cabeza causado por el aumento de la presión intracraneal en el paciente
- enfermedades óseas (sensibilidad o hinchazón dolorosa en las extremidades)
Si se observan alguno de los síntomas anteriores de sobredosis, debe informar a su médico. El médico puede interrumpir la perfusión de CERNEVIT.
Si tiene alguna duda adicional relacionada con la utilización de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los siguientes efectos adversos son frecuentes y ocurren en 1 de cada 10 pacientes:
- dolor en el lugar de la inyección
Los siguientes efectos adversos son raros y ocurren en 1 de cada 1000 pacientes:
Los siguientes efectos adversos ocurren con frecuencia no conocida:
- reacciones alérgicas, con trastornos respiratorios, dolor en el pecho, edema de la garganta, urticaria, erupción, enrojecimiento de la piel, malestar abdominal, así como con paro cardíaco
- aumento de los niveles de vitamina A y proteínas transportadoras de vitamina A en la sangre
- trastornos del gusto (sabor metálico en la boca)
- taquicardia
- taquipnea
- diarrea
- aumento de los niveles de enzimas hepáticos y ácidos biliares
- picazón
- fiebre, dolor generalizado, reacciones en el lugar de la inyección, como sensación de ardor, erupción
Debe informar a su médico de inmediato si experimenta síntomas de reacción alérgica, como trastornos respiratorios, dolor en el pecho, edema de la garganta, urticaria, erupción, enrojecimiento de la piel, malestar abdominal. El médico interrumpirá la perfusión y tomará las medidas necesarias.
Notificación de efectos adversos
Si se producen efectos adversos, debe consultar a su médico o enfermera.
Esto incluye cualquier efecto adverso no mencionado en esta hoja de instrucciones.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Ministerio de Sanidad y Consumo
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 99
Fax: +34 91 596 24 90
Correo electrónico: [[email protected]](mailto:[email protected])
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad de este medicamento.
5. Cómo conservar CERNEVIT
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
Conservar en temperatura ambiente, es decir, entre 15°C y 25°C. Proteger de la luz.
Conservar en el embalaje exterior de cartón.
Una vez reconstituido, el producto mantiene su estabilidad química y física durante 24 horas a 25°C.
Desde el punto de vista microbiológico, el medicamento debe utilizarse inmediatamente después de la reconstitución. En caso contrario, la responsabilidad de la duración y condiciones de conservación hasta el momento de su uso recae en la persona que lo administra, y no debe conservarse durante más de 24 horas a 2-8°C, a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas.
No utilizar este medicamento después de la fecha de caducidad indicada en el embalaje después de "Caducidad". La fecha de caducidad es el último día del mes indicado.
No desechar los medicamentos por el desagüe ni en los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este tipo de actuación ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene CERNEVIT?
- Los principios activos de este medicamento son:
1 vial de 5 ml contiene:
| Principios activos | Equivalentes a | ||
| palmitato de retinol | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| coenzima tiamina | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| fosfato de riboflavina sódico | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| clorhidrato de piridoxina | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciánocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantoténico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
UI = Unidades Internacionales
mg = miligramos
Los demás componentes son: glicina, fosfolipidos de soja, ácido glicocólico, hidróxido de sodio y ácido clorhídrico.
CERNEVIT contiene 24 mg de sodio (1 mmol) por vial. Debe tenerse en cuenta en pacientes con dieta controlada de sodio.
Cómo se presenta CERNEVIT y contenido del paquete?
CERNEVIT se presenta en viales de vidrio marrón. Para preparar la solución para perfusión, el personal médico especializado puede utilizar el sistema BIO-SET, que facilita la reconstitución del medicamento CERNEVIT.
CERNEVIT se presenta en paquetes que contienen 10 o 20 viales con o sin el sistema BIO-SET.
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Baxter España, S.A.
Calle de María de Molina, 46
28006 Madrid
Fabricante
Baxter S.A.
Boulevard René Branquart 80
7860 Lessines, Bélgica
Para obtener más información, debe consultar a un representante del titular de la autorización de comercialización.
Baxter España, S.A.
Calle de María de Molina, 46
28006 Madrid
Teléfono: 91 456 90 00
Fecha de la última revisión de la hoja de instrucciones: 26.03.2019
--------------------------------------------------------------------------------------------------------------
La siguiente información es solo para médicos o personal médico especializado
Composición cualitativa y cuantitativa
1 vial de 5 ml contiene:
| Principios activos | Equivalentes a | ||
| palmitato de retinol | 3500 UI | vitamina A | 3500 UI |
| colecalciferol | 220 UI | vitamina D3 | 220 UI |
| DL-α-tocoferol | 10,20 mg | vitamina E | 11,20 UI |
| ácido ascórbico | 125 mg | vitamina C | 125 mg |
| coenzima tiamina | 5,80 mg | vitamina B1 (tiamina) | 3,51 mg |
| fosfato de riboflavina sódico | 5,67 mg | vitamina B2 (riboflavina) | 4,14 mg |
| clorhidrato de piridoxina | 5,50 mg | vitamina B6 (piridoxina) | 4,53 mg |
| ciánocobalamina | 6 µg | vitamina B12 | 6 µg |
| ácido fólico | 414 µg | ácido fólico | 414 µg |
| dexpanthenol | 16,15 mg | ácido pantoténico | 17,25 mg |
| biotina | 69 µg | biotina | 69 µg |
| nicotinamida | 46 mg | vitamina PP | 46 mg |
Los componentes auxiliares son: glicina, fosfolipidos de soja, ácido glicocólico, hidróxido de sodio y ácido clorhídrico
Aspecto del producto
Una vez reconstituido, la solución tiene un color amarillo-anaranjado.
Dosis y vía de administración
Solo para adultos y niños mayores de 11 años
1 vial al día.
Administrar mediante inyección lenta intramuscular o intravenosa, o mediante perfusión intravenosa.
Vía de administración
- administración intravenosaProcedimiento de reconstitución: véase a continuación las instrucciones de uso y preparación.
Una vez reconstituido: inyectar lentamente (al menos 10 minutos; véase el punto Advertencias) en una solución de cloruro de sodio al 0,9% o glucosa al 5% para perfusión intravenosa.
La administración puede continuar durante todo el período de nutrición parenteral. Con el fin de satisfacer las necesidades nutricionales y prevenir deficiencias y posibles complicaciones relacionadas con ellas
CERNEVIT puede agregarse a mezclas nutricionales que contienen carbohidratos, grasas, aminoácidos y electrolitos, siempre que se haya comprobado previamente la compatibilidad y estabilidad con respecto a cada uno de los componentes de la mezcla nutricional.
- administración intramuscularProcedimiento de reconstitución: véase a continuación las instrucciones de uso y preparación.
Debe tenerse en cuenta la cantidad total de vitaminas procedentes de todas las fuentes, como otras formas de nutrición, administración de otras vitaminas o medicamentos que contengan vitaminas como componentes inactivos (véase el punto Interacciones).
El estado clínico del paciente y los niveles de vitaminas deben ser controlados para mantenerlos en un nivel adecuado.
Debe tenerse en cuenta que algunas vitaminas, especialmente la A, B y B, son sensibles a la luz ultravioleta (por ejemplo, luz solar directa e indirecta). Además, un alto contenido de oxígeno en la solución puede aumentar la pérdida de vitaminas A, B, C y E. Debe considerarse estos factores si no se alcanzan los niveles adecuados de vitaminas.
Contraindicaciones
No se debe utilizar CERNEVIT en:
- hipersensibilidad a los principios activos o a alguno de los componentes auxiliares, especialmente a la vitamina B6 o a los productos de soja y maní (véase el punto 6. Contenido del paquete y otra información)
- niños menores de 11 años
- hipervitaminosis de alguna de las vitaminas contenidas en este producto
Advertencias y precauciones especiales
Advertencias
Reacciones de hipersensibilidad
- Con CERNEVIT, otros productos multivitamínicos y vitaminas individuales (especialmente B6, B12 y ácido fólico) se han notificado graves reacciones de hipersensibilidad sistémica. Con CERNEVIT y otros productos vitamínicos administrados por vía parenteral, se han notificado reacciones con resultado de muerte.
- Se ha observado alergia cruzada entre las proteínas de soja y maní
- En algunos casos, la aparición de reacciones de hipersensibilidad después de la administración parenteral de productos multivitamínicos puede estar relacionada con la velocidad de administración. En el caso de la administración en perfusión intravenosa, CERNEVIT debe administrarse lentamente. En el caso de la administración en inyección intravenosa, debe administrarse lentamente (la inyección debe durar al menos 10 minutos).
Toksicidad de las vitaminas
- El estado clínico del paciente y los niveles de vitaminas en sangre deben ser controlados para evitar la sobredosis y la toxicidad, especialmente de las vitaminas A, D y E, y en particular en pacientes que también reciben vitaminas de otras fuentes o utilizan otros factores que aumentan el riesgo de toxicidad de las vitaminas.
- El control es especialmente importante en pacientes que reciben suplementos durante períodos prolongados.
Hipervitaminosis A
- El riesgo de hipervitaminosis A y toxicidad de la vitamina A (por ejemplo, anormalidades de la piel y el hueso, visión doble, cirrosis hepática) es mayor, por ejemplo:
- en pacientes con deficiencia de proteínas
- en pacientes con insuficiencia renal (incluso en ausencia de suplementación de vitamina A)
- en pacientes con insuficiencia hepática
- en pacientes con baja masa corporal (por ejemplo, pacientes pediátricos)
- y en pacientes tratados durante períodos prolongados.
- Las enfermedades hepáticas agudas en pacientes con altas reservas de vitamina A en el hígado pueden provocar la aparición de síntomas de toxicidad de la vitamina A.
Síndrome de realimentación en pacientes que reciben nutrición parenteral
La suplementación de nutrientes en pacientes gravemente desnutridos puede provocar un síndrome de síntomas relacionados, caracterizado por la transferencia de potasio, fósforo y magnesio al espacio intracelular, ya que en el paciente predominan los procesos anabólicos.
También puede ocurrir una deficiencia de tiamina y retención de líquidos en el organismo. Un control y aumento gradual de la ingesta de nutrientes, evitando la sobrealimentación, puede prevenir estas complicaciones. En caso de deficiencias nutricionales, puede ser justificada una suplementación adecuada.
Precipitados en pacientes que reciben nutrición parenteral
En pacientes que reciben nutrición parenteral, se han notificado precipitados en los vasos pulmonares.
Algunos casos han sido mortales. Un exceso de calcio y fosfato puede aumentar el riesgo de formación de precipitados de fosfato de calcio. Se han notificado precipitados incluso en ausencia de sales de fosfato en la solución. También se han notificado la aparición de precipitados en el filtro de la línea de infusión y la sospecha de formación de precipitados en el sistema circulatorio.
Además del control de la solución, también debe controlarse periódicamente el conjunto de infusión y el catéter en busca de precipitados.
En caso de aparición de síntomas de trastornos de la función pulmonar, debe interrumpirse la perfusión y comenzar la evaluación clínica del paciente.
Compruebe que el contenedor no esté dañado.
Trabaje en condiciones asépticas.
No utilice viales parcialmente utilizados; no utilice si el color del producto después de la reconstitución no es el adecuado.
Precauciones especiales de uso
Efecto en el hígado
- En pacientes que reciben CERNEVIT, se recomienda controlar los parámetros de la función hepática. Se recomienda un control especial en pacientes con ictericia de origen hepático o otros síntomas de colestasis. En pacientes que reciben CERNEVIT, se han notificado casos de aumento de los niveles de enzimas hepáticos, incluyendo un aumento aislado de la alanino aminotransferasa (ALT) en personas con enfermedades inflamatorias del intestino. Además, en pacientes que reciben CERNEVIT, se han observado aumentos de los niveles de ácidos biliares (tanto totales como individuales, incluyendo el ácido glicocólico).
- en algunos pacientes que reciben nutrición parenteral (incluyendo la nutrición parenteral con suplementos de vitaminas) se produce una enfermedad hepática y de las vías biliares, incluyendo colestasis, esteatosis, fibrosis y cirrosis hepática, que pueden conducir a insuficiencia hepática, así como a colecistitis y colelitiasis. Se considera que la etiología de estas enfermedades es multifactorial y puede variar en cada paciente. Los pacientes que desarrollen anormalidades en los resultados de las pruebas de laboratorio o otros signos de enfermedad hepática y de las vías biliares deben ser evaluados lo antes posible por un médico con conocimientos en enfermedades hepáticas para identificar los posibles factores causales y subyacentes y tomar las medidas terapéuticas y preventivas adecuadas.
Uso en pacientes con trastornos de la función hepática
Los pacientes con trastornos de la función hepática pueden requerir una suplementación individualizada de vitaminas.
Debe tenerse especial cuidado para evitar la toxicidad de la vitamina A, ya que la presencia de enfermedad hepática se asocia con una mayor sensibilidad a la toxicidad de la vitamina A, especialmente en combinación con el consumo excesivo de alcohol crónico (véase también "Hipervitaminosis A" y "Efecto en el hígado").
Uso en pacientes con trastornos de la función renal
Los pacientes con trastornos de la función renal pueden requerir una suplementación individualizada de vitaminas, dependiendo del grado de daño renal y la presencia de enfermedades concomitantes. En pacientes con insuficiencia renal grave, debe tenerse especial cuidado para mantener un nivel adecuado de vitamina D y para evitar la toxicidad de la vitamina A, que puede ocurrir en estos pacientes incluso con suplementos de pequeñas dosis de vitamina A o incluso en ausencia de suplementación.
Hipervitaminosis y toxicidad (neuropatía periférica, movimientos involuntarios) de la piridoxina (vitamina B6) se han notificado en pacientes sometidos a hemodiálisis crónica que reciben productos multivitamínicos por vía intravenosa que contienen 4 mg de piridoxina administrados tres veces a la semana.
Monitoreo general
En pacientes que reciben CERNEVIT durante períodos prolongados como única fuente de vitaminas, debe controlarse el estado clínico y los niveles de vitaminas. Esto es especialmente importante para:
- vitamina A en pacientes con úlceras, heridas, quemaduras, síndrome del intestino corto o fibrosis quística
- vitamina B12 en pacientes sometidos a diálisis
- vitamina B12 en pacientes con cáncer
- vitamina B12 en pacientes con insuficiencia renal
- vitaminas individuales cuyo requerimiento puede aumentar debido a interacciones con otros medicamentos (véase el punto Interacciones).
Las deficiencias de una o más vitaminas deben corregirse mediante una suplementación específica.
CERNEVIT no contiene vitamina K, que debe administrarse por separado si es necesario.
Uso en pacientes con deficiencia de vitamina B12
Antes de iniciar la suplementación con CERNEVIT en pacientes en riesgo de deficiencia de vitamina B12 y (o) cuando se planea administrar CERNEVIT durante varias semanas, se recomienda evaluar el estado de la vitamina B12.
Después de varios días de administración, tanto el nivel de cianocobalamina (vitamina B12) como el de ácido fólico en CERNEVIT pueden ser suficientes para provocar un aumento en la cantidad de glóbulos rojos, reticulocitos y hemoglobina en algunos pacientes con deficiencia de vitamina B12 con anemia megaloblástica. Esto puede enmascarar la deficiencia de vitamina B12.
El tratamiento efectivo de la deficiencia de vitamina B12 requiere dosis más altas de cianocobalamina que las que se administran en CERNEVIT.
La suplementación con ácido fólico en pacientes con deficiencia de vitamina B12 que no reciben vitamina B12 no previene el desarrollo o la progresión de los cambios neurológicos asociados con la deficiencia de vitamina B12. De hecho, se sugiere que puede empeorar el estado neurológico.
Al interpretar los niveles de vitamina B12, debe tenerse en cuenta que la ingesta reciente de vitamina B12 puede provocar un nivel normal a pesar de la deficiencia en los tejidos.
Alteraciones de las pruebas de laboratorio
La biotina puede interferir con las pruebas de laboratorio basadas en la interacción entre la biotina y la estreptavidina, lo que puede provocar resultados falsamente bajos o falsamente altos, dependiendo de la prueba. El riesgo de interferencia es mayor en niños y pacientes con trastornos de la función renal y aumenta con dosis más altas. Al interpretar los resultados de las pruebas de laboratorio, debe tenerse en cuenta la posible interferencia de la biotina, especialmente si se observa una falta de concordancia con la presentación clínica (por ejemplo, resultados de las pruebas de la tiroides que imitan los resultados que indican enfermedad de Graves-Basedow en pacientes que toman biotina sin síntomas de esta enfermedad o resultados falsamente negativos de las pruebas de troponina en pacientes con infarto de miocardio que toman biotina). En los casos en que se sospeche una interferencia, debe realizarse una prueba alternativa no susceptible a la interferencia de la biotina, si está disponible. Si se solicitan pruebas de laboratorio en pacientes que toman biotina, debe consultarse con el personal de laboratorio.
La presencia de ácido ascórbico en suero y orina puede provocar lecturas falsamente altas o bajas de la glucosa en algunos sistemas de medición de la glucosa en sangre y orina, incluyendo tiras reactivas portátiles y glucómetros portátiles. Debe consultarse la documentación técnica de cada prueba de laboratorio para determinar las posibles interferencias causadas por las vitaminas.
Uso concomitante con medicamentos antiepilépticos:
Debido a la presencia de ácido fólico, la administración concomitante de CERNEVIT con medicamentos antiepilépticos que contienen fenobarbital, fenitoína o primidona requiere una precaución especial.
Uso concomitante con levodopa:
Debido a la presencia de piridoxina en CERNEVIT, el uso concomitante con levodopa requiere precaución, ya que puede reducir la eficacia de la levodopa, ya que la descarboxilación de la levodopa requiere una enzima dependiente de la vitamina B6. Para evitar esta interacción, puede agregarse un inhibidor de la descarboxilasa de dopa, como la carbidopa.
Interacciones con otros medicamentos y otros tipos de interacciones
- factores que pueden provocar la aparición de un pseudotumor cerebral (incluyendo algunas tetraciclinas): el riesgo de aparición de un pseudotumor cerebral aumenta con la administración concomitante de vitamina A
- alcohol (consumo crónico excesivo): aumenta el riesgo de hepatotoxicidad de la vitamina A
- medicamentos antiepilépticos: el ácido fólico puede aumentar el metabolismo de algunos medicamentos antiepilépticos, como el fenobarbital, la fenitoína, la fosfenitoína y la primidona, lo que aumenta el riesgo de convulsiones. Debe controlarse el nivel de los medicamentos antiepilépticos en suero cuando se administra concomitantemente con folatos y después de suspender la terapia con folatos
- medicamentos antiplaquetarios (por ejemplo, aspirina): la vitamina E puede potenciar el efecto inhibitorio de la agregación plaquetaria
- aspirina (terapia con dosis altas): puede reducir el nivel de ácido fólico mediante el aumento de la excreción urinaria
- algunos medicamentos antiepilépticos (por ejemplo, fenitoína, carbamazepina, fenobarbital, valproato): pueden provocar deficiencia de folatos, piridoxina y vitamina D
- algunos medicamentos antirretrovirales: los niveles bajos de vitamina D se han asociado con efavirenz y zidovudina. La reducción de la formación de metabolitos activos de la vitamina D se ha asociado con inhibidores de la proteasa
- clorafenicol: puede inhibir la respuesta hematológica al tratamiento con vitamina B12
- deferoxamina: aumenta el riesgo de insuficiencia cardíaca inducida por el hierro debido a la mayor movilización del hierro por la suplementación con vitamina C por encima de los niveles fisiológicos. Para obtener información específica sobre las precauciones, véase la información del producto de la deferoxamina
- etionamida: puede provocar deficiencia de piridoxina
- fluoropirimidinas (5-fluorouracilo, capecitabina, tegafur): aumento de la citotoxicidad en combinación con ácido fólico
- antagonistas del ácido fólico, como metotrexato, sulfasalazina, pirimetamina, triamtereno, trimetoprima y altas concentraciones de catequinas presentes en el té: bloquean la conversión del ácido fólico a sus metabolitos activos y reducen la eficacia de la suplementación
- antimetabolitos del ácido fólico (metotrexato, raltitrexed): la suplementación con ácido fólico puede reducir la eficacia del efecto antimetabólico
- levodopa: la vitamina B6 puede reducir la eficacia de la levodopa, ya que la descarboxilación de la levodopa requiere una enzima dependiente de la vitamina B6. Para evitar esta interacción, puede agregarse un inhibidor de la descarboxilasa de dopa, como la carbidopa
Interacciones con la suplementación de otras vitaminas:
Algunos medicamentos pueden interactuar con algunas vitaminas en dosis significativamente más altas que las contenidas en CERNEVIT. Debe tenerse en cuenta en pacientes que toman vitaminas de múltiples fuentes, y cuando esto ocurra, debe controlarse a los pacientes en busca de estas interacciones y actuar en consecuencia.
Sobredosis
La sobredosis aguda o crónica de vitaminas (especialmente A, D y E) puede provocar hipervitaminosis sintomáticas.
El riesgo de sobredosis es especialmente alto si el paciente recibe vitaminas de múltiples fuentes, y en pacientes con una mayor sensibilidad a la hipervitaminosis (véase el punto Precauciones especiales de uso).
Los síntomas de sobredosis de CERNEVIT se deben principalmente a la administración de dosis excesivas de vitamina A.
Los síntomas clínicos de la sobredosis aguda de vitamina A (dosis que superan las 150.000 UI)
- trastornos gastrointestinales, dolor de cabeza, aumento de la presión intracraneal, edema del nervio óptico, trastornos psiquiátricos, irritabilidad y hasta convulsiones. Como síntoma tardío de la reacción del organismo a la sobredosis, se ha observado una descamación generalizada de la piel.
Los síntomas clínicos de la toxicidad de la vitamina A en la sobredosis crónica (administración durante períodos prolongados de dosis más altas de las necesarias fisiológicamente)
- aumento de la presión intracraneal, crecimiento excesivo de la capa cortical de los huesos largos y osificación prematura de las partes proximales de los huesos. El diagnóstico se basa en la presencia de hinchazones dolorosas en las extremidades. En la imagen radiográfica, se observan engrosamientos de la capa cortical del hueso del brazo, la pierna, las clavículas y las costillas.
El tratamiento de la sobredosis de vitaminas generalmente consiste en suspender la suplementación de vitaminas y otras medidas según las indicaciones clínicas (como la limitación de la ingesta de calcio, el aumento de la diuresis y la hidratación).
Datos farmacéuticos
Periodo de validez
2 años
Precauciones especiales de conservación
Conservar en temperatura ambiente, es decir, entre 15°C y 25°C. Proteger de la luz.
Conservar en el embalaje exterior de cartón.
Una vez reconstituido, el producto mantiene su estabilidad química y física durante 24 horas a 25°C.
Desde el punto de vista microbiológico, el medicamento debe utilizarse inmediatamente después de la reconstitución. En caso contrario, la responsabilidad de la duración y condiciones de conservación hasta el momento de su uso recae en la persona que lo administra, y no debe conservarse durante más de 24 horas a 2-8°C, a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas.
Tipo de embalaje y contenido
Viales de vidrio anaranjado que contienen 750 mg de polvo, en una caja de cartón. Embalajes de 10 y 20 viales.
Viales de vidrio anaranjado que contienen 750 mg de polvo, con el sistema BIO-SET, en una caja de cartón. Embalajes de 10 y 20 viales.
No todos los tamaños de embalaje pueden estar disponibles en el mercado.
Incompatibilidades, instrucciones para la eliminación y preparación del medicamento para su uso (si corresponde)
- Al preparar la solución y agregar el componente a la mezcla para nutrición parenteral, debe seguirse las condiciones asépticas.
- Mezcle suavemente para disolver el polvo liofilizado.
- CERNEVIT debe disolverse completamente antes de transferirlo del vial.
- No utilice el producto si la solución preparada no es clara o si el cierre original está dañado.
- Después de agregar CERNEVIT a la solución para nutrición parenteral, debe comprobarse si hay algún cambio de color anormal o si están presentes precipitados de complejos o cristales insolubles.
- Debe mezclarse cuidadosamente la solución final si CERNEVIT se utiliza como componente de la mezcla para nutrición parenteral.
- El producto reconstituido no utilizado debe desecharse y no debe conservarse para su uso posterior.
- Los medicamentos para administración parenteral deben evaluarse visualmente en busca de partículas sólidas y cambios de color antes de su administración, siempre que el producto y el embalaje lo permitan.
- Se recomienda el uso de un filtro en el extremo de la línea de infusión durante la administración de todos los tipos de nutrición parenteral.
Si es necesario, debe consultarse la documentación de referencia correspondiente sobre compatibilidad y directrices. Este medicamento no debe mezclarse con otros medicamentos, a menos que se haya demostrado su compatibilidad y estabilidad. Para obtener más información, debe consultarse al titular de la autorización de comercialización.
Debe comprobarse la compatibilidad de las soluciones administradas simultáneamente a través de la misma línea.
CERNEVIT (viales sin BIO-SET)
Administración intravenosa
Utilizando una jeringa, inyectar 5 ml de agua para inyección o solución de glucosa al 5% o solución de cloruro de sodio al 0,9% en el vial.
Mezcle suavemente hasta que el polvo se disuelva.
La solución resultante tiene un color amarillo-anaranjado.
Administración intramuscular
Disolver el polvo en 2,5 ml de agua para inyección de la manera descrita anteriormente.
CERNEVIT BIO-SET
CERNEVIT con el sistema BIO-SET permite la disolución directa del preparado en bolsas
(de una y varias cámaras) con entrada para inyección.
Bolsa de una cámara:
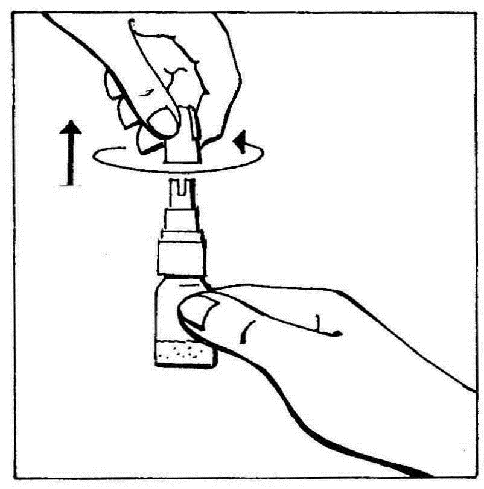
- 1. Quitar el tapón, girándolo y luego tirando para romper el anillo de seguridad.
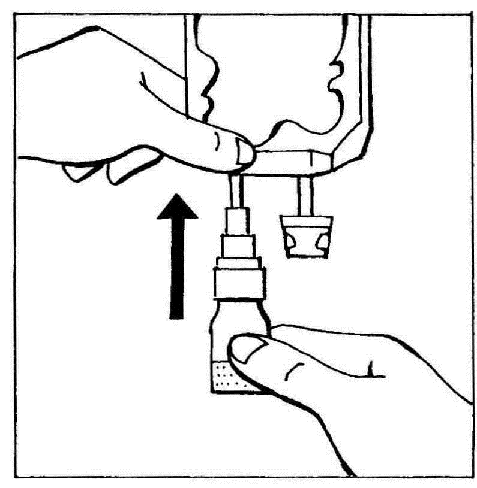
- 2. Conectar el BIO-SET directamente a la entrada para inyección de la bolsa.
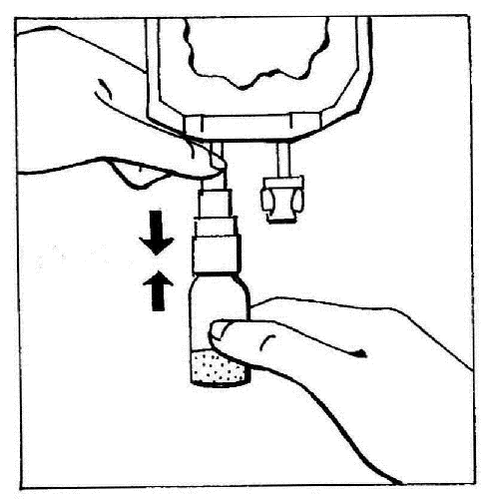
- 3. Activar el BIO-SET presionando la parte transparente y móvil. Esto permite perforar el corcho de goma de la ampolla.
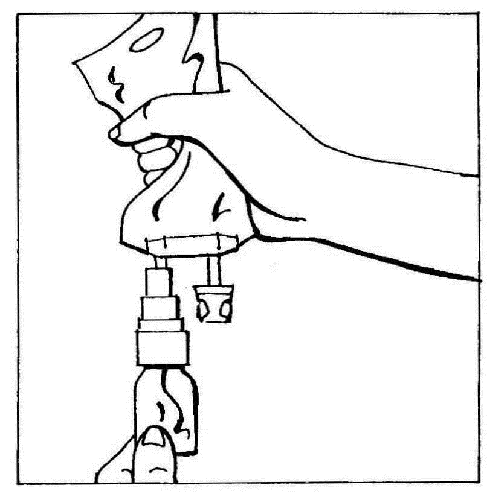
- 4. Colocar en posición vertical los elementos conectados (CERNEVIT con BIO-SET y la bolsa con el líquido para infusión), sosteniendo la bolsa en la parte superior. Presionar suavemente la bolsa varias veces para hacer que el líquido fluya hacia la ampolla (aproximadamente 5 ml). Agitar la ampolla para disolver el polvo.
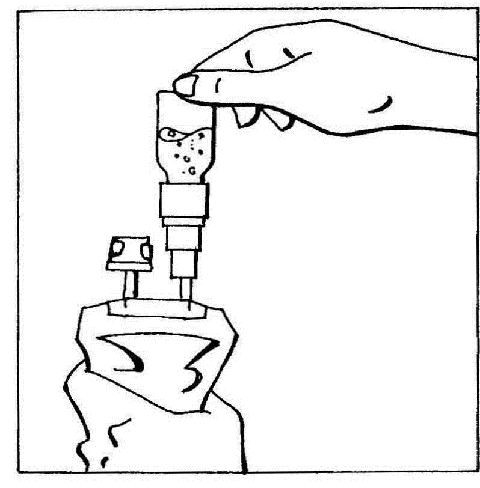
- 5. Invertir los elementos conectados y sostenerlos en posición vertical con la ampolla en la parte superior. Presionar suavemente la bolsa varias veces para mover el aire desde la bolsa hacia la ampolla. Esto hará que el líquido fluya de regreso hacia la bolsa.
- 6. Repetir los pasos 4 y 5 hasta que la ampolla esté vacía.
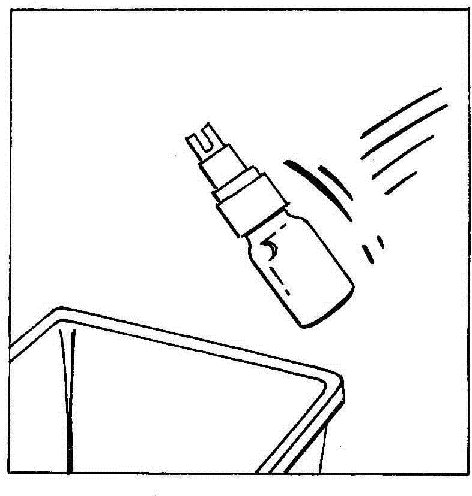
- 7. Desconectar y descartar la ampolla con el BIO-SET.
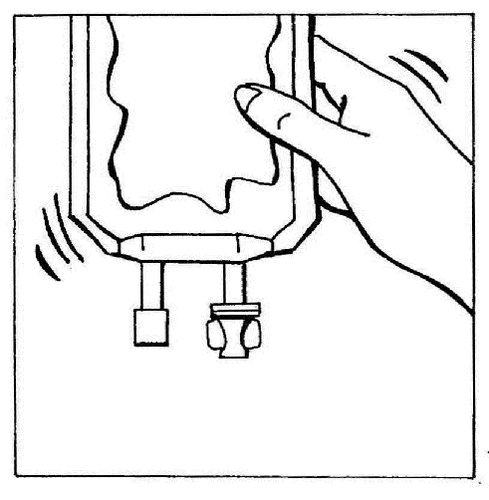
- 8. Mezclar suavemente el contenido de la bolsa.
Bolsa de varias cámaras:
La disolución del preparado CERNEVIT con el kit BIO-SET debe realizarse antes de activar la bolsa
de varias cámaras (antes de abrir las soldaduras rompibles y antes de mezclar todas
las cámaras).
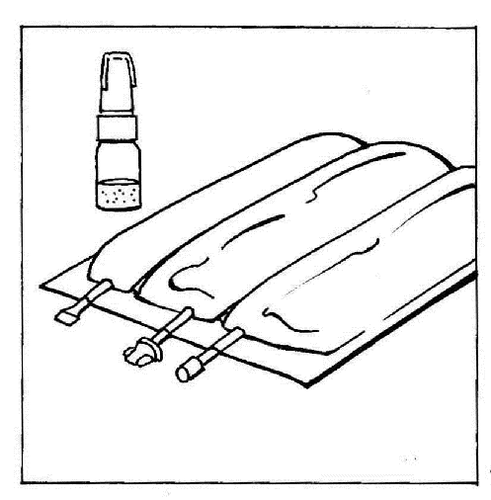
- 1. Colocar la bolsa de varias cámaras sobre una mesa.
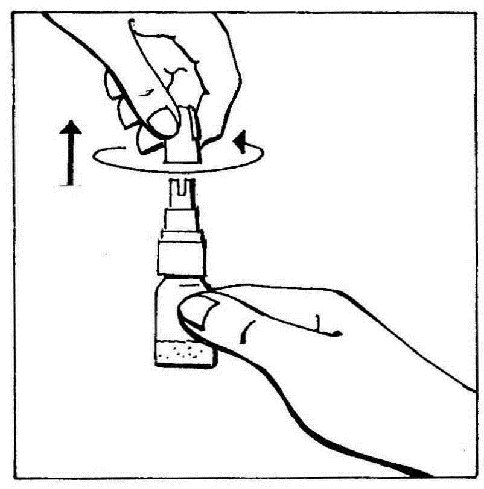
- 2. Quitar el tapón, girándolo y luego tirando para romper el anillo de seguridad.
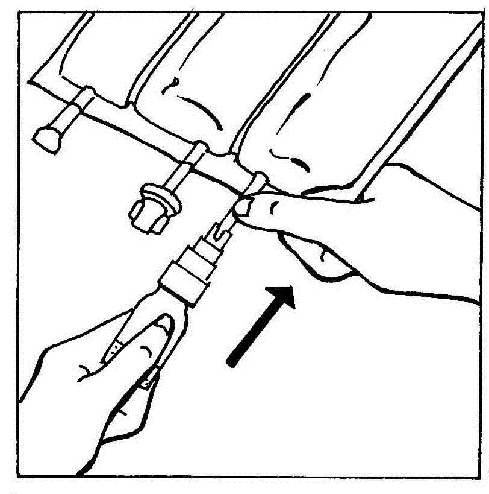
- 3. Conectar el BIO-SET directamente a la entrada para inyección de la bolsa.
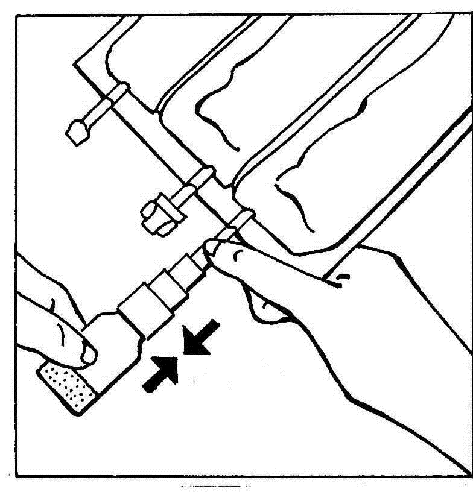
- 4. Activar el BIO-SET presionando la parte transparente y móvil. Esto permite perforar el corcho de goma de la ampolla.
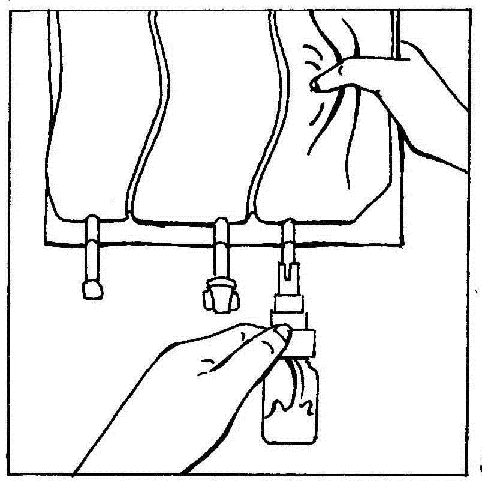
- 5. Sostener la ampolla en posición vertical. Presionar suavemente la cámara de la bolsa varias veces para hacer que el líquido fluya hacia la ampolla (aproximadamente 5 ml). Agitar la ampolla para disolver el polvo.
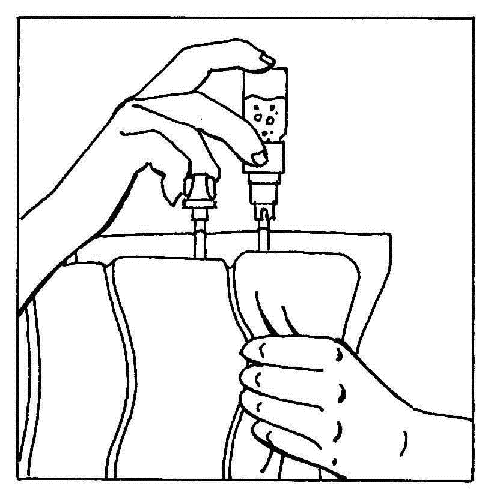
- 6. Invertir los elementos conectados y sostenerlos en posición vertical con la ampolla en la parte superior. Presionar suavemente la cámara de la bolsa varias veces para mover el aire desde la bolsa hacia la ampolla. Esto hará que el líquido fluya de regreso hacia la bolsa.
- 7. Repetir los pasos 5 y 6 hasta que la ampolla esté vacía.
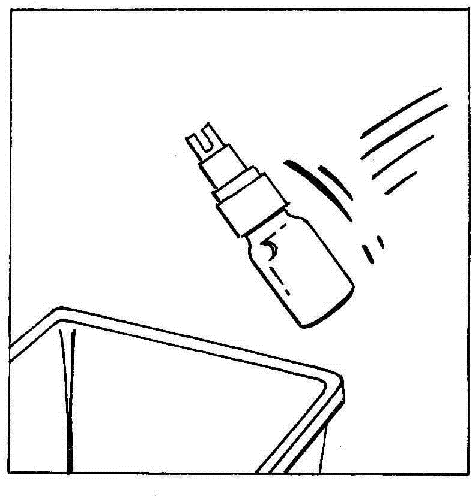
- 8. Desconectar y descartar la ampolla con el CERNEVIT BIO-SET.
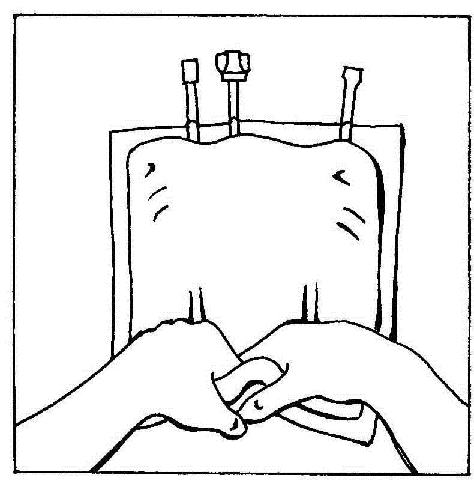
- 9. Romper las soldaduras de las cámaras de la bolsa. Finalmente, activar la bolsa de varias cámaras.
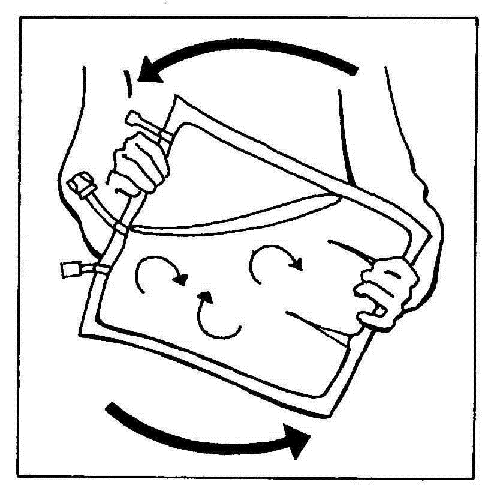
- 10. Mezclar suavemente el contenido de la bolsa, girándola al menos 3 veces.
ADVERTENCIA:
Debe tener cuidado de no desconectar el kit BIO-SET de la entrada para inyección de la bolsa
durante la disolución del preparado.
- País de registro
- Requiere recetaNo
- Fabricante
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a CernevitForma farmacéutica: Concentrado, -Principio activo: electrolytes in combination with other drugsFabricante: Fresenius Kabi Norge ASNo requiere recetaForma farmacéutica: Concentrado, (170,1 mg + 133,5 mg + 14 mg)/mlPrincipio activo: electrolytes in combination with other drugsNo requiere recetaForma farmacéutica: Solución, 1 g/10 mlPrincipio activo: Calcio cloruroFabricante: Demo S.A.Requiere receta
Alternativas a Cernevit en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Cernevit en Україна
Alternativa a Cernevit en Іспанія
Médicos online para Cernevit
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Cernevit – sujeta a valoración médica y normativa local.