
Cómo usar Carmustine Zentiva
Hoja de instrucciones del paquete: información para el usuario
Carmustine Zentiva, 100 mg, polvo y disolvente para la preparación de concentrado de solución para infusión
para infusión
karmustina
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de utilizar el medicamento, ya que contiene información importante para el paciente.
- Conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, consultar al médico, farmacéutico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar al médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Carmustine Zentiva y para qué se utiliza
- 2. Información importante antes de utilizar Carmustine Zentiva
- 3. Cómo utilizar Carmustine Zentiva
- 4. Posibles efectos adversos
- 5. Cómo conservar Carmustine Zentiva
- 6. Contenido del paquete y otra información
1. Qué es Carmustine Zentiva y para qué se utiliza
Carmustine Zentiva, 100 mg, polvo y disolvente para la preparación de concentrado de solución para infusión
para infusión, es un medicamento que contiene karmustina. La karmustina pertenece a un grupo de medicamentos
antineoplásicos, llamados derivados de nitrosourea, cuya acción consiste en ralentizar el crecimiento de las células cancerosas.
Carmustine Zentiva se utiliza en el tratamiento paliativo (alivio de los síntomas de la enfermedad y prevención del sufrimiento en los pacientes) como monoterapia o en tratamiento combinado con otros medicamentos antineoplásicos autorizados en ciertos tipos de cáncer, como:
- Tumores cerebrales - glioma, meduloblastoma, astrocitoma y metástasis en el cerebro
- Mieloma múltiple (tumor maligno que se desarrolla en la médula ósea)
- Enfermedad de Hodgkin (linfoma)
- Linfomas no hodgkinianos (linfoma)
- Tumores del tracto gastrointestinal o digestivo
- Melanoma maligno (cáncer de piel)
La karmustina también se utiliza como tratamiento de acondicionamiento antes del trasplante de células madre de la médula ósea (trasplante autólogo de células madre) en enfermedades hematológicas malignas del sistema linfático (linfoma de Hodgkin y linfoma no hodgkiniano)
2. Información importante antes de utilizar Carmustine Zentiva
Cuándo no utilizar Carmustine Zentiva:
- si el paciente es alérgico a la karmustina o a alguno de los demás componentes de este medicamento
(enumerados en el punto 6);
- Carmustine Zentiva no debe utilizarse en pacientes que tengan una cuenta de plaquetas, glóbulos blancos o glóbulos rojos disminuida debido a la quimioterapia o por otras razones;
- si el paciente tiene una disfunción renal grave;
- en niños y adolescentes menores de 18 años;
- en mujeres que están amamantando.
Advertencias y precauciones
Antes de comenzar a utilizar Carmustine Zentiva, debe discutirlo con su médico, farmacéutico o enfermera.
El efecto adverso principal de este medicamento es la mielosupresión retardada, por lo que el médico controlará la morfología de la sangre cada semana durante al menos 6 semanas después de la administración de la dosis del medicamento. Durante el tratamiento con las dosis recomendadas, los cursos de tratamiento con Carmustine Zentiva no se administrarán con más frecuencia que cada 6 semanas. Antes de la administración del medicamento, el médico controlará la morfología de la sangre.
Debe informar inmediatamente a su médico si experimenta alguno de los siguientes síntomas:
- Síntomas de infección (fiebre, dolor de garganta persistente)
- Aumento de la tendencia a los moretones y/o hemorragias
- Cansancio inusual
- Latido cardíaco acelerado y/o irregular
Antes de comenzar el tratamiento, se realizarán pruebas de función hepática, pulmonar y renal, que se repetirán regularmente durante el tratamiento.
Durante el tratamiento, pueden ocurrir síntomas gastrointestinales en forma de náuseas y vómitos.
Como la administración de Carmustine Zentiva puede causar daño pulmonar, antes de comenzar el tratamiento se realizará una radiografía de tórax y pruebas de función pulmonar (véase también el punto "Posibles efectos adversos").
El tratamiento con dosis altas de karmustina (hasta 600 mg/m²) se utiliza solo en combinación con un trasplante posterior de células madre. Las dosis altas pueden aumentar el riesgo de toxicidad pulmonar, renal, hepática, cardíaca y gastrointestinal, así como infecciones y trastornos del equilibrio electrolítico (bajo nivel de potasio, magnesio y fosfato en sangre).
El dolor abdominal (neutropenia febril) puede ocurrir como un efecto adverso relacionado con la terapia, después de la administración de quimioterapia.
Los pacientes que tienen varias enfermedades y un estado de salud más grave están más expuestos a los efectos adversos. Esto es especialmente importante en pacientes de edad avanzada.
El médico informará al paciente sobre la posibilidad de daño pulmonar y reacciones alérgicas, así como sus síntomas.
En caso de que ocurran tales síntomas, debe comunicarse inmediatamente con el médico (véase el punto 4).
Las mujeres y los hombres en edad reproductiva deben utilizar métodos anticonceptivos efectivos durante el tratamiento y durante al menos 6 meses después del tratamiento (lea el subpunto "Embarazo, lactancia y fertilidad").
Carmustine Zentiva y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los medicamentos sin receta, como:
- Fenitoína utilizada para la epilepsia
- Cimetidina utilizada para problemas gastrointestinales, como la dispepsia
- Digoxina utilizada para la arritmia cardíaca
- Melfalán - medicamento antineoplásico
- Dexametasona utilizada como medicamento antiinflamatorio y supresor del sistema inmunológico
- Metotrexato, ciclofosfamida, procarbazina, clorotepina (mostaza nitrogenada), fluorouracilo, vinblastina, actinomicina (dactinomicina), bleomicina, doxorubicina (adriamicina) utilizados en el tratamiento de varios tipos de cáncer.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o cree que puede estar embarazada, o planea quedarse embarazada, debe consultar a su médico o farmacéutico antes de utilizar este medicamento.
Embarazo y fertilidad
Carmustine Zentiva no debe utilizarse durante el embarazo, ya que puede ser perjudicial para el feto no nacido. Por lo tanto, como regla general, no se debe administrar este medicamento a mujeres embarazadas.
En caso de que se utilice durante el embarazo, la paciente debe ser consciente de los posibles riesgos para el feto no nacido. Las mujeres en edad reproductiva deben evitar quedar embarazadas durante el tratamiento con este medicamento. Las mujeres capaces de quedar embarazadas deben ser informadas sobre la necesidad de utilizar anticoncepción efectiva para evitar el embarazo durante el tratamiento con este medicamento y durante al menos 6 meses después del tratamiento.
Los hombres deben utilizar métodos anticonceptivos adecuados durante el tratamiento con Carmustine Zentiva y durante al menos 6 meses después del tratamiento, para evitar el embarazo en sus parejas. Carmustine Zentiva puede alterar la fertilidad en los hombres. Se debe recomendar a los pacientes que busquen asesoramiento sobre fertilidad/planeamiento familiar antes de comenzar el tratamiento con Carmustine Zentiva.
Lactancia
No se debe amamantar durante el tratamiento con este medicamento y durante 7 días después del tratamiento. No se puede descartar el riesgo para los recién nacidos/lactantes.
Conducción de vehículos y uso de máquinas
El efecto del medicamento en la capacidad para conducir vehículos y utilizar máquinas es desconocido. Debe consultar a su médico antes de conducir vehículos o utilizar cualquier herramienta o máquina, ya que la administración de Carmustine Zentiva puede causar mareos, que pueden afectar la capacidad para conducir vehículos o utilizar máquinas.
Carmustine Zentiva contiene propilenglicol
El propilenglicol contenido en este medicamento puede tener efectos similares a los del alcohol y aumentar la probabilidad de efectos adversos.
No se debe utilizar este medicamento en niños menores de 5 años.
Utilice este medicamento solo si se lo receta un médico. El médico puede realizar pruebas adicionales durante el tratamiento con este medicamento.
3. Cómo utilizar Carmustine Zentiva
Carmustine Zentiva siempre será administrado por personal médico especializado con experiencia en el uso de medicamentos antineoplásicos.
Adultos
La dosis depende del estado de salud, la superficie corporal y la respuesta al tratamiento. El medicamento se administra generalmente cada 6 semanas. La dosis recomendada de Carmustine Zentiva para monoterapia en pacientes no tratados previamente es de 150 a 200 mg/m² de superficie corporal (SC) por vía intravenosa cada 6 semanas. El medicamento se puede administrar en una dosis única o se puede dividir en infusiones diarias de 75 a 100 mg/m² de SC durante 2 días consecutivos. La dosis también depende de si Carmustine Zentiva se administra con otros medicamentos antineoplásicos.
Las dosis se aumentarán según la respuesta del paciente al tratamiento.
La dosis recomendada de karmustina administrada por vía intravenosa en combinación con otros quimioterapeutas antes del trasplante de células madre de la médula ósea es de 300 a 600 mg/m².
Para evitar el efecto tóxico en la médula ósea, la morfología de la sangre se examinará con frecuencia y la dosis se ajustará según sea necesario.
Vía de administración
Después de la reconstitución y dilución, Carmustine Zentiva se administra por vía intravenosa en infusión (goteo intravenoso) durante 1 a 2 horas. El tiempo de infusión no debe ser inferior a 1 hora, ya que de lo contrario puede ocurrir dolor y ardor en el lugar de administración del medicamento. El lugar de administración del medicamento se observará durante la infusión.
La duración del tratamiento se determinará según las necesidades individuales del paciente.
Uso en niños y adolescentes (menores de 18 años)
Carmustine Zentiva no debe utilizarse en niños y adolescentes debido al alto riesgo de toxicidad pulmonar.
Uso en personas de edad avanzada
Carmustine Zentiva puede utilizarse en pacientes de edad avanzada con precaución.
La función renal se controlará.
Uso de una dosis mayor que la recomendada de Carmustine Zentiva
Como el medicamento se administra por un médico o enfermera, es poco probable que se utilice una dosis incorrecta. Debe informar a su médico o enfermera si tiene alguna duda sobre la cantidad de medicamento que ha recibido.
En caso de que tenga alguna otra pregunta sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, Carmustine Zentiva puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe informar inmediatamente a su médico o enfermera si experimenta alguno de los siguientes síntomas:
respiración silbante, problemas para respirar, hinchazón de los párpados, cara o labios, erupción o picazón (especialmente si se extiende por todo el cuerpo), así como una sensación de desmayo inminente. Estos pueden ser síntomas de una reacción alérgica grave.
Carmustine Zentiva puede causar los siguientes efectos adversos:
Muy frecuentes(pueden ocurrir en más de 1 de cada 10 personas)
- Mielosupresión retardada (disminución de la producción de glóbulos sanguíneos por la médula ósea);
- Ataxia (falta de coordinación muscular);
- Mareos;
- Dolor de cabeza;
- Enrojecimiento transitorio de los ojos, visión borrosa, hemorragia retiniana, inflamación de la íris y del nervio óptico;
- Hipotensión (disminución de la presión arterial) en caso de tratamiento con dosis altas;
- Inflamación de las venas relacionada con dolor, hinchazón, enrojecimiento, sensibilidad;
- Trastornos respiratorios (problemas pulmonares) relacionados con dificultad para respirar. Este medicamento puede causar daño pulmonar grave (potencialmente mortal). El daño pulmonar puede ocurrir después de muchos años de tratamiento. Debe informar inmediatamente a su médico si experimenta alguno de los siguientes síntomas: dificultad para respirar, tos persistente, dolor en el pecho, debilidad/malestar persistente;
- Náuseas y vómitos severos; que ocurren dentro de las 2-4 horas después de la administración del medicamento y duran 4-6 horas;
- En caso de contacto con la piel: inflamación de la piel;
- El contacto accidental con la piel puede causar decoloración transitoria (oscurecimiento de la piel o las uñas).
Frecuentes(pueden ocurrir en menos de 1 de cada 10 personas)
- Leucemias agudas (cáncer de sangre) displasias de la médula ósea (desarrollo anormal de la médula ósea) debido al tratamiento prolongado. Pueden ocurrir los siguientes síntomas: sangrado de las encías, dolor óseo, fiebre, infecciones frecuentes, sangrado nasal frecuente o severo, bultos debido a la hinchazón de los ganglios linfáticos en el cuello, brazo, abdomen o ingle, palidez de la piel, dificultad para respirar, debilidad, cansancio o falta general de energía;
- Anemia (disminución del número de glóbulos rojos en la sangre);
- Encefalopatía (enfermedad del cerebro) en caso de tratamiento con dosis altas; los síntomas posibles son: debilidad muscular en una área del cuerpo, incapacidad para tomar decisiones o concentrarse, movimientos involuntarios de los músculos, temblor, dificultad para hablar o tragar, convulsiones;
- Pérdida de apetito (anorexia);
- Estreñimiento;
- Diarrrea;
- Inflamación de la boca y los labios;
- Toxicidad hepática reversible en caso de tratamiento con dosis altas, retrasada hasta 60 días después de la administración. Este trastorno puede llevar a un aumento de la actividad de las enzimas hepáticas y la concentración de bilirrubina (estos son parámetros determinados en las pruebas de sangre);
- Pérdida de cabello (alopecia);
- Enrojecimiento de la piel;
- Reacciones en el lugar de inyección.
Raros(pueden ocurrir en menos de 1 de cada 1,000 personas)
- Enfermedad obstructiva de las venas (obstrucción progresiva de las venas) en caso de tratamiento con dosis altas, en la que las venas muy pequeñas en el hígado se bloquean. Los síntomas posibles son: acumulación de líquido en la cavidad abdominal, agrandamiento del bazo, sangrado severo del esófago, ictericia de la piel y la esclera;
- Dificultad para respirar debido a una enfermedad pulmonar en la que el tejido pulmonar se cubre de cicatrices
(fibrosis pulmonar intersticial) (en caso de tratamiento con dosis bajas); los síntomas son: tos seca, dificultad para respirar, cansancio, pérdida de peso;
- Enfermedades renales;
- Ginecomastia (aumento de tamaño de los senos en los hombres);
- Sangrado gastrointestinal;
- Inflamación del nervio óptico y la retina adyacente
Muy raros(pueden ocurrir en menos de 1 de cada 10,000 personas)
- Inflamación de la pared de la vena con trombosis asociada (tromboflebitis).
No conocidos(frecuencia no puede determinarse a partir de los datos disponibles)
- Dolor muscular;
- Tumores secundarios (cáncer causado por radioterapia o quimioterapia);
- Convulsiones (incluyendo estado de convulsión);
- Daño tisular debido a la fuga en el lugar de administración del medicamento;
- Infertilidad;
- Alteración del desarrollo del embrión y/o feto en mujeres embarazadas;
- Cualquier síntoma de infección;
- Trastornos del equilibrio electrolítico (bajo nivel de potasio, magnesio y fosfato en sangre);
- Dolor abdominal (neutropenia febril);
- Después de la administración de dosis altas acumuladas y del tratamiento prolongado con Carmustine Zentiva y otros derivados de nitrosourea, se han observado reducción renal, acumulación progresiva de ciertos productos metabólicos en sangre (azotemia) y insuficiencia renal. Después de la administración de dosis totales más bajas, también se ha observado daño renal
Notificación de efectos adversos
Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente a:
Departamento de Vigilancia de Reacciones Adversas de Medicamentos del Ministerio de Sanidad, Servicios Sociales e Igualdad
C/ Alcalá 56, 28071 Madrid
Teléfono: +34 91 822 62 62
Fax: +34 91 822 62 63
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización o a su representante en España.
La notificación de efectos adversos es importante, ya que permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Carmustine Zentiva
Conservar este medicamento en un lugar donde no pueda ser visto o alcanzado por los niños.
Conservar y transportar a una temperatura entre 2°C y 8°C.
No utilizar este medicamento después de la fecha de caducidad que se indica en el envase después de "caducidad". La fecha de caducidad es el último día del mes indicado.
El medicamento será conservado por el médico o por otra persona del personal sanitario.
Después de la reconstitución según las instrucciones, la karmustina para inyección es estable durante 480 horas en la nevera (2-8°C) y 24 horas a temperatura ambiente (25°C ± 2°C) en un recipiente de vidrio. Antes de su uso, compruebe las ampollas reconstituidas en busca de cristales. Si se observan cristales, pueden disolverse calentando la ampolla a temperatura ambiente con agitación.
Desde el punto de vista microbiológico, la solución reconstituida debe utilizarse inmediatamente.
Conservar la ampolla en el envase exterior para protegerla de la luz.
La solución madre preparada debe diluirse posteriormente en 500 ml de solución de cloruro de sodio para inyección o solución de dextrosa al 5% para inyección, en recipientes de vidrio o polipropileno, y permanece estable física y químicamente durante 8 horas a 25°C ± 2°C, siempre que se proteja de la luz. Estas soluciones también son estables durante 48 horas cuando se conservan en la nevera (2-8°C) y durante 6 horas adicionales a 25°C ± 2°C, siempre que se protejan de la luz.
La solución debe protegerse de la luz hasta el final de la administración.
No desechar los medicamentos por el desagüe ni en los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este tipo de medidas ayuda a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Carmustine Zentiva?
El principio activo de este medicamento es la karmustina.
Cada ampolla de polvo para la preparación de concentrado de solución para infusión contiene 100 mg de karmustina.
Cada ampolla de disolvente contiene 3 ml de propilenglicol.
Después de la reconstitución con el disolvente proporcionado, 1 ml de solución contiene 33,3 mg de karmustina.
Los demás componentes son:
- Polvo: no contiene componentes adicionales.
- Disolvente: propilenglicol.
Cómo se presenta Carmustine Zentiva y contenido del paquete?
Carmustine Zentiva se presenta como polvo y disolvente para la preparación de concentrado de solución para infusión.
El polvo es de color amarillo pálido y se suministra en una ampolla de vidrio ámbar tipo I (30 ml) con un tapón de goma de bromobutilo y un tapón de polipropileno.
El disolvente es una solución clara, incolora y viscosa, y se suministra en una ampolla de vidrio transparente tipo I (5 ml) con un tapón de goma de bromobutilo y un tapón de polipropileno.
Un paquete contiene una ampolla que contiene 100 mg de polvo y una ampolla que contiene 3 ml de disolvente.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Zentiva k.s.
U Kabelovny 130
Dolni Měcholupy
102 37 Praga 10
República Checa
Importador:
MIAS Pharma Limited
Suite 2, Stafford House, Strand Road
Portmarnock, Co. Dublin
Irlanda
Tillomed Malta Limited,
Malta Life Sciences Park,
LS2.01.06 Industrial Estate,
San Gwann, SGN 3000, Malta
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Bélgica:
Carmustine Tillomed 100 mg poudre et solvant pour solution à diluer pour perfusion
República Checa:
Carmustine Zentiva
Dinamarca:
Carmustin Macure
Finlandia:
Carmustine Macure 100 mg kuiva-aine ja liuotin välikonsentraatiksi infuusionestettä varten, liuos
Grecia:
Carmustine/Tillomed 100 mg κόνις και διαλύτης για συμπύκνωμα για διάλυμα προς έγχυση
Hungría:
Carmustine Zentiva 100 mg por és oldószer oldatos infúzióhoz való koncentrátumhoz
Irlanda:
Carmustine 100 mg powder and solvent for concentrate for solution for infusion
Italia:
BICNU
Lituania
Carmustine Zentiva 100 mg milteliai ir tirpiklis koncentratui infuziniam tirpalui
Países Bajos:
Carmustine Glenmark 100 mg, poeder en oplosmiddel voor concentraat voor oplossing voor infusie
Noruega:
Carmustine Macure
Polonia:
Carmustine Zentiva
Portugal:
Carmustine Tillomed 100 mg pó e solvente para concentrado para solução para perfusão
Eslovaquia:
Carmustine Zentiva
Eslovenia:
Karmustin Tillomed 100 mg prašek in vehikel za raztopino za infundiranje
Suecia:
Carmustine Macure
Fecha de la última revisión de la hoja de instrucciones:marzo 2025
---------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente a profesionales sanitarios:
A continuación, se presenta una descripción breve del procedimiento de preparación y/o administración, incompatibilidades farmacéuticas, dosificación del medicamento, sobredosis o acciones de seguimiento requeridas, así como pruebas de laboratorio, basadas en la ficha técnica del medicamento.
Polvo liofilizado para la preparación de concentrado de solución para infusión no contiene conservantes y no está destinado a su uso en ampollas multidosis. El medicamento está destinado solo para un uso único. Debe tener cuidado al manipular el medicamento y evitar el contacto con la piel. La reconstitución y la dilución adicional deben realizarse en condiciones asépticas.
Al seguir las instrucciones de conservación recomendadas, se puede evitar la degradación de las sustancias contenidas en la ampolla no abierta hasta la fecha de caducidad indicada en el envase.
La conservación de la karmustina a una temperatura de 27°C o superior puede llevar a la fusión de la sustancia, ya que la karmustina tiene un punto de fusión bajo (alrededor de 30,5°C a 32,0°C). La presencia de una capa oleosa en el fondo de la ampolla puede indicar la degradación del medicamento. No debe utilizarse este medicamento.
En caso de duda sobre si el medicamento ha estado en condiciones de refrigeración adecuadas, debe verificar inmediatamente todas las ampollas en la caja. Para verificar, debe colocar la ampolla en la luz.
La reconstitución y la dilución del polvo para la preparación de concentrado de solución para infusión deben realizarse de la siguiente manera
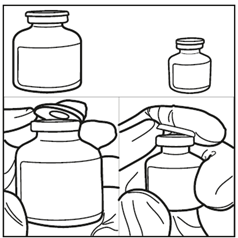
Paso 1: Retire ambas ampollas del envase y espere a que alcancen la temperatura ambiente. (Mín. 10 minutos).
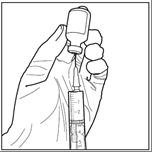
Paso 2: En condiciones asépticas, extraiga 3 ml de disolvente estérilde la ampolla de disolvente utilizando una jeringa estéril. Asegúrese de que se ha extraído toda la cantidad (3 ml) de disolvente estéril en la jeringa.
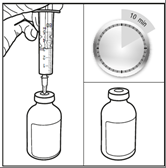
Paso 3: Inyecte el disolvente estéril en la ampolla que contiene 100 mg de karmustina y deje que el producto se humedezca durante al menos 10 minutos.
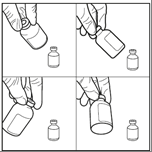
Paso 4: Mezcle (realizando movimientos circulares) durante al menos 60 segundos sin detenerse, para obtener una solución clara
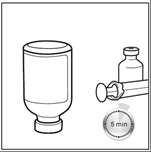
Paso 5: La ampolla debe mantenerse invertida durante 5 minutos antes de extraer la solución reconstituida
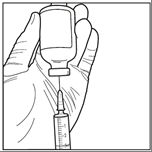
Paso 6: Extraiga asépticamente la solución reconstituida solo en posición invertida y, después de la dilución adicional, prepare la solución para infusión
Cada mililitro de solución de base obtenida después de la reconstitución contiene 33,3 mg de karmustina
La solución después de la preparación según las instrucciones es de color amarillento.
La solución de base debe diluirse inmediatamente en 500 ml de solución de cloruro de sodio para inyección al 0,9% o solución de dextrosa al 5% para inyección, en recipientes de vidrio o polipropileno. La solución resultante contiene una concentración final de 0,2 mg/ml de karmustina, y debe conservarse lejos de la luz.
Antes de su uso, compruebe las ampollas reconstituidas en busca de cristales. Si se observan cristales, pueden disolverse calentando la ampolla a temperatura ambiente con agitación. Las ampollas reconstituidas deben examinarse en busca de partículas sólidas y cambios de color antes de la administración.
Modo de administración:
La karmustina está destinada a la administración intravenosa después de la reconstitución y la dilución adicional.
La solución obtenida después de la reconstitución y la dilución debe administrarse inmediatamente en forma de goteo intravenoso durante 1-2 horas, protegiendo la solución de la luz. El tiempo de infusión no debe ser inferior a 1 hora, ya que la administración de la infusión en un tiempo más corto puede causar dolor y ardor en el lugar de inyección del medicamento. El lugar de inyección del medicamento debe observarse durante la administración.
La administración del medicamento debe finalizar dentro de las 3 horas después de su reconstitución/dilución.
La infusión debe realizarse utilizando un conjunto de infusión de PE que no contenga PCV.
Debe seguir las instrucciones de manejo seguro de los medicamentos antineoplásicos y su eliminación.
Dosificación y pruebas de laboratorio
Dosis iniciales
La dosis recomendada de Carmustine Zentiva para monoterapia en pacientes no tratados previamente es de 150 a 200 mg/m² de superficie corporal (SC) por vía intravenosa cada 6 semanas. El medicamento se puede administrar en una dosis única o se puede dividir en infusiones diarias de 75 a 100 mg/m² de SC durante 2 días consecutivos.
Cuando se administra Carmustine Zentiva en combinación con otros medicamentos con actividad mielosupresora o en pacientes con reserva de médula ósea disminuida, las dosis deben ajustarse según el perfil hematológico del paciente, como se describe a continuación.
Seguimiento y dosis posteriores
Un curso de tratamiento posterior con Carmustine Zentiva solo puede administrarse cuando los parámetros de la morfología de la sangre hayan regresado a valores aceptables (recuento de plaquetas por encima de 100.000/mm³, leucocitos por encima de 4.000/mm³), lo que generalmente ocurre dentro de las 6 semanas. La morfología de la sangre debe controlarse con frecuencia, y no debe administrarse un curso de tratamiento posterior antes de que transcurran 6 semanas, debido al posible riesgo de toxicidad hematológica retardada.
Después de la administración de la dosis inicial, las dosis posteriores deben ajustarse según la respuesta hematológica del paciente a la dosis anterior, tanto en monoterapia como en terapia combinada con otros medicamentos con actividad mielosupresora. Se sugiere el siguiente esquema de ajuste de dosis:
| Valor mínimo después de la dosis anterior | Porcentaje de la dosis anterior para administrar | |
| Leucocitos/mm³ | Plaquetas/mm³ | |
| >4000 | >100 000 | 100% |
| 75 000 – 99 999 | 100% |
| 25 000 – 74 999 | 70% |
| <2000 | <25 000< td> | 50% |
Pacientes de edad avanzada
En general, en pacientes de edad avanzada, las dosis deben seleccionarse con precaución, y en particular, debe iniciarse con el extremo inferior del rango de dosis, debido a la frecuencia más alta de disfunción hepática, renal o cardíaca; también debe considerarse la presencia de enfermedades concomitantes y el tratamiento con otros medicamentos.
Dado que en los pacientes de edad avanzada existe un mayor riesgo de disfunción renal, debe tenerse precaución al seleccionar la dosis y controlar la función renal, así como ajustar la dosis según sea necesario.
Niños y adolescentes
La karmustina está contraindicada en niños y adolescentes menores de 18 años (véase el punto 4.3) debido al alto riesgo de toxicidad pulmonar (véase el punto 4.4).
Compatibilidad/incompatibilidad con los recipientes
La solución para infusión es inestable en recipientes de cloruro de polivinilo (PVC). La solución de karmustina solo debe administrarse desde recipientes de vidrio o polipropileno.
No mezcle el medicamento con otros medicamentos, excepto los enumerados en el punto 6.6.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorMIAS Pharma Ltd Tillomed Malta Limited
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Carmustine ZentivaForma farmacéutica: Polvo, 100 mgPrincipio activo: CarmustinaRequiere recetaForma farmacéutica: Polvo, 50 mgPrincipio activo: CarmustinaRequiere recetaForma farmacéutica: Polvo, 300 mgPrincipio activo: CarmustinaRequiere receta
Alternativas a Carmustine Zentiva en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Carmustine Zentiva en España
Alternativa a Carmustine Zentiva en Ucrania
Médicos online para Carmustine Zentiva
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Carmustine Zentiva – sujeta a valoración médica y normativa local.






