Cómo usar Carmustine Accord
Hoja de instrucciones del paquete: información para el usuario
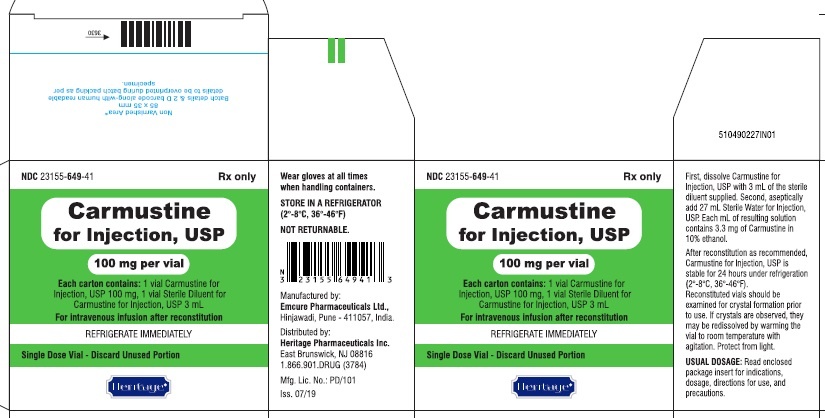
Carmustine Accord, 100 mg, polvo y disolvente para concentrado para solución para infusión
infusión
Carmustina
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Carmustine Accord y para qué se utiliza
- 2. Información importante antes de usar Carmustine Accord
- 3. Cómo usar Carmustine Accord
- 4. Posibles efectos adversos
- 5. Cómo conservar Carmustine Accord
- 6. Contenido del paquete y otra información
1. Qué es Carmustine Accord y para qué se utiliza
Carmustine Accord es un medicamento que contiene carmustina. La carmustina pertenece a un grupo de medicamentos antineoplásicos llamados derivados de nitrosourea, que actúan ralentizando el crecimiento de las células cancerosas.
La carmustina se indica para el tratamiento de adultos con los siguientes tipos de cáncer maligno en monoterapia o en combinación con otros medicamentos antineoplásicos o terapias (radioterapia, cirugía):
- Tumores cerebrales (glioblastoma multiforme, glioma del tallo cerebral, meduloblastoma, astrocitoma y ependimoma) y metástasis cerebrales
- Terapia de segunda línea para linfoma no hodgkiniano y enfermedad de Hodgkin.
- Tumores del tracto gastrointestinal.
- Melanoma maligno (cáncer de piel)
- Como tratamiento de acondicionamiento antes del trasplante autólogo de células madre hematopoyéticas en enfermedades hematológicas malignas (enfermedad de Hodgkin/linfoma no hodgkiniano).
2. Información importante antes de usar Carmustine Accord
Cuándo no usar Carmustine Accord:
- si el paciente es alérgico a la carmustina o a cualquier otro componente de este medicamento (enumerados en el punto 6);
- si el paciente tiene trastornos de la médula ósea que se manifiestan por una disminución del número de plaquetas, glóbulos blancos (leucocitos) o glóbulos rojos (eritrocitos) debido a la quimioterapia o por otras razones;
- si el paciente tiene trastornos graves de la función renal;
- en niños y adolescentes;
- en mujeres que están amamantando.
Precauciones y advertencias
Antes de comenzar el tratamiento con Carmustine Accord, debe discutirlo con su médico, farmacéutico o enfermera.
El efecto adverso principal de este medicamento es la mielosupresión retardada, que puede manifestarse como fatiga, sangrado de la piel y las mucosas, así como infecciones y fiebre debido a cambios en la sangre. Por lo tanto, el médico controlará la morfología de la sangre cada semana durante al menos 6 semanas después de la administración de la dosis del medicamento. Durante el tratamiento con las dosis recomendadas, los cursos de tratamiento con Carmustine Accord se administrarán con un intervalo de al menos 6 semanas. Antes de la administración del medicamento, el médico controlará la morfología de la sangre.
Antes de comenzar el tratamiento, se realizarán pruebas de función hepática, pulmonar y renal, que se repetirán regularmente durante el tratamiento.
Dado que el uso de Carmustine Accord puede provocar daño pulmonar, antes de comenzar el tratamiento se realizará una radiografía de tórax y pruebas de función pulmonar (véase también el punto "Posibles efectos adversos").
El tratamiento con altas dosis de Carmustine Accord (hasta 600 mg/m2) se utiliza solo en combinación con un trasplante posterior de células madre. Las altas dosis pueden aumentar el riesgo de toxicidad pulmonar, renal, hepática, cardíaca y gastrointestinal, así como infecciones y trastornos electrolíticos (bajos niveles de potasio, magnesio y fósforo en sangre).
El dolor abdominal (neutropenia febril) puede ocurrir como un efecto adverso relacionado con la terapia, después de la administración de quimioterapia.
El médico informará al paciente sobre la posibilidad de daño pulmonar y reacciones alérgicas, así como sus síntomas.
En caso de que aparezcan estos síntomas, debe comunicarse de inmediato con el médico (véase el punto 4).
Niños y adolescentes
No se debe usar Carmustine Accord en niños y adolescentes menores de 18 años.
Carmustine Accord y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los medicamentos sin receta, como:
- Fenitoína para la epilepsia
- Dexametasona como medicamento antiinflamatorio y supresor del sistema inmunológico
- Cimetidina para problemas gástricos, como la dispepsia
- Digoxina para la arritmia cardíaca
- Melfalán, un medicamento antineoplásico
Uso de Carmustine Accord con alcohol
La cantidad de alcohol en este producto medicinal puede alterar el efecto de otros medicamentos.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si sospecha que puede estar embarazada, o planea quedarse embarazada, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Embarazo y fertilidad
No se debe usar Carmustine Accord durante el embarazo, ya que puede tener un efecto perjudicial en el feto no nacido. Por lo tanto, generalmente no se debe administrar este medicamento a mujeres embarazadas. En caso de que se use durante el embarazo, la paciente debe ser consciente de los posibles riesgos para el feto no nacido. Las mujeres en edad fértil deben ser informadas sobre la necesidad de usar anticoncepción efectiva para prevenir el embarazo durante el tratamiento con este medicamento y durante al menos 6 meses después de finalizar el tratamiento.
Los hombres deben usar métodos anticonceptivos adecuados durante el tratamiento con Carmustine Accord y durante al menos 6 meses después del tratamiento, para prevenir el embarazo en sus parejas.
Lactancia
No se debe amamantar durante el tratamiento con este medicamento y durante 7 días después del tratamiento. No se puede descartar el riesgo para los recién nacidos/lactantes.
Conducción de vehículos y uso de máquinas
Carmustine Accord no tiene efecto o tiene un efecto insignificante en la capacidad para conducir vehículos o usar máquinas. Debe consultar a su médico antes de conducir vehículos o usar cualquier herramienta o máquina, ya que la cantidad de alcohol contenida en este medicamento puede alterar la capacidad para conducir vehículos o usar máquinas.
Carmustine Accord contiene etanol (alcohol)
Este medicamento contiene 2,37 g de alcohol (etanol) por vial, lo que equivale a 33,86 mg/kg. La cantidad en la dosis máxima (600 mg/m2) de este medicamento es equivalente a 640 ml de cerveza o 256 ml de vino.
La cantidad de alcohol en este medicamento puede afectar la capacidad para conducir vehículos o usar máquinas.
Puede afectar la evaluación de la situación y la velocidad de reacción.
Los pacientes con epilepsia o enfermedades hepáticas deben consultar a su médico o farmacéutico antes de tomar este medicamento.
La cantidad de alcohol en este medicamento puede alterar el efecto de otros medicamentos. En caso de que se tomen otros medicamentos, debe consultar a su médico o farmacéutico.
Las pacientes embarazadas o en período de lactancia deben consultar a su médico o farmacéutico antes de tomar este medicamento.
Las personas adictas al alcohol deben consultar a su médico o farmacéutico antes de tomar este medicamento.
Dado que este medicamento se administra generalmente de forma lenta durante 1-2 horas, el efecto del alcohol puede ser atenuado.
3. Cómo usar Carmustine Accord
Carmustine Accord siempre será administrado por personal médico con experiencia en el uso de medicamentos antineoplásicos.
Adultos
La dosificación depende del estado de salud, la superficie corporal y la respuesta al tratamiento. El medicamento generalmente se administra con un intervalo de al menos 6 semanas. La dosis recomendada del producto medicinal Carmustine Accord para monoterapia en pacientes no tratados previamente es de 150 a 200 mg/m2 por vía intravenosa cada 6 semanas.
El medicamento se puede administrar en una dosis única o se puede dividir en infusiones diarias de 75 a 100 mg/m2 durante dos días consecutivos.
La dosificación también depende de si Carmustine Accord se administra con otros medicamentos antineoplásicos.
Las dosis se aumentarán según la respuesta del paciente al tratamiento.
La dosis recomendada del producto medicinal Carmustine Accord para administración intravenosa en combinación con otros quimioterapeutas antes del trasplante de células madre hematopoyéticas es de 300
- 600 mg/m2.
Para evitar un efecto tóxico en la médula ósea, la morfología de la sangre se controlará con frecuencia y la dosis se ajustará si es necesario.
Vía de administración
Después de la reconstitución y dilución, Carmustine Accord se administra por vía intravenosa en infusión (goteo intravenoso) durante un período de una a dos horas, protegiéndolo de la luz. El tiempo de infusión no debe ser inferior a una hora, ya que de lo contrario puede ocurrir ardor y dolor en el lugar de administración del medicamento. El lugar de administración del medicamento se controlará durante la infusión.
El tiempo de tratamiento se determinará según las necesidades individuales del paciente.
Uso de una dosis mayor que la recomendada de Carmustine Accord
Dado que el medicamento se administra por un médico o enfermera, es poco probable que se use una dosis incorrecta. Debe informar a su médico o enfermera en caso de que tenga alguna inquietud sobre la cantidad de medicamento que ha recibido.
En caso de que tenga alguna otra pregunta sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe informar de inmediato a su médico o enfermera si experimenta alguno de los siguientes síntomas:
cualquier respiración sibilante repentina, problemas para respirar, hinchazón de los párpados, la cara o los labios, erupción o picazón (especialmente si se extiende por todo el cuerpo), así como una sensación de desmayo inminente. Estos pueden ser síntomas de una reacción alérgica grave.
Carmustine Accord puede causar los siguientes efectos adversos:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Mielosupresión retardada (disminución del número de glóbulos producidos por la médula ósea), que puede aumentar el riesgo de infecciones en caso de disminución del número de glóbulos blancos;
- Ataxia (falta de coordinación voluntaria de los movimientos musculares);
- Mareos;
- Dolor de cabeza;
- Enrojecimiento transitorio del ojo, visión borrosa debido a hemorragia retiniana;
- Hipotensión (disminución de la presión arterial);
- Flebitis relacionada con el dolor, la hinchazón, el enrojecimiento, la sensibilidad a la presión;
- Trastornos respiratorios (relacionados con los pulmones) relacionados con dificultad para respirar. Este medicamento puede causar daño pulmonar grave (potencialmente mortal). El daño pulmonar puede ocurrir después de muchos años del tratamiento. Debe informar de inmediato a su médico si experimenta alguno de los siguientes síntomas: dificultad para respirar, tos persistente, dolor en el pecho, debilidad/malestar persistente.
- Náuseas y vómitos severos;
- En caso de contacto con la piel: dermatitis;
- El contacto accidental con la piel puede causar decoloración transitoria (oscurecimiento de la piel o las uñas) Frecuentes(pueden ocurrir en hasta 1 de cada 10 personas):
- Leucemia aguda y displasia de la médula ósea (desarrollo anormal de la médula ósea). Los síntomas posibles son: sangrado de las encías, dolor óseo, fiebre, infecciones frecuentes, sangrado nasal frecuente o severo, tumores causados por ganglios linfáticos hinchados en el cuello o alrededor, debajo de las axilas, en el abdomen o en la ingle, palidez de la piel, dificultad para respirar, debilidad, fatiga o disminución general de la energía;
- Anemia (disminución del número de glóbulos rojos en la sangre);
- Encefalopatía (enfermedad del cerebro). Los síntomas posibles son: debilidad muscular en un lugar, incapacidad para tomar decisiones o mala concentración, movimientos involuntarios de los músculos, temblor, dificultad para hablar o tragar, convulsiones;
- Pérdida del apetito;
- Estreñimiento;
- Diarrhea;
- Estomatitis;
- Toxicidad hepática reversible en caso de tratamiento con altas dosis. Este trastorno puede llevar a un aumento de la actividad de las enzimas hepáticas y la bilirrubina (estos son parámetros determinados en las pruebas de sangre);
- Alopecia (pérdida de cabello);
- Enrojecimiento de la piel;
- Reacciones en el lugar de inyección.
Raros(pueden ocurrir en hasta 1 de cada 1.000 personas):
- Enfermedad obstructiva de las venas (obstrucción progresiva de las venas) que se manifiesta por la obstrucción de venas muy pequeñas (microscópicas) en el hígado. Los síntomas posibles son: acumulación de líquido en el abdomen, hígado aumentado de tamaño, sangrado severo del esófago, ictericia;
- Problemas respiratorios causados por la fibrosis pulmonar intersticial (durante el uso de dosis más bajas);
- Problemas relacionados con los riñones;
- Ginecomastia (aumento del tamaño de los senos en los hombres).
Desconocidos(la frecuencia no puede determinarse a partir de los datos disponibles):
- Dolor muscular;
- Convulsiones (incluyendo el estado de mal epiléptico),;
- Daño tisular debido a la fuga en el lugar de administración del medicamento;
- Infertilidad;
- Cualquier síntoma de infección;
- Se ha demostrado que la carmustina tiene un efecto adverso en el desarrollo de los fetos no nacidos.
- Trastornos electrolíticos (y desequilibrio electrolítico (bajos niveles de potasio, magnesio y fósforo en sangre)).
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Ministerio de Sanidad y Consumo
Calles de Jerusalén, 181C
02222 Madrid
Teléfono: +34 91 596 12 34
Fax: +34 91 596 12 35
Sitio web: https://www.aemps.gob.es/
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
5. Cómo conservar Carmustine Accord
El medicamento será conservado por el médico o por otra persona del personal médico especializado.
El medicamento debe conservarse en un lugar no visible y no accesible para los niños.
No debe usarse después de la fecha de caducidad indicada en el etiquetado y el paquete después de EXP.
La fecha de caducidad es el último día del mes indicado.
Conservar y transportar a una temperatura de 2°C a 8°C.
Conservar los viales en el paquete de cartón para proteger del sol.
Después de la reconstitución (solución reconstituida)
Se ha demostrado la estabilidad química y física de la solución reconstituida durante 24 horas a una temperatura de 2°C a 8°C.
Después de la dilución (solución para infusión)
Se ha demostrado la estabilidad química y física de la solución para infusión en 500 ml de solución de cloruro de sodio para inyección al 0,9% o 500 ml de solución de glucosa al 5% para inyección, si se conserva en un recipiente de vidrio o polipropileno durante 4 horas a una temperatura de 20°C a 25°C y se protege de la luz. Las soluciones también permanecerán estables durante 24 horas** en el refrigerador (2°C a 8°C) y durante 3 horas adicionales a 20°C a 25°C, protegidas de la luz.
Desde el punto de vista microbiológico, si el método de apertura, reconstitución y dilución no excluye el riesgo de contaminación microbiológica, el producto debe usarse de inmediato. Si el producto no se usa de inmediato, el usuario es responsable del tiempo y las condiciones de conservación durante el uso.
La solución debe protegerse de la luz hasta el final de la administración del medicamento.
No debe desecharse el medicamento por el desagüe ni en los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
**24 horas de tiempo de conservación de la solución para infusión preparada es el tiempo total durante el cual la carmustina permanece en la solución, incluyendo el tiempo de reconstitución con 3 ml de etanol y 27 ml de agua para inyección.
6. Contenido del paquete y otra información
Qué contiene Carmustine Accord?
El principio activo del medicamento es la carmustina.
Cada vial de 30 ml de polvo para solución para infusión contiene 100 mg de carmustina.
Cada vial de disolvente contiene 3 ml de etanol anhidro.
Después de la reconstitución con el disolvente suministrado y la dilución en 27 ml de agua estéril para inyección,
1 ml de solución contiene 3,3 mg de carmustina.
Excipientes:
- Polvo: No contiene excipientes.
- Disolvente: Etanol, anhidro.
Cómo se presenta Carmustine Accord y qué contiene el paquete?
Carmustine Accord se presenta como polvo y disolvente para solución para infusión.
Escamas o masa seca blanquecina en un vial de vidrio ámbar (30 ml) cerrado con un tapón de goma de bromobutilo y una cubierta de aluminio con un tapón de polipropileno.
El disolvente es un líquido claro e incoloro en un vial de vidrio transparente (5 ml) cerrado con un tapón de goma de butilo con una capa de fluorotecnol y una cubierta de aluminio con un tapón de polipropileno.
Tamaños de paquete:
El paquete contiene 1 vial que contiene 100 mg de polvo y 1 vial que contiene 3 ml de disolvente.
El paquete contiene 10 viales que contienen 100 mg de polvo y 10 viales que contienen 3 ml de disolvente.
No todos los tamaños de paquete pueden estar disponibles.
Título del responsable
Accord Healthcare Polska Sp. z o.o.
Ul. Taśmowa 7
02-677 Varsovia
Teléfono: +48 22 577 28 00
Fabricante/Importador
Accord Healthcare Polska Sp.z o.o.
Ul. Lutomierska 50
95-200 Pabianice
Laboratori Fundació Dau
C/ C, 12-14 Pol. Ind.
Zona Franca
08040 Barcelona
España
Accord Healthcare B.V.
Winthontlaan 200
3526KV Utrecht
Países Bajos
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
| País | Nombre del producto |
| Chipre | Carmustine Accord |
| República Checa | Carmustine Accord |
| Dinamarca | Carmustine Accord |
| Estonia | Carmustine Accord |
| Finlandia | Carmustine Accord 100 mg kuiva-aine ja liuotin välikonsentraatiksi infuusionestettä varten, liuos |
| Francia | Carmustine Accord 100 mg poudre et solvant pour solution à diluer pour perfusion |
| España | Carmustine Accord 100 mg polvo y disolvente para concentrado para solución para perfusión |
| Países Bajos | Carmustine Accord 100 mg poeder en oplosmiddel voor concentraat voor oplossing voor infusie |
| Irlanda | Carmustine 100 mg powder and solvent for concentrate for solution for infusion |
| Malta | Carmustine 100 mg powder and solvent for concentrate for solution for infusion |
| Alemania | Carmustine Accord 100 mg Pulver und Lösungsmittel für ein Konzentrat zur Herstellung einer Infusionslösung |
| Noruega | Carmustine Accord |
| Polonia | Carmustine Accord |
| Portugal | Carmustina Accord |
| Suecia | Carmustine Accord 100 mg pulver och vätska till koncentrat till infusionsvätska, lösning |
| Reino Unido (Irlanda del Norte) | Carmustine 100 mg powder and solvent for concentrate for solution for infusion |
| Italia | Carmustina Accord |
Fecha de la última actualización de la hoja de instrucciones: septiembre de 2024
Información destinada exclusivamente al personal médico especializado:
A continuación, se presenta una descripción breve del método de preparación y (o) administración, incompatibilidades farmacéuticas, dosificación del medicamento, sobredosis o acciones requeridas para el monitoreo, así como pruebas de laboratorio, basadas en la característica actual del producto medicinal.
El producto medicinal Carmustine Accord polvo para solución para infusión no contiene conservantes y no está destinado para uso en viales multidosis.
La reconstitución y la dilución adicional deben realizarse en condiciones asépticas.
Al seguir las condiciones de conservación recomendadas, se puede evitar la degradación de las sustancias contenidas en el vial no abierto hasta la fecha de caducidad indicada en el paquete.
La conservación de la carmustina a una temperatura de 28°C o superior puede provocar la licuefacción de esta sustancia, ya que la carmustina tiene un punto de fusión bajo (alrededor de 28°C a 29°C). El indicador de que ha ocurrido la degradación es una capa oleosa en el fondo del vial visible a la luz clara. No se debe usar este producto medicinal.
En el vial no abierto pueden estar presentes escamas con bordes afilados o incluso una masa compacta, pero sin degradación de la carmustina.
Reconstitución y dilución del polvo para solución para infusión
Disolver la carmustina (100 mg de polvo) en 3 ml del disolvente estéril suministrado (etanol) en el paquete primario (vial de vidrio marrón). La carmustina debe disolverse completamente en el etanol antes de agregar el agua estéril para inyección. La disolución del polvo puede tardar 3 minutos. Luego, de forma aséptica, agregar 27 ml de agua estéril para inyección a la solución de etanol.
La solución básica resultante de 30 ml debe mezclarse bien.
Un mililitro de solución básica contiene 3,3 mg de carmustina en un 10% de etanol, y su pH es de 4 a 6,8.
La solución después de la reconstitución según las instrucciones es amarillenta y prácticamente libre de partículas visibles.
La solución básica de 30 ml debe diluirse de inmediato, agregando 30 ml de solución básica a 500 ml de solución de cloruro de sodio para inyección al 0,9% o 500 ml de solución de glucosa al 5% para inyección.
Método de administración
El producto Carmustine Accord está destinado para administración intravenosa después de la reconstitución y la dilución adicional.
Al reconstituir el polvo con el disolvente estéril suministrado (3 ml de vial), se prepara una solución, y luego se agrega agua estéril para inyección adicional para obtener una solución básica amarillenta. La solución básica debe diluirse adicionalmente en 500 ml de solución de cloruro de sodio para inyección al 0,9% o en solución de glucosa para inyección al 5%.
La solución para infusión preparada debe administrarse de inmediato en infusión intravenosa durante un período de una a dos horas, protegiéndola de la luz. El tiempo de infusión no debe ser inferior a una hora, ya que de lo contrario puede ocurrir ardor y dolor en el lugar de administración del medicamento. Durante la administración del medicamento, se debe controlar el lugar de infusión intravenosa.
El personal embarazado no debe tener contacto con este producto medicinal.
Debe seguirse las pautas para el manejo seguro de los medicamentos antineoplásicos y su eliminación.
Dosificación y pruebas de laboratorio
Dosis iniciales
La dosis recomendada del producto medicinal Carmustine Accord para monoterapia en pacientes no tratados previamente es de 150 a 200 mg/m2 por vía intravenosa cada 6 semanas. El medicamento se puede administrar en una dosis única o se puede dividir en infusiones diarias de 75 a 100 mg/m2 durante dos días consecutivos.
Cuando se use el producto medicinal Carmustine Accord en combinación con otros medicamentos con efecto mielosupresor o en pacientes con reserva de médula ósea disminuida, las dosis deben ajustarse según el perfil hematológico del paciente, como se describe a continuación.
Monitoreo y dosis posteriores
El siguiente curso de tratamiento con el producto medicinal Carmustine Accord se puede administrar solo cuando los parámetros de la morfología de la sangre hayan regresado a un nivel aceptable (número de plaquetas superior a 100.000/mm3, leucocitos superiores a 4.000/mm3), lo que generalmente ocurre dentro de seis semanas. La morfología de la sangre se debe controlar con frecuencia, y no se debe administrar el siguiente curso de tratamiento antes de que transcurran seis semanas debido al posible riesgo de toxicidad hematológica retardada.
Después de la dosis inicial, las dosis posteriores se deben ajustar según la respuesta hematológica del paciente al tratamiento anterior, tanto en monoterapia como en terapia combinada con otros medicamentos con efecto mielosupresor. Se sugiere el siguiente esquema de ajuste de dosis:
| Nivel más bajo después de la dosis anterior | Porcentaje de la dosis anterior | |
| Leucocitos/mm3 | Plaquetas/mm3 | |
| >4 000 | >100 000 | 100% |
| 3 000 – 3 999 | 75 000 – 99 999 | 100% |
| 2 000 – 2 999 | 25 000 – 74 999 | 70% |
| <2 000< td> | <25 000< td> | 50% |
En caso de que el nivel más bajo después de la dosis anterior no se encuentre en la misma fila para leucocitos y plaquetas (por ejemplo, leucocitos >4.000 y plaquetas <25.000), se debe aplicar el valor correspondiente al porcentaje más bajo de la dosis anterior (por ejemplo, plaquetas <25.000 - se debe aplicar como máximo el 50% de la dosis anterior).
No hay limitaciones en cuanto al período de tratamiento con carmustina. En caso de que el tumor no responda o aparezcan efectos adversos graves o no tolerados, el tratamiento con carmustina debe interrumpirse.
Tratamiento de acondicionamiento antes del trasplante de células madre hematopoyéticas
La carmustina se administra por vía intravenosa en una dosis de 300-600 mg/m2 en combinación con otros quimioterapeutas a pacientes con enfermedad hematológica maligna, antes del trasplante de células madre hematopoyéticas.
Grupos de pacientes especiales
Niños y adolescentes
No se debe usar carmustina en niños y adolescentes menores de 18 años debido a la seguridad del medicamento.
Pacientes de edad avanzada
En general, en pacientes de edad avanzada, las dosis deben seleccionarse con cuidado, y en particular, se debe tener en cuenta la presencia de trastornos de la función hepática, renal o cardíaca; enfermedades concomitantes y tratamiento con otros medicamentos. Debido a que en los pacientes de edad avanzada es más frecuente la presencia de trastornos de la función renal, se debe tener cuidado al seleccionar la dosis y controlar el coeficiente de filtración glomerular, así como reducir la dosis según sea necesario.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorAccord Healthcare B.V. Accord Healthcare Polska Sp. z o.o. Laboratori Fundació Dau
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Carmustine AccordForma farmacéutica: Polvo, 50 mgPrincipio activo: CarmustinaRequiere recetaForma farmacéutica: Polvo, 300 mgPrincipio activo: CarmustinaRequiere recetaForma farmacéutica: Polvo, 100 mgPrincipio activo: CarmustinaRequiere receta
Alternativas a Carmustine Accord en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Carmustine Accord en Spain
Alternativa a Carmustine Accord en Ukraine
Médicos online para Carmustine Accord
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Carmustine Accord – sujeta a valoración médica y normativa local.