
Adacel
Consulta con un médico sobre la receta médica de Adacel

Cómo usar Adacel
Hoja de instrucciones del paquete: información para el usuario
ADACEL
Suspensión para inyección en jeringa precargada
Vacuna contra el tétanos, la difteria y la tos ferina (acelular, combinada), adsorbida, con contenido reducido de antígenos
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de administrar la vacuna a un adulto o un niño, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico, farmacéutico o enfermera.
- Esta vacuna ha sido prescrita específicamente para esta persona. No debe dársela a otros.
- Si un adulto o un niño experimenta algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a un médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es la vacuna ADACEL y para qué se utiliza
- 2. Información importante antes de administrar la vacuna ADACEL
- 3. Cómo administrar la vacuna ADACEL
- 4. Posibles efectos adversos
- 5. Cómo almacenar la vacuna ADACEL
- 6. Contenido del paquete y otra información
1. Qué es la vacuna ADACEL y para qué se utiliza
ADACEL (Tdap) es una vacuna. Las vacunas se utilizan para proteger contra enfermedades infecciosas. El efecto de las vacunas consiste en estimular el organismo para que produzca su propia protección contra las bacterias que causan la enfermedad en cuestión.
Esta vacuna se utiliza para aumentar la protección contra el tétanos, la difteria y la tos ferina (tos ferina) en niños a partir de 4 años, en adolescentes y adultos después de un ciclo completo de vacunación básica.
La administración de la vacuna ADACEL a una mujer embarazada permite transferir la protección al niño durante el embarazo para protegerlo contra la tos ferina durante los primeros meses de vida del niño.
Límites de la protección proporcionada
La vacuna ADACEL solo previene las enfermedades causadas por las bacterias contra las que está dirigida la vacuna. Es posible contraer enfermedades similares si son causadas por otras bacterias o virus.
La vacuna ADACEL no contiene bacterias o virus vivos y no puede causar ninguna de las enfermedades infecciosas contra las que protege.
Es importante recordar que ninguna vacuna proporciona una protección total y de por vida en todas las personas vacunadas.
2. Información importante antes de administrar la vacuna ADACEL
Para asegurarse de que la vacuna ADACEL sea adecuada para un adulto o un niño, es importante informar al médico o enfermera si alguna de las siguientes condiciones se aplica a la persona o niño en cuestión. Si algo no está claro, debe pedir al médico o enfermera que lo explique.
Cuándo no administrar la vacuna ADACEL
- si ocurre una reacción alérgica:
- contra las vacunas contra el tétanos, la difteria o la tos ferina,
- contra cualquier otro componente (enumerado en el punto 6), Página 1 de 10
- contra cualquier sustancia residual del proceso de fabricación (formaldehído, glutaraldehído), que pueden estar presentes en cantidades residuales.
- si hubo una reacción grave en el cerebro dentro de una semana después de la última dosis de vacuna contra la tos ferina
- si hay una enfermedad aguda y grave con fiebre. La vacunación debe retrasarse hasta la recuperación. Una enfermedad leve sin fiebre generalmente no es una razón para retrasar la vacunación. El médico determinará si el adulto o el niño pueden recibir la vacuna ADACEL.
Advertencias y precauciones
Antes de administrar la vacuna, debe informar al médico o enfermera:
- sobre la administración de una dosis de refuerzo de vacuna contra el tétanos o la difteria en las últimas 4 semanas. En tal caso, la persona o el niño no deben recibir la vacuna ADACEL y el médico, basándose en las recomendaciones oficiales, decidirá cuándo es posible recibir la próxima dosis.
- si dentro de las 6 semanas después de la última dosis de vacuna contra el tétanos se produjo un síndrome de Guillain-Barré (pérdida temporal de la capacidad de moverse o sentir en todas o algunas partes del cuerpo). El médico decidirá si la vacuna ADACEL debe administrarse.
- sobre una enfermedad progresiva que afecta el cerebro y/o los nervios o convulsiones no controladas. El médico comenzará el tratamiento y luego administrará la vacuna después de que la condición del paciente se estabilice.
- sobre un sistema inmunológico débil o debilitado, debido a
- tratamiento (por ejemplo, esteroides, quimioterapia o radioterapia)
- infección por el virus del VIH o SIDA
- cualquier otra enfermedad.
La vacuna puede no ser tan efectiva en personas con sistemas inmunológicos debilitados. Si es posible, la vacunación debe retrasarse hasta que la enfermedad o el tratamiento haya terminado.
- sobre cualquier problema de sangre que cause moretones fáciles o sangrado prolongado después de un pequeño corte (por ejemplo, debido a una enfermedad de la sangre, como la hemofilia o la trombocitopenia, o al uso de medicamentos que diluyen la sangre).
El desmayo puede ocurrir después o incluso antes de cualquier inyección. Por lo tanto, debe informar al médico o enfermera si el paciente o su hijo han experimentado desmayos con inyecciones anteriores.
Antes de administrar la vacuna ADACEL, debe informar al médico, farmacéutico o enfermera si la persona o el niño tienen una reacción alérgica al látex. Las jeringas precargadas (1,5 ml) con tapas de punta suaves contienen un derivado de goma natural de látex, que puede causar una reacción alérgica.
La vacuna ADACEL y otras vacunas o medicamentos
Debe informar al médico, enfermera o farmacéutico sobre los medicamentos que el paciente está tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
La vacuna ADACEL no contiene bacterias vivas, por lo que generalmente se puede administrar al mismo tiempo que otras vacunas o inmunoglobulinas, pero en diferentes partes del cuerpo. Los estudios han demostrado que la vacuna ADACEL se puede administrar al mismo tiempo que cualquiera de las siguientes vacunas: vacuna contra la hepatitis B, vacuna contra la poliomielitis (inactivada o oral), vacuna inactivada contra la gripe y vacuna recombinante contra el virus del papiloma humano. La inyección de más de una vacuna al mismo tiempo se realizará en diferentes extremidades.
En el caso de un tratamiento que afecte el sistema circulatorio o inmunológico (como medicamentos que diluyen la sangre, esteroides o quimioterapia), véase el punto "Advertencias y precauciones", anterior.
Página 2 de 10
Embarazo, lactancia y fertilidad
Si el paciente está embarazado o en período de lactancia, o si se sospecha que está embarazado o planea tener un hijo, debe consultar a un médico o enfermera. El médico ayudará a decidir si el paciente embarazado debe recibir la vacuna ADACEL.
Conducción de vehículos y uso de máquinas
No se ha estudiado el efecto de la vacuna en la capacidad de conducir vehículos o operar máquinas.
La vacuna ADACEL no tiene efecto o tiene un efecto insignificante en la capacidad de conducir vehículos mecánicos y operar máquinas.
3. Cómo administrar la vacuna ADACEL
Cuándo debe administrarse la vacuna
El médico determinará si la administración de la vacuna ADACEL es adecuada, dependiendo de:
- el tipo de vacunas administradas anteriormente,
- el número de dosis de vacunas similares administradas anteriormente,
- el momento de la última dosis de vacuna similar. El médico decidirá qué tan grande debe ser el intervalo entre las vacunas. Si el paciente está embarazado, el médico ayudará a decidir si el paciente debe recibir la vacuna ADACEL durante el embarazo.
Dosis y vía de administración
Quién administrará la vacuna ADACEL?
La vacuna ADACEL debe ser administrada por un profesional de la salud capacitado en la administración de vacunas, en una clínica o consultorio equipado con equipo para tratar reacciones alérgicas graves y raras a la vacuna.
Dosis
Las personas de todas las edades para las que se indica la vacuna ADACEL reciben una sola inyección (0,5 ml).
En caso de una lesión que requiera profilaxis contra el tétanos, el médico puede decidir administrar la vacuna ADACEL con o sin inmunoglobulina antitetánica.
La vacuna ADACEL se puede utilizar para la vacunación de refuerzo. El médico aconsejará sobre la vacunación de refuerzo.
Vía de administración
El médico o enfermera administrará la vacuna en el músculo del brazo superior (músculo deltoides).
El médico o enfermera noadministrará la vacuna en un vaso sanguíneo, en las nalgas o bajo la piel. En caso de trastornos de coagulación, el médico o enfermera pueden decidir inyectar la vacuna bajo la piel, aunque esto puede causar más efectos adversos locales, incluido un pequeño bulto bajo la piel.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a un médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, la vacuna ADACEL puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Página 3 de 10
Reacciones alérgicas graves
Si alguno de los siguientes síntomas ocurre después de salir del lugar donde se administró la inyección, debe consultar a un médico de inmediato:
dificultad para respirar
azulamiento de la lengua o los labios
erupción cutánea
hinchazón de la cara o la garganta
presión arterial baja, que causa mareos o desmayo
Estos síntomas generalmente ocurren muy pronto después de la inyección, mientras la persona aún está en la clínica o consultorio. Las reacciones alérgicas graves son muy raras después de la administración de cualquier vacuna (pueden ocurrir en hasta 1 de cada 10,000 personas).
Otros efectos adversos:
Durante los estudios clínicos realizados en ciertos grupos de edad, se observaron los siguientes efectos adversos:
Niños de 4 a 6 años
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- pérdida de apetito
- dolor de cabeza
- diarrea
- fatiga
- dolor
- enrojecimiento
- hinchazón en el lugar de la inyección
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas):
- náuseas
- vómitos
- erupción cutánea
- dolores (en todo el cuerpo) o debilidad muscular
- dolor o hinchazón de las articulaciones
- fiebre
- escalofríos
- aumento de tamaño o dolor de los ganglios linfáticos en las axilas
Adolescentes de 11 a 17 años
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- dolor de cabeza
- diarrea
- náuseas
- dolores (en todo el cuerpo) o debilidad muscular
- dolor o hinchazón de las articulaciones
- fatiga o debilidad
- malestar general
- escalofríos
- dolor
- enrojecimiento e hinchazón en el lugar de la inyección.
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas):
- vómitos
- erupción cutánea
- fiebre
- aumento de tamaño o dolor de los ganglios linfáticos en las axilas
Página 4 de 10
Adultos de 18 a 64 años
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- dolor de cabeza
- diarrea
- dolores (en todo el cuerpo) o debilidad muscular
- fatiga o debilidad
- malestar general
- dolor
- enrojecimiento e hinchazón en el lugar de la inyección
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas):
- náuseas
- vómitos
- erupción cutánea
- dolor o hinchazón de las articulaciones
- fiebre
- escalofríos
- aumento de tamaño o dolor de los ganglios linfáticos en las axilas
Después de la comercialización de la vacuna ADACEL, se han observado los siguientes efectos adversos adicionales en varios grupos de edad para los que se recomienda la vacuna. La frecuencia de estos efectos adversos no se puede calcular con precisión, ya que se trata de informes voluntarios y deben relacionarse con el número estimado de personas vacunadas.
Reacciones alérgicas / reacciones alérgicas graves (como se describe al comienzo del punto 4), sensación de hormigueo y entumecimiento o entumecimiento, parálisis de parte o todo el cuerpo (síndrome de Guillain-Barré), inflamación de los nervios en el hombro (inflamación del nervio del hombro), trastornos de la función del nervio facial (parálisis del nervio facial), convulsiones (convulsiones), desmayos, inflamación de la médula espinal, inflamación del músculo cardíaco, picazón, urticaria, inflamación de los músculos, hinchazón generalizada de las extremidades, asociada con enrojecimiento, sensación de calor, sensibilidad o dolor en el lugar de la inyección de la vacuna, moretones, absceso o pequeño bulto en el lugar de la inyección de la vacuna.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a un médico, farmacéutico o enfermera. Los efectos adversos se pueden notificar directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Plaza de la Marina Española, 5, 28071 Madrid, teléfono: +34 91 596 34 00, fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también se pueden notificar al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo almacenar la vacuna ADACEL
El medicamento debe almacenarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe utilizarse la vacuna ADACEL después de la fecha de caducidad que figura en el etiquetado después de "VENC". La fecha de caducidad es el último día del mes indicado.
Almacenar en refrigerador (2°C–8°C). No congelar. Desechar la vacuna si ha sido congelada.
Las jeringas precargadas deben almacenarse en el paquete exterior para protegerlas de la luz.
No debe desecharse el medicamento por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
Página 5 de 10
6. Contenido del paquete y otra información
Qué contiene la vacuna ADACEL?
Los principios activos de cada dosis (0,5 ml) de la vacuna son:
Toxoides de la difteria
no menos de 2 unidades internacionales (2 Lf)
Toxoides del tétanos
no menos de 20 unidades internacionales (5 Lf)
Antígenos de la tos ferina:
Toxoides de la tos ferina
2,5 microgramos
Hemaglutinina filamentosa
5 microgramos
Pertactina
3 microgramos
Fimbrias de tipo 2 y 3
5 microgramos
Adsorbidos en fosfato de aluminio
1,5 mg (0,33 mg de Al)
El fosfato de aluminio actúa como adyuvante en esta vacuna. Los adyuvantes son sustancias que forman parte de algunas vacunas y tienen la función de aumentar, mejorar o prolongar el efecto protector de la vacuna.
Otros componentes son: fenoxietanol, agua para inyección
Cómo se presenta la vacuna ADACEL y qué contiene el paquete?
La vacuna ADACEL es una suspensión para inyección en jeringa precargada (0,5 ml):
- sin aguja - paquete de 1 o 10
- con 1 o 2 agujas separadas - paquete de 1 o 10
- con aguja separada en cubierta de protección - paquete de 1 o 10
No todos los tipos de paquetes pueden estar disponibles.
La apariencia correcta de la vacuna es una suspensión turbia y blanca. Durante el almacenamiento, puede formarse un sedimento blanco y grumos o agregados escamosos. Después de agitar, se convierte en un líquido blanco uniforme; en caso de que estén presentes agregados, el producto se puede agitar nuevamente hasta obtener una suspensión uniforme.
Título del titular de la autorización de comercialización y fabricante / importador
Título del titular de la autorización de comercialización
Sanofi Winthrop Industrie
82 Avenue Raspail
94250 Gentilly
Francia
Fabricante
Sanofi Winthrop Industrie
Voie de l’Institut - Parc Industriel d’Incarville
B.P 101
27100 Val de Reuil
Francia
Sanofi-Aventis Zrt., Budapest Logistics and Distribution Platform
H-1225 Budapest
Building DC5, Campona utca. 1 (Harbor Park)
Hungría
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Austria, Alemania
Covaxis
Página 6 de 10
Bélgica, Dinamarca, Finlandia, Francia, Grecia, España, Países Bajos, Irlanda,
Luxemburgo, Noruega, Portugal, Suecia, Italia:
Triaxis
Bulgaria, Croacia, Chipre, República Checa, Estonia, Lituania, Letonia, Malta, Polonia,
Rumania, Eslovaquia, Eslovenia, Hungría, Reino Unido (Irlanda del Norte):
ADACEL
Fecha de la última revisión de la hoja de instrucciones:enero 2025
Información destinada exclusivamente a profesionales de la salud:
Como no se han realizado estudios sobre la incompatibilidad, la vacuna ADACEL no debe mezclarse con otros medicamentos.
Preparación para la administración
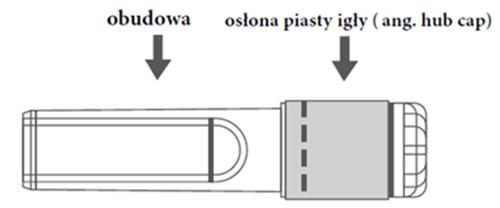
La jeringa precargada puede estar equipada con una punta Luer Lock con una tapa de punta suave (Figura A) o con una tapa de punta rígida (Figura B). La jeringa con la suspensión para inyección debe ser evaluada visualmente antes de la administración. En caso de partículas extrañas sólidas, fuga, uso prematuro del émbolo o daño en el sello de la punta, la jeringa precargada debe ser desechada. La jeringa está diseñada para un solo uso y no debe ser reutilizada.
Instrucciones para el uso de la jeringa precargada con punta Luer Lock
Figura A: Jeringa con punta Luer Lock y tapa de punta suave
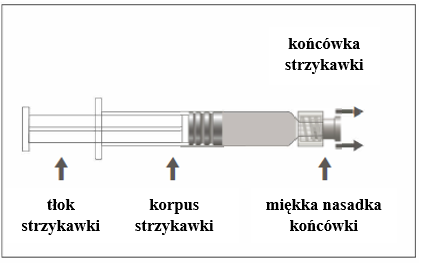 | ||
| Paso 1: Sosteniendo la punta de la jeringa con una mano (evite sostener el émbolo o el cuerpo de la jeringa), retire la tapa de la punta. | 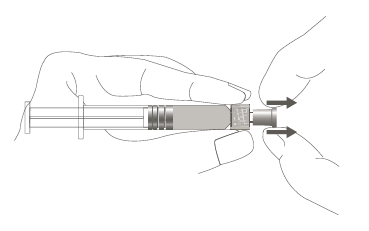 | |
Página 7 de 10
| Paso 2: Para fijar la aguja a la jeringa, gírela suavemente en la punta hasta que sienta una ligera resistencia. | 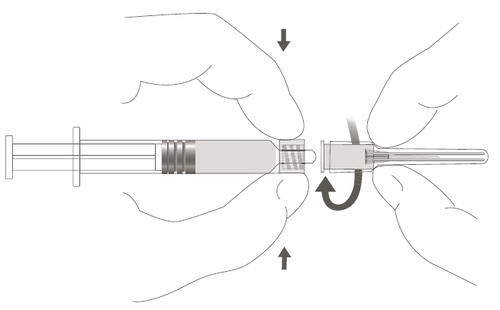 |
Figura B: Jeringa con punta Luer Lock y tapa de punta rígida
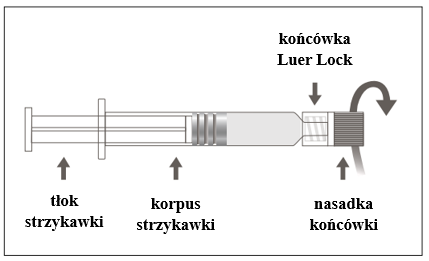
| Paso 1: Sosteniendo la punta Luer Lock con una mano (evite sostener el émbolo o el cuerpo de la jeringa), gire la tapa de la punta hacia afuera. | 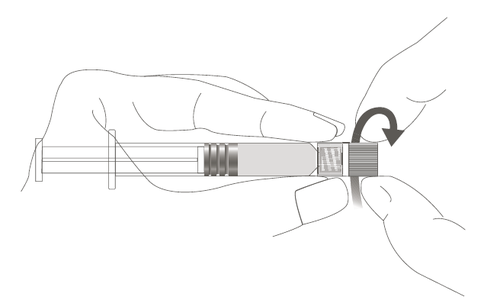 |
| Paso 2: Para fijar la aguja a la jeringa, gírela suavemente en la punta Luer Lock hasta que sienta una ligera resistencia. | 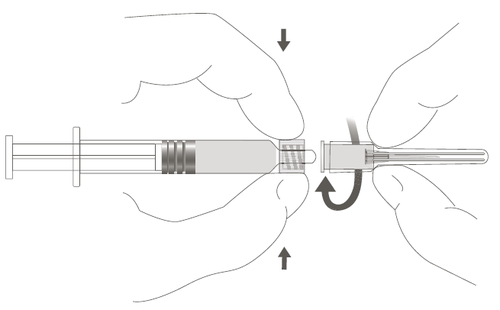 |
Lock:
Página 8 de 10
Debe realizar los pasos anteriores 1 y 2 para preparar la jeringa con punta Luer Lock y la aguja para fijarla.
| Figura C: Aguja con cubierta de protección (en su cubierta) | Figura D: Componentes de la cubierta de protección de la aguja (preparados para el uso) |
 |  |
Paso 3: Retire la cubierta de la aguja. La aguja está protegida por una cubierta de protección y una tapa de protección.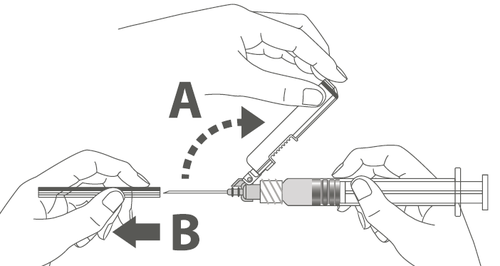 | |
| Paso 4: A: Aleje la cubierta de protección de la aguja en la dirección del cuerpo de la jeringa bajo el ángulo mostrado. B: Retire la tapa de protección. | |
| Paso 5: Después de la inyección, bloquee (active) la cubierta de protección, utilizando una de las tres (3) técnicas de manejo de una mano: activación en una superficie plana, con el pulgar o el dedo índice. Nota: La activación se confirma con un "clic" audible y/o palpable. | 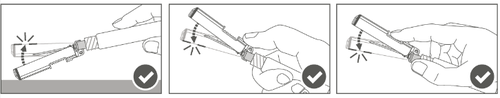 |
| Paso 6: Verifique visualmente el funcionamiento de la cubierta de protección. La cubierta de protección debe estar completamente bloqueada (activada), como se muestra en la Figura C. |  |
Página 9 de 10
| La Figura D muestra que la cubierta de protección NO está completamente bloqueada (no está activada). | 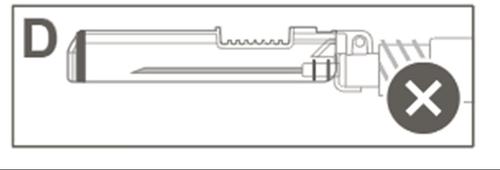 |
| Advertencia: No debe intentar desbloquear (desactivar) el dispositivo de protección empujando la aguja fuera de la cubierta de protección. | |
Debe eliminarse cualquier residuo no utilizado del medicamento o sus desechos de acuerdo con las regulaciones locales.
No debe volver a colocar las cubiertas en las agujas.
Página 10 de 10
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorSanofi Winthrop Industrie Sanofi-Aventis Zrt.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a AdacelForma farmacéutica: Suspensión, 0.5 mlPrincipio activo: pertussis, purified antigen, combinations with toxoidsFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Suspensión, 1 dosis (0.5 ml)Principio activo: pertussis, purified antigen, combinations with toxoidsFabricante: AJ Vaccines A/SRequiere recetaForma farmacéutica: Suspensión, no menos de 30 UI de toxoide diftérico, no menos de 40 UI de toxoide tetánico y no menos de 4 UI de suspensión de cepa inactivada de Bordetella pertussis/0,5 ml; 1 día; 1 dosis (0,5 ml)Principio activo: pertussis, inactivated, whole cell, combinations with toxoidsRequiere receta
Alternativas a Adacel en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Adacel en Україна
Alternativa a Adacel en Іспанія
Médicos online para Adacel
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Adacel – sujeta a valoración médica y normativa local.














