
PEDMARQSI 80 mg/mL SOLUTION FOR INFUSION

How to use PEDMARQSI 80 mg/mL SOLUTION FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show translationContents of the leaflet
Introducción
Prospecto: información para el paciente
Pedmarqsi 80 mg/ml solución para perfusión
tiosulfato de sodio
Lea todo el prospecto detenidamente antes de que usted o su hijo empiece a tomar este medicamento, porque contiene información importante.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si usted o su hijo experimentan efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Pedmarqsi y para qué se utiliza
- Qué necesita saber antes de que usted o su hijo/a empiece a recibir Pedmarqsi
- Cómo se administra Pedmarqsi
- Posibles efectos adversos
- Conservación de Pedmarqsi
- Contenido del envase e información adicional
1. Qué es Pedmarqsi y para qué se utiliza
Pedmarqsi contiene el principio activo tiosulfato de sodio.
Pedmarqsi se utiliza para reducir el riesgo de pérdida de audición por cisplatino, que es un medicamento contra el cáncer. Se administra a niños y adolescentes de entre 1 mes y 18 años que están siendo tratados con cisplatino por tumores sólidos que no se han extendido a otras zonas del organismo.
2. Qué necesita saber antes de que usted o su hijo/a empiece a recibir Pedmarqsi
No administrar Pedmarqsi
si el niño es:
- alérgico al tiosulfato de sodio o a alguno de los demás componentes de este medicamento (incluidos en la sección 6)
- un bebé menor de 1 mes de edad
Advertencias y precauciones
Consulte a su médico o enfermero antes de que usted o su hijo/a reciba Pedmarqsi si el niño:
- ha tenido una reacción alérgica, como erupción cutánea, urticaria o dificultad para respirar tras una dosis previa de tiosulfato de sodio
- tiene una alergia conocida a sustancias químicas llamadas sulfitos, lo que puede significar que usted o el niño tienen más probabilidades de tener una reacción alérgica a este medicamento.
- tiene una función renal deficiente o una enfermedad renal grave
- necesita una dieta baja en sal debido a otra enfermedad
Otros medicamentos y Pedmarqsi
Informe a su médico o enfermero si usted o su hijo/a está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Embarazo y lactancia
Este medicamento no debe administrarse si usted o su hija está embarazada (o pudiera estar embarazada) o si está dando el pecho. Este medicamento solo se administra después de la quimioterapia con cisplatino y el cisplatino puede dañar a su bebé. Consulte a su médico si es necesario utilizar métodos anticonceptivos durante el tratamiento y durante 6 meses después del mismo.
Pedmarqsi contiene ácido bórico
Este medicamento contiene ácido bórico que puede afectar a la fertilidad cuando se administra de forma prolongada.
Pedmarqsi contiene sodio
Este medicamento contiene 23 mg de sodio (principal componente de la sal de cocina/de mesa) en cada ml. Esto equivale al 1-2 % de la ingesta alimentaria segura de sodio en niños de 1 a 17 años y al 12 % en bebés de 7 a 11 meses.
3. Cómo se administra Pedmarqsi
Antes de que usted o su hijo/a reciba este medicamento, se le administrarán medicamentos contra las náuseas para ayudar a prevenir los vómitos.
Este medicamento es una solución que un médico o enfermero administra mediante perfusión (gota a gota) en una vena. Esto suele hacerse a través de un tubo insertado en una vena en el tórax, conocido como vía central. La perfusión se administra durante 15 minutos. El tratamiento se inicia 6 horas después de la finalización de la dosis de cisplatino.
La dosis de este medicamento se calcula en función de su tamaño (superficie corporal) en m2, que se calcula a partir de la estatura y el peso. La dosis recomendada para quienes pesen 10 kg o más es de 12,8 g por m2; se administran dosis más bajas a aquellas personas que pesen menos de 10 kg. Su médico determinará la dosis que sea adecuada para usted o para su hijo.
Si usted o su hijo reciben más Pedmarqsi de lo que debería
Debido a que la dosis la calculan y la controlan los profesionales sanitarios, es poco probable que usted o su hijo reciban la cantidad incorrecta. En caso de sobredosis, usted o su hijo pueden sufrir náuseas, vómitos, cambios en la concentración de sodio, fosfato o potasio en la sangre, cambios en la presión arterial o acidez de la sangre (acidosis metabólica) que pueden causar náuseas, vómitos, somnolencia y dificultad para respirar. Su médico podría darle a usted o a su hijo tratamiento sintomático para estos efectos adversos.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Si usted o su hijo presenta una reacción alérgica grave a este medicamento con síntomas como erupción cutánea, opresión en el pecho, sibilancias, dificultad para respirar o sensación de frío, debe informar inmediatamente a su médico o enfermero.
Otros efectos adversos
Los otros efectos adversos observados con este medicamento suelen ser leves. Los efectos adversos que usted o su hijo pueden sufrir son:
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- Malestar (náuseas)
- Vómitos
- Reducción del nivel de fosfato o potasio que se observa en los análisis de sangre
- Aumento del nivel de sodio que se observa en los análisis de sangre
Frecuentes(pueden afectar a más de 1 de cada 100 personas)
- Aumento o disminución de la presión arterial
- Reducción del nivel de calcio que se observa en los análisis de sangre
- Acidez de la sangre (acidosis metabólica) que puede causar náuseas, vómitos, somnolencia y dificultad para respirar
Comunicación de efectos adversos
Si usted o su hijo experimentan efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Pedmarqsi
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Pedmarqsi
- El principio activo es tiosulfato de sodio, en forma anhidra.
- Los demás componentes son:
- ácido bórico (0,25 mg/ml)
- agua para preparaciones inyectables
- ácido clorhídrico e hidróxido de sodio para el ajuste del pH (ver sección 2; Pedmarqsi contiene sodio).
Aspecto del producto y contenido del envase
Este medicamento es una solución para infusión intravenosa.
Este medicamento es una solución estéril clara e incolora suministrada en viales de vidrio claros sellados con un tapón de goma y un sobresellado abatible de aluminio. Cada caja contiene un vial.
Titular de la autorización de comercialización y Responsable de la fabricación
Norgine B.V.
Antonio Vivaldistraat 150
1083 HP Amsterdam
Países Bajos
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
----------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
Posología y forma de administración
Tiempo de administración en relación con el cisplatino
El momento de la administración de tiosulfato de sodio en relación con la quimioterapia con cisplatino es crítico.
Si se administra tiosulfato de sodio:
- en menos de 6 horas después del final de la perfusión de cisplatino: puede reducir la eficacia del cisplatino contra el tumor
- transcurridas más de 6 horas después del final de la perfusión de cisplatino: puede no ser eficaz para prevenir la ototoxicidad.
Utilice tiosulfato de sodio únicamente después de una perfusión de cisplatino que haya durado 6 horas o menos. No utilice tiosulfato de sodio si:
- la perfusión de cisplatino supera las 6 horas o
- está prevista, en las 6 horas siguientes, una perfusión posterior de cisplatino.
Cuando el cisplatino se administra en días consecutivos, debe garantizarse un intervalo mínimo de 6 horas entre la perfusión de tiosulfato de sodio y la posterior perfusión de cisplatino.
Después del final de la perfusión de cisplatino:
- Administre un tratamiento antiemético intravenoso multiagente muy eficaz 30 minutos antes de la administración de tiosulfato de sodio, es decir, 5,5 horas después de la finalización de la perfusión de cisplatino
- Este medicamento es una solución para perfusión lista para usar
- Prepare los ml necesarios de tiosulfato de sodio, 80 mg/ml, en una jeringa o añádalos a una bolsa de perfusión estéril vacía
- Detenga el líquido de hidratación de cisplatino y limpie la vía con cloruro de sodio al 0,9 %
- Perfunda el tiosulfato de sodio durante 15 minutos (6 horas después de terminar la perfusión de cisplatino)
- Limpie la vía con cloruro sódico al 0,9 % y reanude la hidratación para el cisplatino inmediatamente después.
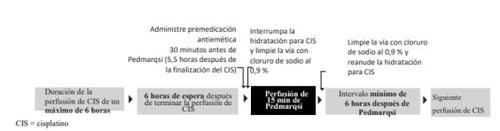
Consulte el apartado «Tiempo de administración en relación con el cisplatino» para obtener información crucial sobre el momento de la administración de tiosulfato de sodio.
Este medicamento se presenta en un vial de un solo uso que contiene 8 g en una concentración de 80 mg/ml. La dosis recomendada de tiosulfato de sodio para la prevención de la ototoxicidad inducida por cisplatino se basa en el peso y se normaliza en función de la superficie corporal según la tabla siguiente:
Peso corporal | Dosis | Volumen |
>10 kg | 12,8 g/m2 | 160 ml/m2 |
5 a 10 kg | 9,6 g/m2 | 120 ml/m2 |
<5 kg | 6,4 g/m2 | 80 ml/m2 |
Instrucciones de uso, manipulación y eliminación
Este medicamento está destinado para un solo uso. La eliminación de las partes no utilizadas de la solución se realizará de acuerdo con la normativa local.
Se ha demostrado la estabilidad química y física en uso durante 24 horas a temperatura ambiente controlada para el producto conservado en bolsas intravenosas de cloruro de polivinilo, acetato de vinilo etileno y poliolefina.
Desde un punto de vista microbiano, el producto se debe usar de inmediato después de la apertura. Si no se utiliza inmediatamente, los tiempos y condiciones de conservación antes del uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas entre 2 y 8 ºC.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to PEDMARQSI 80 mg/mL SOLUTION FOR INFUSIONDosage form: INJECTABLE, 0.5 mg/5 mlActive substance: flumazenilManufacturer: Cheplapharm Arzneimittel GmbhPrescription requiredDosage form: INJECTABLE, 1 mg flumazenil/10 mlActive substance: flumazenilManufacturer: Cheplapharm Arzneimittel GmbhPrescription requiredDosage form: INJECTABLE, 100 mgActive substance: sugammadexManufacturer: Merck Sharp & Dohme B.V.Prescription required
Online doctors for PEDMARQSI 80 mg/mL SOLUTION FOR INFUSION
Discuss questions about PEDMARQSI 80 mg/mL SOLUTION FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions






