VEDROP 50 mg/ml SOLUÇÃO ORAL

Pergunte a um médico sobre a prescrição de VEDROP 50 mg/ml SOLUÇÃO ORAL

Como usar VEDROP 50 mg/ml SOLUÇÃO ORAL
Introdução
Prospecto: informação para o utilizador
Vedrop 50 mg/ml em solução oral
Tocofersolano
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a tomar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Vedrop e para que é utilizado
- O que necessita saber antes de começar a tomar Vedrop
- Como tomar Vedrop
- Possíveis efeitos adversos
- Conservação de Vedrop
- Conteúdo do envase e informação adicional
1. O que é Vedrop e para que é utilizado
Vedrop contém vitamina E (na forma de tocofersolano). Este medicamento é utilizado para tratar a carência de vitamina E produzida pela má absorção digestiva (pela qual os nutrientes dos alimentos não se absorvem facilmente durante a digestão) em pacientes com idades compreendidas entre o nascimento (recém-nascidos a termo) até os 18 anos com colestase crónica (doença hereditária ou congénita em que a bile não pode passar do fígado para o intestino).
2. O que necessita saber antes de começar a tomar Vedrop
Não tome Vedrop
- Se for alérgico à vitamina E (d-alfa tocoferol ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
- Vedrop não deve ser administrado a bebés prematuros.
Advertências e precauções
Consulte o seu médico antes de começar a tomar Vedrop se tiver:
- Problemas de rim ou desidratação. Vedrop deve ser utilizado com precaução e deve ser vigilada cuidadosamente a função renal, porque o polietilenglicol, que faz parte do princípio ativo tocofersolano, pode danificar os rins.
- Problemas de fígado. Vedrop deve ser utilizado com precaução e as funções do fígado devem ser vigiladas estritamente.
Toma de Vedrop com outros medicamentos
Informa o seu médico ou farmacêutico se estiver a tomar ou tiver tomado recentemente ou possa ter que tomar qualquer outro medicamento.
Informa o seu médico ou farmacêutico se estiver a tomar:
- Certos medicamentos que diminuem a viscosidade do sangue (anticoagulantes orais, como a warfarina). O seu médico pedir-lhe-á que se submeta a análises de sangue regulares e poderá ajustar a dose para evitar um maior risco de hemorragia.
- Vitaminas lipossolúveis (como as vitaminas A, D, E ou K) ou medicamentos altamente lipossolúveis (como os corticoides, ciclosporina, tacrolimus, antihistamínicos). Vedrop pode aumentar a sua absorção durante a digestão, por isso o médico supervisionará o efeito do tratamento e ajustará a dose quando necessário.
Gravidez e amamentação
Não existem dados clínicos disponíveis sobre a utilização deste medicamento durante a gravidez. Informe o seu médico se estiver grávida para que decida se é conveniente utilizar o medicamento.
Não existem dados sobre se este medicamento é excretado no leite materno. Informe o seu médico se deseja amamentar o seu filho para que decida se é conveniente utilizar o medicamento. O seu médico ajudá-lo-á a tomar a melhor decisão para si e para o seu filho.
Consulte o seu médico ou farmacêutico antes de tomar qualquer medicamento.
Condução e uso de máquinas
É pouco provável que Vedrop afete a sua capacidade para conduzir e utilizar máquinas.
Vedrop contém metil-parahidroxibenzoato sódico (E219) e etil-parahidroxibenzoato sódico (E215), que podem produzir reações alérgicas (possivelmente retardadas).
Vedrop contém 0,18 mmoles (4,1 mg) de sódio por ml. Consulte o seu médico se segue uma dieta pobre em sódio.
3. Como tomar Vedrop
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose habitual é de 0,34 ml/kg/dia.
O seu médico prescrever-lhe-á a dose em ml.
O médico modificará a dose deste medicamento de acordo com os seus níveis de vitamina E no sangue.
Forma de administração
Engula a solução com ou sem água. Use apenas com a seringa para uso oral que está incluída no envase.
Pode tomar Vedrop antes ou durante as refeições, com ou sem água.
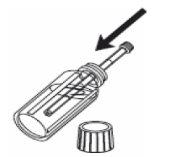
Para medir a dose:
1- Abra o frasco. 2- Introduza a seringa de uso oral no frasco. |
|
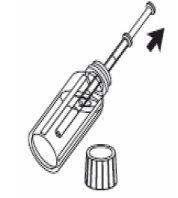
3- Encha a seringa de uso oral com o líquido, puxando o êmbolo até a marca de referência correspondente à quantidade em mililitros (ml) que o seu médico prescreveu. |
|
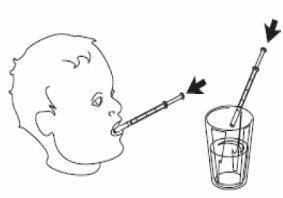
4- Retire a seringa de uso oral do frasco. 5- Esvazie o conteúdo da seringa, pressionando sobre o êmbolo até o fundo, seja:
ou
|
|
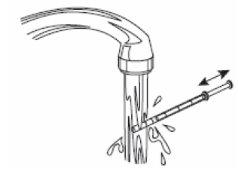
6- Feche o frasco. 7- Lave a seringa com água. |
|
Se tomar mais Vedrop do que deve
Se tomar doses altas de vitamina E, pode sofrer de diarreia e dor de estômago transitórias. Consulte o seu médico ou farmacêutico se os sintomas persistirem mais de dois dias.
Se esquecer de tomar Vedrop
Não tome a dose que esqueceu e volte à pauta de administração regular programada. Não tome uma dose dupla para compensar as doses esquecidas.
Se interromper o tratamento com Vedrop
Não interrompa o tratamento sem consultar o seu médico, porque pode voltar a produzir-se uma carência de vitamina E que afete a sua saúde. Entre em contato com o seu médico ou farmacêutico antes de interrompê-lo.
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Foram comunicados os seguintes efeitos adversos:
Efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas)
- Diarreia
Efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas)
- Astenia (sensação de fraqueza)
- Cefaleia
- Perda de cabelo
- Coceira
- Erupção cutânea
- Níveis anormais de sódio no sangue
- Níveis anormais de potássio no sangue
- Aumento das transaminases (enzimas hepáticas)
Frequência não conhecida(não pode ser estimada a partir dos dados disponíveis)
- Dor de estômago
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Anexo V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Vedrop
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece no envase e no frasco após EXP. A data de validade é o último dia do mês que se indica.
- Este medicamento não requer condições especiais de conservação.
- Elimine o medicamento um mês após a abertura, mesmo que reste alguma solução.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Vedrop
- O princípio ativo é tocofersolano. Cada ml de solução contém 50 mg de d-alfa-tocoferol na forma de tocofersolano, que equivalem a 74,5 UI de tocoferol.
- Os outros componentes são: sorbato potássico, metil-parahidroxibenzoato sódico (E219) e etil-parahidroxibenzoato sódico (E215) (ver o final da secção 2 para obter mais informação sobre estes 2 excipientes), glicerol, fosfato disódico dodecahidratado, ácido clorídrico concentrado, água ultrapurificada.
Aspecto de Vedrop e conteúdo do envase
Vedrop é uma solução oral de cor amarela pálida ligeiramente viscosa contida em um frasco de vidro de cor marrom, selado com tampa de segurança. Os frascos contêm 10 ml, 20 ml ou 60 ml de solução oral. Cada envase contém um frasco e uma seringa para uso oral (uma seringa de 1 ml com um frasco de 10 ml ou 20 ml, uma seringa de 2 ml com um frasco de 60 ml).
Titular da autorização de comercialização
Recordati Rare Diseases
Immeuble “Le Wilson”
70, avenue du General de Gaulle
F-92800 Puteaux
França
Responsável pela fabricação
Recordati Rare Diseases
Immeuble “Le Wilson”
70, avenue du Général de Gaulle
92800 Puteaux
França
ou
Recordati Rare Diseases
Eco River Parc
30, rue des Peupliers
F-92000 Nanterre
França
Pode solicitar mais informação sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização.
Bélgica/Bélgica/Bélgica Recordati Tel: +32 2 46101 36 | Lituânia Recordati AB. Tel: + 46 8 545 80 230 Suécia |
Grécia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França | Luxemburgo/Luxemburgo Recordati Tel: +32 2 46101 36 Bélgica |
República Checa Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França | Hungria Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França |
Dinamarca Recordati AB. Tel: +46 8 545 80 230 Suécia | Malta Recordati Rare Diseases Tel: +33 1 47 73 64 58 França |
Alemanha Recordati Rare Diseases Germany GmbH Tel: +49 731 140 554 0 | Países Baixos Recordati Tel: +32 2 46101 36 Bélgica |
Estônia Recordati AB. Tel: + 46 8 545 80 230 Suécia | Noruega Recordati AB. Tel: +46 8 545 80 230 Suécia |
Grécia Recordati Rare Diseases Tel: +33 1 47 73 64 58 França | Áustria Recordati Rare Diseases Germany GmbH Tel: +49 731 140 554 0 Alemanha |
Espanha Recordati Rare Diseases Spain S.L.U. Tel: + 34 91 659 28 90 | Polônia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França |
França Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 | Portugal Jaba Recordati S.A. Tel: +351 21 432 95 00 |
Croácia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França | Romênia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França |
Irlanda Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França | Eslovênia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França |
Islândia Recordati AB. Tel: +46 8 545 80 230 Suécia | Eslováquia Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 França |
Itália Recordati Rare Diseases Italy Srl Tel: +39 02 487 87 173 | Finlândia Recordati AB. Tel: +46 8 545 80 230 Suécia |
Chipre Recordati Rare Diseases Tel: +33 1 47 73 64 58 França | Suécia Recordati AB. Tel: +46 8 545 80 230 |
Letônia Recordati AB. Tel: + 46 8 545 80 230 Suécia | Reino Unido Recordati Rare Diseases UK Ltd. Tel: +44 (0)1491 414333 |
Data da última revisão deste prospecto:
Este medicamento foi autorizado em “circunstâncias excepcionais”. Esta modalidade de aprovação significa que, devido à rareza da sua doença, não foi possível obter informação completa sobre este medicamento.
A Agência Europeia de Medicamentos reverá anualmente a informação nova sobre este medicamento que possa estar disponível e este prospecto será atualizado quando necessário.
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu/.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VEDROP 50 mg/ml SOLUÇÃO ORALForma farmacêutica: SOLUÇÃO/SUSPENSÃO ORAL, 50 mg/mlSubstância ativa: tocofersolanFabricante: Recordati Rare DiseasesRequer receita médicaForma farmacêutica: CÁPSULA, 2000 mgSubstância ativa: tocopherol (vit E)Fabricante: Chiesi España S.A.U.Requer receita médicaForma farmacêutica: CÁPSULA, 400 mgSubstância ativa: tocopherol (vit E)Fabricante: Chiesi España S.A.U.Requer receita médica
Médicos online para VEDROP 50 mg/ml SOLUÇÃO ORAL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de VEDROP 50 mg/ml SOLUÇÃO ORAL – sujeita a avaliação médica e regras locais.