VABYSMO 120 mg/mL solução para injecção em seringa pré-carregada

Pergunte a um médico sobre a prescrição de VABYSMO 120 mg/mL solução para injecção em seringa pré-carregada

Como usar VABYSMO 120 mg/mL solução para injecção em seringa pré-carregada
Introdução
Prospecto: informação para o paciente
Vabysmo 120mg/ml solução injetável em seringa pré-carregada
faricimab
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar esses efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Vabysmo e para que é utilizado
- O que precisa saber antes de começar a usar Vabysmo
- Como usar Vabysmo
- Efeitos adversos possíveis
- Conservação de Vabysmo
- Conteúdo do envase e informação adicional
1. O que é Vabysmo e para que é utilizado
O que é Vabysmo e para que é utilizado
Vabysmo contém o princípio ativo faricimab, que pertence a um grupo de medicamentos chamados agentes anti-neo-vascularização.
Vabysmo é injetado no olho pelo seu médico para tratar distúrbios oculares em adultos chamados:
- degeneração macular associada à idade neo-vascular (exsudativa) (DMAn),
- alteração na visão devido ao edema macular diabético (EMD).
- alteração na visão devido ao edema macular causado por um bloqueio das veias retinianas (oclusão da ramo venosa retiniana (OVR) ou oclusão da veia central da retina (OVCR)).
Estes distúrbios afetam a mácula, a parte central da retina (a camada sensível à luz na parte de trás do olho) que é responsável pela visão fina e central. A DMAn ocorre devido ao crescimento de vasos sanguíneos anormais que permitem a filtragem de sangue e fluido dentro da mácula, e o EMD ocorre devido a vasos sanguíneos perfurados que causam inchaço da mácula. A OVCR é o bloqueio do vaso sanguíneo principal (veia) que transporta o sangue desde a retina e a OVR é o bloqueio de uma das ramas mais pequenas da veia principal. Devido ao aumento na pressão dentro das veias, há uma fuga de fluido para a retina, o que provoca inchaço da mácula (edema macular).
Como funciona Vabysmo
Vabysmo reconhece e bloqueia especificamente a atividade de algumas proteínas conhecidas como angiopoietina-2 e fator de crescimento endotelial vascular A. Quando estas proteínas estão presentes a níveis superiores ao normal, podem causar o crescimento de vasos sanguíneos anormais e/ou dano nos vasos normais, com fuga dentro da mácula, causando inchaço ou dano que pode afetar negativamente a visão da pessoa. Unindo-se a estas proteínas, Vabysmo pode bloquear suas ações e prevenir o crescimento anormal dos vasos, a fuga e o inchaço. Vabysmo pode melhorar a doença e/ou retardar o agravamento da doença e, assim, manter, ou até melhorar, a sua visão.
2. O que precisa saber antes de começar a usar Vabysmo
Não use Vabysmo:
- se é alérgico a faricimab ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
- se tem uma infecção ativa ou suspeita de infecção no olho ou ao redor do mesmo.
- se tem dor ou vermelhidão no olho (inflamação ocular).
Se encontrar-se em alguma dessas situações, informe o seu médico. Não lhe devem administrar Vabysmo.
Advertências e precauções
Consulte o seu médico antes de começar a usar Vabysmo:
- se tem glaucoma (uma doença do olho geralmente causada por pressão alta no olho).
- se tem história de ver centelhas, luzes ou partículas flutuantes (pontos flutuantes negros) e se tem um aumento repentino no tamanho e no número de partículas flutuantes.
- se sofreu cirurgia ocular nas últimas 4 semanas ou se a cirurgia ocular está planeada para as próximas 4 semanas.
- se teve alguma vez alguma doença ocular ou tratamento ocular.
Consulte o seu médico imediatamente se:
- apresenta perda repentina da visão.
- apresenta sinais de uma possível infecção ou inflamação ocular, como piora da vermelhidão do olho, dor ocular, aumento do desconforto ocular, visão borrosa ou diminuída, aumento no número de pequenas partículas na visão, sensibilidade aumentada à luz.
Além disso, é importante que saiba que:
- a segurança e eficácia de Vabysmo quando administrado em ambos os olhos ao mesmo tempo não foram estudadas e usar assim pode aumentar o risco de experimentar efeitos adversos.
- as injeções com Vabysmo podem causar um aumento temporário na pressão do olho (pressão intraocular) em alguns pacientes dentro de 60 minutos após a injeção. O seu médico vigiará isso após cada injeção.
- O seu médico verificará se tem outros fatores de risco que possam aumentar a possibilidade de desgarro ou desprendimento de uma das camadas da parte posterior do olho (desprendimento ou desgarro de retina, e desprendimento ou desgarro do epitélio pigmentar da retina), caso em que Vabysmo será administrado com precaução.
Quando são administrados alguns medicamentos que funcionam de forma semelhante a Vabysmo, sabe-se que existe um risco de coágulos de sangue que bloqueiam os vasos sanguíneos (eventos tromboembólicos arteriais), que podem causar um ataque cardíaco ou um acidente vascular cerebral. Dado que uma pequena quantidade do medicamento entra no sangue, existe o risco teórico desses episódios após a injeção de Vabysmo dentro do olho.
A experiência é limitada no tratamento de:
- pacientes com infecções ativas.
- pacientes com DMAn e pacientes com oclusão da veia da retina (OVR) de 85 anos ou mais.
- pacientes com EMD devido à diabetes tipo I.
- diabéticos com valores médios de açúcar no sangue elevados (hemoglobina glicosilada superior a 10%).
- diabéticos com doença ocular provocada pela diabetes, conhecida como retinopatia diabética proliferativa.
- diabéticos com pressão sanguínea alta, superior a 140/90 mmHg e doença de vasos sanguíneos.
- pacientes com EMD que recebem injeções em intervalo inferior a 8 semanas durante um longo período de tempo.
A experiência é limitada no tratamento de pacientes que recebem injeções em intervalos inferiores a 8 semanas durante um longo período de tempo e esses pacientes podem ter um maior risco de efeitos adversos.
Não há experiência no tratamento de:
- diabéticos ou pacientes com OVR com pressão sanguínea alta não controlada.
Se algo do anterior lhe acontecer, o seu médico terá em conta esta falta de informação no momento de o tratar com Vabysmo.
Crianças e adolescentes
Não foi estudado o uso de Vabysmo em crianças e adolescentes porque a DMAn, o EMD e a OVR ocorrem principalmente em adultos.
Outros medicamentos e Vabysmo
Informa ao seu médico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez elactação
Vabysmo não foi estudado em mulheres grávidas. Vabysmo não deve ser usado na gravidez a não ser que o benefício potencial para o paciente supere o risco potencial para o feto.
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Não se recomenda a lactação durante o tratamento com Vabysmo porque não se sabe se Vabysmo é excretado no leite humano.
As mulheres que possam engravidar devem usar um método anticonceptivo eficaz durante o tratamento e durante pelo menos três meses após o fim do tratamento com Vabysmo. Se engravidar ou pensar que está grávida durante o tratamento, informe rapidamente o seu médico.
Condução e uso de máquinas
Após a injeção de Vabysmo, pode sofrer problemas temporários de visão (por exemplo, visão borrosa). Não conduza nem use máquinas enquanto esses durarem.
Vabysmo contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose, isto é, é essencialmente “isento de sódio”.
Vabysmo contém polissorbato
Este medicamento contém 0,02 mg de polissorbato em cada dose de 0,05 ml. Os polissorbatos podem provocar reações alérgicas. Consulte o seu médico se tiver alguma alergia conhecida.
3. Como usar Vabysmo
Como é administrado Vabysmo
A dose recomendada é 6 mg de faricimab.
Degeneração macular associada à idade neo-vascular (exsudativa) (DMAn)
- Será administrada uma injeção por mês durante os primeiros 3 meses.
- Posteriormente, deve receber injeções até cada 4 meses. O seu médico determinará a frequência das injeções com base no estado do seu olho.
Edema macular diabético (EMD) e edema macular secundário à oclusão da veia retiniana (oclusão da ramo venosa retiniana (OVR) ou oclusão da veia central da retina (OVCR))
- Será administrada uma injeção por mês durante um mínimo de 3 meses.
- Posteriormente, pode receber injeções menos frequentes. O seu médico determinará a frequência das injeções com base no estado do seu olho.
Forma de administração
Vabysmo é injetado dentro do olho (injeção intravítrea) por um médico experiente em administrar injeções oculares.
Antes da injeção, o seu médico usará um desinfetante ocular para limpar o seu olho cuidadosamente para prevenir a infecção. O seu médico dará uma gota ocular (anestésico local) para adormecer o olho e reduzir ou prevenir a dor da injeção.
Quanto dura o tratamento com Vabysmo
Este é um tratamento a longo prazo, possivelmente continuará durante meses ou anos. O seu médico vigiará regularmente o seu estado para verificar se o tratamento está tendo o efeito desejado. Dependendo de como responde ao tratamento com Vabysmo, o seu médico fará um ajuste para uma frequência de doses maior ou menor.
Se perder uma dose de Vabysmo
Se perder uma dose, marque uma nova consulta com o seu médico o mais rápido possível.
Se interromper o tratamento com Vabysmo
Fale com o seu médico antes de interromper o tratamento. Interromper o tratamento pode aumentar o risco de perda de visão e a sua visão pode piorar.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos com as injeções de Vabysmo são tanto pelo medicamento como pelo procedimento da injeção e podem afetar o olho principalmente.
Alguns efeitos adversos podem ser graves
Entre em contato com o seu médico imediatamentese tiver algum dos seguintes sintomas, que são sinais de reações alérgicas, inflamação ou infecções:
- dor ocular, aumento do desconforto, piora da vermelhidão ocular, visão borrosa ou diminuída, aumento no número de pequenas partículas na visão, aumento na sensibilidade à luz – estes são sinais de uma possível infecção ocular, inflamação ou reação alérgica.
- uma diminuição repentina ou um cambio na visão.
Outros efeitos adversos possíveis
Outros efeitos adversos que podem ocorrer após o tratamento com Vabysmo incluem aqueles listados abaixo.
Muitos dos efeitos adversos são leves ou moderados e geralmente desaparecerão dentro de uma semana após cada injeção.
Entre em contato com o seu médico se algum dos seguintes efeitos adversos se tornar grave.
Muito frequentes(podem afetar mais de 1 de cada 10 pessoas):
- Nenhum
Frequentes(podem afetar até 1 de cada 10 pessoas):
- Embaçamento do cristalino no olho (catarata)
- Desgarro de uma das camadas da parte posterior do olho (desgarro do epitélio pigmentar da retina, apenas em DMAn)
- Desprendimento da substância semelhante a um gel que se encontra dentro do olho (desprendimento vítreo)
- Aumento da pressão dentro do olho (aumento da pressão intraocular)
- Sangramento dos pequenos vasos sanguíneos da camada mais externa do olho (hemorragia conjuntival)
- Pontos que se movem ou sombras escuras na visão (partículas flutuantes no vítreo)
- Dor ocular
Pouco frequentes(podem afetar até 1 de cada 100 pessoas):
- Inflamação grave ou infecção dentro do olho (endoftalmitis)
- Inflamação da substância gelatinosa dentro do olho/olho vermelho (vitritis)
- Inflamação do íris e seu tecido adjacente no olho (irite, iridociclite, uveíte)
- Sangramento dentro do olho (hemorragia vítrea)
- Desconforto ocular
- Coceira (prurido ocular)
- Desgarro da retina (parte posterior do olho que detecta a luz)
- Olho vermelho (hiperemia ocular/conjuntival)
- Sensação de ter algo no olho
- Visão borrosa
- Diminuição da nitidez na visão (acuidade visual reduzida)
- Dor durante o procedimento
- Desprendimento de retina
- Aumento da produção de lágrimas (lagrimeo aumentado)
- Rasgo da córnea, dano da parte transparente do globo ocular que cobre o íris (abrasão corneal)
- Irritação ocular
Raros(podem afetar até 1 de cada 1.000 pessoas):
- Diminuição temporária da nitidez na visão (acuidade visual reduzida transitoriamente)
- Embaçamento do cristalino devido a uma lesão (catarata traumática)
Frequência não conhecida
- Vasculite retiniana (inflamação dos vasos sanguíneos do fundo do olho)
- Vasculite oclusiva retiniana (bloqueio dos vasos sanguíneos do fundo do olho, normalmente na presença de inflamação)
Quando são administrados alguns medicamentos que funcionam de forma semelhante a Vabysmo, sabe-se que há um risco de coágulos de sangue que bloqueiam os vasos sanguíneos (eventos tromboembólicos arteriais) que podem causar um ataque cardíaco ou um acidente vascular cerebral. Dado que uma pequena quantidade do medicamento entra no sangue, existe o risco teórico desses episódios após a injeção de Vabysmo dentro do olho.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V*. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Vabysmo
Seu médico, farmacêutico ou enfermeiro é responsável por conservar este medicamento e descartar corretamente qualquer produto não utilizado. A seguinte informação está destinada a profissionais de saúde.
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece na etiqueta e no envase após EXP. A data de validade é o último dia do mês que se indica.
Conservar em refrigerador (2 ºC - 8 ºC).
Não congelar.
Mantenha a bandeja selada no embalagem original para proteger a seringa pré-carregada da luz.
A seringa pré-carregada pode ser conservada a temperatura ambiente, de 20 ºC a 25 ºC, no embalagem original por até 24 horas.
6. Conteúdo do envase e informação adicional
Composição de Vabysmo
- O princípio ativo é faricimab. Um ml de solução injetável contém 120 mg de faricimab. Cada seringa pré-carregada contém 21 mg de faricimab em 0,175 ml de solução. Isso fornece uma dose aproveitável para liberar uma dose única de 0,05 ml de solução que contém 6 mg de faricimab.
- Os demais componentes são: L-histidina, ácido acético a 30% (E 260), L-metionina, cloreto de sódio, sacarose, polissorbato 20 (E 432), água para preparações injetáveis (ver Seção 2 “Vabysmo contém sódio e polissorbato”).
Aspecto do produto e conteúdo do envase
Vabysmo 120 mg/ml solução injetável (injeção) em seringa pré-carregada é uma solução de clara a opalescente, de transparente a amarelo-pardusca.
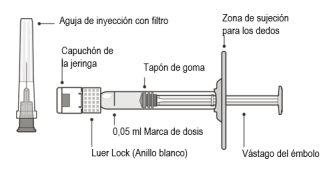
O envase contém uma agulha de injeção com filtro de parede extrafina (calibre 30 x ½ polegada, 0,30 mm x 12,7 mm, 5 µm), juntamente com uma seringa pré-carregada para um único uso.
Título de autorização de comercialização e responsável pela fabricação
Roche Registration GmbH
Emil-Barell-Strasse 1
79639
Grenzach-Wyhlen
Alemanha
Fabricante
Roche Pharma AG
Emil-Barell-Strasse 1
79639
Grenzach-Wyhlen
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica N.V. Roche S.A. Tel: +32 (0) 2 525 82 11 | Lituânia UAB “Roche Lietuva” Tel: +370 5 2546799 |
| Luxemburgo (Ver Bélgica) |
República Tcheca Roche s. r. o. Tel: +420 - 2 20382111 | Hungria Roche (Hungria) Kft. Tel: +36 - 1 279 4500 |
Dinamarca Roche Pharmaceuticals A/S Tlf: +45 - 36 39 99 99 | Malta (Ver Irlanda) |
Alemanha Roche Pharma AG Tel: +49 (0) 7624 140 | Países Baixos Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Estônia Roche Eesti OÜ Tel: + 372 - 6 177 380 | Noruega Roche Norge AS Tlf: +47 - 22 78 90 00 |
Grécia Roche (Hellas) A.E. Τηλ: +30 210 61 66 100 | Áustria Roche Áustria GmbH Tel: +43 (0) 1 27739 |
Espanha Roche Farma S.A. Tel: +34 - 91 324 81 00 | Polônia Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88 |
França Roche Tél: +33 (0) 1 47 61 40 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 - 21 425 70 00 |
Croácia Roche d.o.o Tel: +385 1 4722 333 | Romênia Roche România S.R.L. Tel: +40 21 206 47 01 |
Irlanda Roche Products (Irlanda) Ltd. Tel: +353 (0) 1 469 0700 | Eslovênia Roche farmacêutica družba d.o.o. Tel: +386 - 1 360 26 00 |
Islândia Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | República Eslovaca Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
Itália Roche S.p.A. Tel: +39 - 039 2471 | Finlândia Roche Oy Puh/Tel: +358 (0) 10 554 500 |
| Suécia Roche AB Tel: +46 (0) 8 726 1200 |
Letônia Roche Latvija SIA Tel: +371 - 6 7039831 |
Data da última revisão deste prospecto:
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
Esta informação é destinada apenas a profissionais de saúde:
Instruções de uso para a seringa pré-carregada:
Antes de começar: | |
Leia cuidadosamente todas as instruções antes de usar Vabysmo. | |
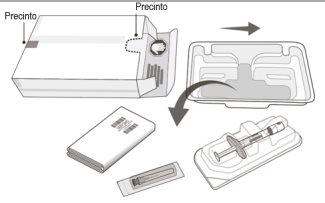
O envase de Vabysmo contém: | |
Uma seringa pré-carregada estéril em uma bandeja selada. A seringa pré-carregada é para um único uso. Uma agulha de injeção com filtro estéril, calibre 30 x ½ polegada, de parede extrafina com um filtro integrado no conector. A agulha de injeção com filtro é para um único uso. | |
Use apenas para a administração a agulha de injeção com filtro fornecida, pois foi projetada para garantir um uso oftálmico seguro do medicamento. | |
Vabysmo deve ser armazenado em geladeira a temperaturas entre 2 ºC e 8 ºC. | |
Nãocongelar. | |
Deixe Vabysmo atingir a temperatura ambiente, de 20 ºC a 25 ºC, antes de proceder com a administração. | |
Antes de seu uso, mantenha a bandeja selada no embalagem original para proteger a seringa pré-carregada da luz. A seringa pré-carregada pode ser armazenada a temperatura ambiente no embalagem original por até 24horas. | |
Vabysmo deve ser inspecionado visualmente antes de sua administração. | |
Nãouse o envase se os selos foram manipulados. | |
Nãoo use se o envase, a seringa pré-carregada, a agulha de injeção com filtro estão vencidos, danificados ou foram manipulados. | |
Nãoo use se faltar a agulha de injeção com filtro. | |
Nãoretire a zona de sujeição para os dedos da seringa. | |
Nãoo use se o capuchão da seringa se desprendeu da Luer lock. | |
Nãoo use se houver partículas, se tiver aparência nublada ou se estiver descolorido. Vabysmo é uma solução de clara a opalescente, de transparente a amarelo-pardusca. |
Conteúdo do envase | ||
Figura A | ||
Descrição do produto | ||
Figura B | ||
Retire a seringa da bandeja da seringa (passo 1). Todos os passos seguintes devem ser realizados utilizando técnicas assépticas. | ||
Abra a bandeja e retire o tampão da seringa | ||
1 | Retire a tampa da bandeja da seringa e extraia a seringa pré-carregada de forma asséptica. | |
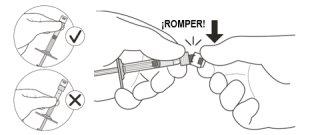
2 | Segure a seringa pelo anel branco e quebre o capuchão da seringa (ver Figura C). | |
Nãogire o capuchão. | ||
Figura C | ||
Una a agulha de injeção com filtro | ||
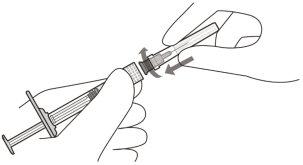
3 | Retire assépticamente a agulha de injeção com filtro de seu envase. | |
4 | De forma asséptica e firme, coloque a agulha de injeção com filtro na seringa Luer lock (ver Figura D). | |
Figura D | Apenas use para a administração a agulha de injeção com filtro fornecida. | |
5 | Retire com cuidado o capuchão da agulha puxando-o em linha reta. | |
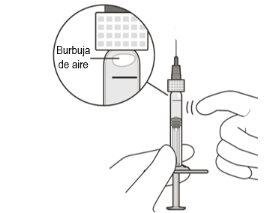
Eliminar as bolhas de ar | ||
6 | Mantenha a seringa com a agulha apontando para cima. Verifique a seringa para garantir que não há bolhas de ar. | |
7 | Se houver bolhas de ar, golpeie suavemente a seringa com seu dedo até que as bolhas subam para a parte superior (ver Figura E). | |
Figura E | ||
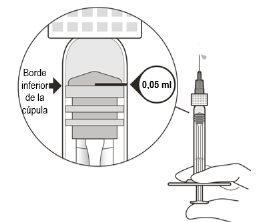
Ajustar a dose do medicamento e eliminar o ar | ||
8 | Mantenha a seringa ao nível do olho e lentamenteempurre o vástago do êmbolo até que o borde inferior da cúpula do tampão de borrachafique alinhado com a marca de dose de 0,05 ml (ver Figura F). Isso eliminará o ar e o excesso de solução e ajustará a dose para 0,05 ml. | |
Certifique-se de que a injeção seja administrada imediatamenteapós a preparação da dose. | ||
Figura F | ||
Procedimento de injeção | ||
9 | O procedimento de injeção deve ser realizado sob condições assépticas. Injete lentamenteaté que o tampão de borracha alcance a parte inferior da seringa para liberar o volume de 0,05 ml. Nãorecoloque nem separe a agulha de injeção com filtro da seringa. A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VABYSMO 120 mg/mL solução para injecção em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 120 mg/mLSubstância ativa: faricimabFabricante: Roche Registration GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médica
Médicos online para VABYSMO 120 mg/mL solução para injecção em seringa pré-carregada
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de VABYSMO 120 mg/mL solução para injecção em seringa pré-carregada – sujeita a avaliação médica e regras locais.