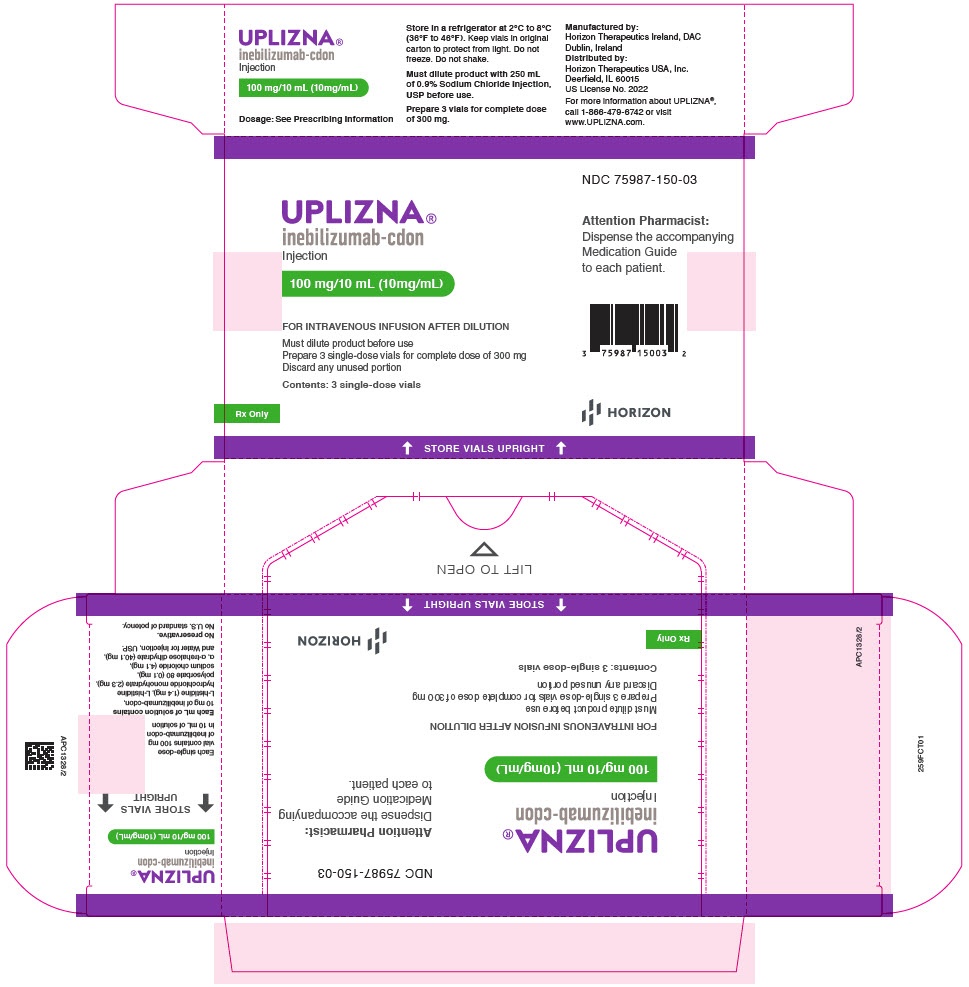
Como usar UPLIZNA 100 mg Concentrado para Solução para Perfusão
Introdução
Prospecto: informação para o utilizador
Uplizna 100 mg concentrado para solução para perfusão
inebilizumab
Este medicamento está sujeito a seguimento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de lhe administrarem este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Uplizna e para que é utilizado
- O que precisa saber antes de lhe administrarem Uplizna
- Como é administrado Uplizna
- Posíveis efeitos adversos
- Conservação de Uplizna
- Conteúdo do envase e informação adicional
1. O que é Uplizna e para que é utilizado
Uplizna contém o princípio ativo inebilizumab e pertence a uma classe de medicamentos denominados anticorpos monoclonais. É uma proteína que se dirige às células produtoras de anticorpos no sistema imunitário (as defesas naturais do corpo) chamadas linfócitos B. Uplizna é utilizado para reduzir o risco de ataques em adultos com uma afecção pouco frequente chamada transtorno do espectro da neuromielite óptica (TENMO), que afeta os nervos do olho e da medula espinal. Acredita-se que o transtorno seja devido a que o sistema imunitário ataca por engano os nervos do organismo. Uplizna é administrado a pacientes com TENMO cujos linfócitos B produzem anticorpos contra a aquaporina 4, uma proteína que desempenha um papel importante na função nervosa.
2. O que precisa saber antes de lhe administrarem Uplizna
Não utilize Uplizna
- se é alérgico a inebilizumab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se padece uma infecção activa grave como a hepatite B.
- se tem tuberculose activa ou latente não tratada.
- se tem antecedentes de leucoencefalopatia multifocal progressiva (LMP), uma infecção cerebral pouco frequente mas grave causada por um vírus.
- se lhe foi indicado que tem problemas graves do sistema imunitário.
- se tem cancro.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de lhe administrarem Uplizna se:
- tem ou acredita que tem uma infecção.
- alguma vez tomou, toma ou tem previsto tomar medicamentos que afetam o sistema imunitário ou outros tratamentos para o TENMO. Estes medicamentos podem aumentar o seu risco de contrair uma infecção.
- alguma vez teve hepatite B ou é portador do vírus da hepatite B.
- recebeu uma vacina recentemente ou está previsto que receba alguma. Deve receber qualquer uma das vacinas requeridas pelo menos 2 semanas antes de começar o tratamento com Uplizna.
Reacções relacionadas com a perfusão
Uplizna pode causar reacções relacionadas com a perfusão que podem incluir cefaleia, sensação de se sentir doente (náuseas), sonolência, falta de ar, febre, dor muscular, erupção ou outros sintomas. Se se apresentam sintomas, o tratamento pode ser interrompido ou suspenso.
Crianças e adolescentes
Este medicamento não deve ser administrado a crianças e adolescentes porque não foi estudado nesta população.
Outros medicamentos e Uplizna
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Gravidez, lactação e fertilidade
Se está grávida, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de lhe administrarem este medicamento.
Gravidez
Não se deve utilizar Uplizna durante a gravidez porque o medicamento pode atravessar a placenta e afetar o bebé. Se pode ficar grávida, deve usar um método anticonceptivo (anticoncepção) de forma contínua uma vez que comece a receber Uplizna. Se o seu médico lhe recomendar interromper o tratamento, continue com o seu método anticonceptivo até 6 meses após a última perfusão.
Lactação
Desconhece-se se Uplizna passa para o leite materno. Se está a amamentar, fale com o seu profissional de saúde sobre a melhor maneira de alimentar o seu bebé se começar o tratamento com Uplizna.
Condução e uso de máquinas
Não se prevê que Uplizna afete a sua capacidade para conduzir ou usar máquinas.
Uplizna contém sódio
Este medicamento contém 48 mg de sódio (componente principal da sal de mesa/para cozinhar) em cada perfusão. Isto equivale a 2 % da ingestão diária máxima de sódio recomendada para um adulto.
3. Como é administrado Uplizna
Uplizna é administrado mediante goteo (perfusão) em uma veia sob a supervisão de um médico com experiência no tratamento de pacientes com TENMO.
A dose recomendada é 300 mg.
A primeira dose é seguida 2 semanas depois por uma segunda dose, e luego uma dose cada 6 meses.
Ser-lhe-ão administrados outros medicamentos entre meia hora e uma hora antes da perfusão, para reduzir o risco de sofrer efeitos adversos. Um médico ou enfermeiro o vigiará durante a perfusão e durante uma hora após.
Em caso de dúvida, consulte novamente o seu médico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram. O seu médico analisará com você os possíveis efeitos adversos e explicará os riscos e os benefícios de Uplizna antes do tratamento.
Efeitos adversos graves
Os efeitos adversosmais gravessão as reacções relacionadas com a perfusão e as infecções (ver secção 2). Estes efeitos adversos podem ocorrer em qualquer momento durante o tratamento ou mesmo após o tratamento ter terminado. Pode experimentar mais de um efeito adverso ao mesmo tempo. Se apresentar uma reacção relacionada com a perfusão ou uma infecção, ligue ou consulte o seu médico imediatamente.
Outros efeitos adversos
Muito frequentes(podem afetar mais de 1 de cada 10 pessoas)
- infecção da bexiga
- infecção no nariz, na garganta, nos seios paranasais e/ou nos pulmões
- resfriado comum
- gripe
- dor articular
- dor de costas
- imunoglobulinas diminuídas
Frequentes(podem afetar até 1 de cada 10 pessoas)
- número de leucócitos no sangue inferior ao normal, que às vezes ocorre 4 semanas ou mais após a última dose de Uplizna
- inflamação dos seios paranasais geralmente causada por uma infecção
- neumonia (infecção pulmonar)
- celulite, uma infecção cutânea bacteriana potencialmente grave
- culebrilha (herpes zóster, uma erupção dolorosa e com bolhas em uma parte do corpo)
- reacção à perfusão de Uplizna (ver Reacções relacionadas com a perfusão, mais acima)
Pouco frequentes(podem afetar até 1 de cada 100 pessoas)
- infecção no sangue (sepsis), uma resposta excepcionalmente grave a uma infecção
- leucoencefalopatia multifocal progressiva (LMP), uma infecção cerebral pouco frequente mas grave causada por um vírus
- abscesso (uma infecção debaixo da pele geralmente causada por bactérias)
- bronquiolite, uma infecção das vias respiratórias causada por um vírus
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Uplizna
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa após CAD.
A data de validade é o último dia do mês que se indica.
Conservar em frigorífico entre 2 °C e 8 °C.
Conservar na caixa original para protegê-lo da luz. Não congelar.
Não utilize este medicamento se observar partículas ou mudança de cor.
6. Conteúdo do envase e informação adicional
Composição de Uplizna
- O princípio ativo é inebilizumab.
- Cada frasco contém 100 mg de inebilizumab.
- Os outros componentes são histidina, hidrocloruro de histidina monohidrato, polissorbato 80, cloreto de sódio, trealose dihidrato e água para preparações injetáveis.
Aspecto do produto e conteúdo doenvase
Uplizna 100 mg concentrado para solução para perfusão é uma solução transparente a ligeiramente opalescente, de incolora a ligeiramente amarela que se fornece em uma caixa que contém 3 frascos.
Título da autorização de comercialização
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Países Baixos
Fabricante
Horizon Therapeutics Ireland DAC
Pottery Road
Dun Laoghaire
Co. Dublin
A96 F2A8
Irlanda
Fabricante
Amgen NV
Telecomlaan 5-7
1831 Diegem
Bélgica
Pode solicitar mais informação respeito a este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica s.a. Amgen n.v. Tel: +32 (0)2 7752711 | Lituânia Amgen Switzerland AG Vilnius filial Tel: +370 5 219 7474 |
| Luxemburgo s.a. Amgen Bélgica Tel: +32 (0)2 7752711 |
República Checa Amgen s.r.o. Tel: +420 221 773 500 | Hungria Amgen Kft. Tel: +36 1 35 44 700 |
Dinamarca Amgen, filial da Amgen AB, Suécia Tel: +45 39617500 | Malta Amgen S.r.l. Itália Tel: +39 02 6241121 |
Alemanha Amgen GmbH Tel: +49 89 1490960 | Países Baixos Amgen B.V. Tel: +31 (0)76 5732500 |
Estônia Amgen Switzerland AG Vilnius filial Tel: +372 586 09553 | Noruega Amgen AB Tel: +47 23308000 |
Grécia Amgen Ελλάς Φαρμακευτική Ε.Π.Ε. Tel: +30 210 3447000 | Áustria Amgen GmbH Tel: +43 (0)1 50 217 |
Espanha Amgen S.A. Tel: +34 93 600 18 60 | Polônia Amgen Biotechnologia Sp. z o.o. Tel: +48 22 581 3000 |
França Amgen S.A.S. Tel: +33 (0)9 69 363 363 | Portugal Amgen Biofarmacêutica, Lda. Tel: +351 21 4220606 |
Croácia Amgen d.o.o. Tel: +385 (0)1 562 57 20 | Romênia Amgen România SRL Tel: +4021 527 3000 |
Irlanda Amgen Ireland Limited Tel: +353 1 8527400 | Eslovênia AMGEN zdravila d.o.o. Tel: +386 (0)1 585 1767 |
Islândia Vistor hf. Tel: +354 535 7000 | Eslováquia Amgen Slovakia s.r.o. Tel: +421 2 321 114 49 |
Itália Amgen S.r.l. Tel: +39 02 6241121 | Finlândia Amgen AB, sucursal na Finlândia Tel: +358 (0)9 54900500 |
Chipre C.A. Papaellinas Ltd Tel: +357 22741 741 | Suécia Amgen AB Tel: +46 (0)8 6951100 |
Letônia Amgen Switzerland AG Riga filial Tel: +371 257 25888 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a UPLIZNA 100 mg Concentrado para Solução para PerfusãoForma farmacêutica: PERFURAÇÃO INJETÁVEL, 120 mg (80 mg/kg) belimumabeSubstância ativa: belimumabFabricante: Glaxosmithkline (Ireland) LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 200 mgSubstância ativa: belimumabFabricante: Glaxosmithkline (Ireland) LimitedRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 400 mg (80 mg/kg) belimumabeSubstância ativa: belimumabFabricante: Glaxosmithkline (Ireland) LimitedRequer receita médica
Médicos online para UPLIZNA 100 mg Concentrado para Solução para Perfusão
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de UPLIZNA 100 mg Concentrado para Solução para Perfusão – sujeita a avaliação médica e regras locais.