
TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto:informação para o utilizador
Twinrix Pediátrico, Suspensão injetável em seringa pré-carregada
Vacina (HAB) (adsorvida) anti-hepatite A (inativada) e anti-hepatite B (ADN-r)
Leia todo o prospecto atentamente antes de si/ seu filho começar a receber esta vacina,porque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Esta vacina foi prescrita apenas para si/ seu filho, e não deve dá-la a outras pessoas.
- Se si/ seu filho experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Este prospecto foi escrito assumindo que a pessoa que recebe a vacina é a que o está lendo. No entanto, a vacina pode ser administrada a crianças e adolescentes de modo que pode ser que si esteja lendo por seu filho.
Conteúdo do prospecto
- O que é Twinrix Pediátrico e para que é utilizado
- O que precisa saber antes de receber Twinrix Pediátrico
- Como administrar Twinrix Pediátrico
- Possíveis efeitos adversos
- Conservação de Twinrix Pediátrico
- Conteúdo do envase e informação adicional
1. O que é Twinrix Pediátrico e para que é utilizado
Twinrix Pediátrico é uma vacina utilizada em crianças e adolescentes a partir de 1 ano de idade e até os 15 anos inclusive para prevenir duas doenças: a hepatite A e a hepatite B. A vacina actua fazendo com que o organismo produza a sua própria proteção (anticorpos) contra estas doenças.
- Hepatite A: A hepatite A é uma doença infecciosa que pode afectar o fígado. Esta doença está causada pelo vírus da hepatite A. A hepatite A pode transmitir-se de pessoa para pessoa através dos alimentos e bebidas, ou nadando em águas contaminadas por águas residuais. Os sintomas da hepatite A começam de 3 a 6 semanas após o contacto com o vírus. Estes consistem em náuseas (malestar), febre e dores. Depois de vários dias o branco dos olhos e a pele podem tornar-se amarelentos (icterícia). A gravidade e o tipo de sintomas podem variar. As crianças pequenas podem não desenvolver icterícia. A maioria das pessoas recupera-se completamente, mas geralmente a doença é suficientemente grave para que os pacientes não possam realizar uma actividade laboral aproximadamente durante um mês.
- Hepatite B: A hepatite B está causada pelo vírus da hepatite B. Causa inflamação do fígado. O vírus encontra-se nos fluidos corporais, tais como o sangue, o sêmen, as secreções vaginais ou a saliva (escarro) de pessoas infectadas.
A vacinação é a melhor forma de se proteger contra estas doenças. Nenhum dos componentes da vacina é infeccioso.
2. O que precisa saber antes de receber Twinrix Pediátrico
Twinrix Pediátrico não deve ser administrado se:
- é alérgico a:
- os princípios activos ou a algum dos outros componentes da vacina (incluídos na secção 6)
- a neomicina.
Os sinais de uma reacção alérgica podem incluir erupção cutânea com picazón, dificuldade para respirar e inflamação da face ou língua
- teve anteriormente uma reacção alérgica a qualquer vacina contra a hepatite A e a hepatite B
- tem uma infecção grave com febre (maior de 38ºC). Uma infecção de pouca importância, como um resfriado, não deveria ser um problema para a vacinação, mas diga-o primeiro ao seu médico.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de receber Twinrix Pediátrico se:
- sofreu algum problema de saúde após a administração prévia de uma vacina
- tem um sistema imunológico debilitado devido a uma doença ou a um tratamento farmacológico
- tem algum problema hemorrágico ou lhe aparecem cardenales com facilidade.
Antes ou depois de qualquer injeção, poderá produzir-se um desmaio (especialmente nos adolescentes), por isso deve informar o seu médico ou enfermeiro se se desmaiou em ocasiões anteriores após a administração de uma injeção.
Outros medicamentos e Twinrix Pediátrico
Pode ser administrado Twinrix Pediátrico com uma vacina do papilomavírus humano (VPH) num local de injeção distinto (por exemplo, o outro braço) na mesma visita médica.
Informa o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou pudesse ter que utilizar qualquer outro medicamento.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico ou farmacêutico antes de receber esta vacina.
Desconhece-se se Twinrix Pediátrico passa para o leite materno, no entanto não é de esperar que a vacina cause problemas aos lactentes.
Twinrix Pediátrico contém neomicina e sódio
Informa o seu médico se teve uma reacção alérgica à neomicina (antibiótico).
Esta vacina contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “exento de sódio”.
3. Como administrar Twinrix Pediátrico
Receberá um total de três injeções durante um período de 6 meses. Cada injeção será administrada em uma visita independente. A primeira dose será administrada na data escolhida. As outras duas doses serão administradas um mês e seis meses após a primeira dose.
- Primeira dose: na data escolhida
- Segunda dose: 1 mês após
- Terceira dose: 6 meses após a primeira dose
O médico informá-lo-á se são necessárias doses adicionais e futuras doses de recorde.
Se perder uma das injeções previstas, fale com o seu médico para marcar outra visita.
Certifique-se de que termina o ciclo completo de vacinação de três injeções. Caso contrário, pode não estar completamente protegido contra as doenças.
O médico administrará a injeção de Twinrix Pediátrico no músculo superior do seu braço ou no músculo da coxa do seu filho.
A vacina nunca deve ser injetada numa veia.
Se tiver alguma outra dúvida sobre o uso desta vacina, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, esta vacina pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos que podem ocorrer são os seguintes:
Efeitos adversos que ocorreram durante os ensaios clínicos ou durante o uso rotineiro da vacina ou com vacinas individuais anti-hepatite A e anti-hepatite B ou com a formulação de adulto de Twinrix.
Muito frequentes(podem ocorrer em mais de 1 de cada 10 doses de vacina): dor e vermelhidão no local da injeção.
Frequentes(podem ocorrer até em 1 de cada 10 doses de vacina): sonolência, dor de cabeça, náuseas, perda de apetite, inflamação ou cardenais no local da injeção, malestar geral, cansaço, febre igual ou maior de 37,5°C, irritabilidade.
Pouco frequentes(podem ocorrer até em 1 de cada 100 doses de vacina): diarreia, vómitos, dor de estômago, erupção cutânea, dores musculares, infecção do tracto respiratório superior.
Raros(podem ocorrer até em 1 de cada 1.000 doses de vacina): inflamação das glândulas do pescoço, da axila ou virilha (linfadenopatia), tontura, perda de sensibilidade da pele ao dor ou ao tacto (hipestesia), sensação de formigueiro (parestesia), habão urticarial, picazón, dor articular, pressão sanguínea baixa, sintomas gripais, tais como febre, dor de garganta, gotejamento nasal, tosse e arrepios.
Muito raros(podem ocorrer até em 1 de cada 10.000 doses de vacina): redução das plaquetas, que aumentam o risco de sangramento ou aparição de cardenais (trombocitopenia), manchas moradas ou marron-avermelhadas visíveis através da pele (púrpura trombocitopénica), inflamação ou infecção do cérebro (encefalite), doença degenerativa do cérebro (encefalopatia), inflamação dos nervos (neurite), insensibilidade ou fraqueza dos braços e pernas (neuropatia), paralisia, convulsões, inflamação da face, boca ou garganta (edema angioneurótico), inchação morada ou morada-avermelhada da pele (líquen plano), erupções cutâneas graves (eritema multiforme), inflamação das articulações, fraqueza muscular, infecção ao redor do cérebro que pode produzir dor de cabeça grave com rigidez de pescoço e sensibilidade à luz (meningite), inflamação de alguns vasos sanguíneos (vasculite), resultados anormais das provas hepáticas de laboratório, esclerose múltipla, inflamação da medula espinal (mielite), pálpebras caídas e hundimento dos músculos de um lado da face (paralisia facial), inflamação temporária dos nervos, que causa dor, fraqueza e paralisia dos membros e, por vezes, progride para o peito e a face (síndrome de Guillain-Barré), doença dos nervos do olho (neurite óptica), dor imediata no local da injeção, ardor e sensação de queimadura.
Reacções alérgicas graves (anafilaxia, reacções anafilactoides e reacção tipo doença do soro) também podem ocorrer muito raramente (até com 1 de cada 10.000 doses da vacina). Alguns sinais de reacções alérgicas graves podem ser erupções cutâneas com picazón ou com bolhas, inflamação dos olhos e da face, dificuldade para respirar ou engolir, descida repentina da pressão sanguínea e perda do conhecimento. Estas reacções podem produzir-se antes de abandonar a consulta do médico. Em qualquer caso, se aparecer algum destes sintomas, deve procurar um médico imediatamente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Twinrix Pediátrico
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2ºC e 8ºC).
Conservar no embalagem original para protegê-lo da luz.
Não congelar. A congelação destrói a vacina.
Os medicamentos não devem ser deitados fora pelo esgoto nem para o lixo. Pergunte ao seu farmacêutico como se desfazer dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deTwinrix Pediátrico
- Os princípios activos são:
Vírus da hepatite A (inactivados) 1,2 360 Unidades ELISA
Antígeno de superfície da hepatite B 3,4 10 microgramas
1Producido em células diploides humanas (MRC-5)
2Adsorvido em hidróxido hidratado de alumínio 0,025 miligramas Al3+
3Producido pela tecnologia do ADN recombinante em células de levedura (Saccharomyces cerevisiae)
4Adsorvido em fosfato de alumínio 0,2 miligramas Al3+
- Os outros componentes de Twinrix Pediátrico são: cloreto de sódio, água para preparações injetáveis.
Aspecto deTwinrix Pediátricoe conteúdo do envase
Suspensão injetável em seringa pré-carregada.
Twinrix Pediátrico é um líquido branco, ligeiramente leitoso.
Twinrix Pediátrico está disponível em seringa pré-carregada de 1 dose com ou sem agulhas separadas, tamanhos de envase de 1, 10 e 50.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Bélgica
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 | Lituânia GlaxoSmithKline Biologicals SA Tel: +370 80000334 |
Bulgária GlaxoSmithKline Biologicals SA Tel: + 359 80018205 | Luxemburgo GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 |
República Checa GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 | Hungria GlaxoSmithKline Biologicals SA Tel: + 36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tel: + 45 36 35 91 00 | Malta GlaxoSmithKline Biologicals SA Tel: + 356 80065004 |
Alemanha GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 | Países Baixos GlaxoSmithKline BV Tel: + 31 (0)33 2081100 |
Estônia GlaxoSmithKline Biologicals SA Tel: +372 8002640 | Noruega GlaxoSmithKline AS Tel: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Μονοπρ?σωπη A.E.B.E. Tel: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
Espanha GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polônia GSK Services Sp. z o.o. Tel: + 48 (22) 576 9000 |
França Laboratoire GlaxoSmithKline Tel: + 33 (0) 1 39 17 84 44 Croácia GlaxoSmithKline Biologicals SA Tel: + 385 800787089 | Portugal Smith Kline & French Portuguesa - Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 Romênia GlaxoSmithKline Biologicals SA Tel: +40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Ltd Tel: + 353 (0)1 495 5000 | Eslovênia GlaxoSmithKline Biologicals SA Tel: + 386 80688869 |
Islândia Vistor hf. Tel: +354 535 7000 | Eslováquia GlaxoSmithKline Biologicals SA Tel: + 421 800500589 |
Itália GlaxoSmithKline S.p.A. Tel: + 39 (0)45 7741 111 | Finlândia GlaxoSmithKline Oy Tel: + 358 10 30 30 30 |
Chipre GlaxoSmithKline Biologicals SA Tel: + 357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia GlaxoSmithKline Biologicals SA Tel: + 371 80205045 | Reino Unido (Irlanda do Norte) GlaxoSmithKline Biologicals SA Tel: +44 (0)800 221441 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos http://www.ema.europa.eu, e na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/).
---------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais de saúde:
Durante o armazenamento pode observar-se um depósito fino de cor branca com uma camada translúcida e incolor por cima.
Deve ressuspender a vacina antes do seu uso. Uma vez ressuspendida, a vacina terá uma aparência branca, turva e uniforme.
Ressuspensão da vacina para obter uma suspensão branca, turva e uniforme
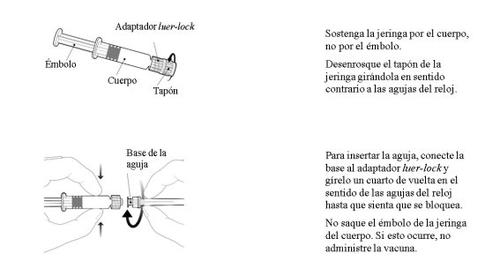
Deve ressuspender a vacina seguindo os passos que se indicam a seguir.
- Segurar a seringa com a boca para cima com a mão fechada.
- Agitar a seringa virando-a para baixo e novamente para cima.
- Repetir esta acção de forma vigorosa durante, pelo menos, 15 segundos.
- Inspecionar novamente a vacina:
- Se a vacina se mostra como uma suspensão branca, turva e uniforme, está pronta para ser usada (não deve ter uma aparência translúcida).
- Se a vacina ainda não se mostra como uma suspensão branca, turva e uniforme, vire-a para baixo e novamente para cima durante, pelo menos, mais 15 segundos e, a seguir, inspecione novamente.
Antes da administração, a vacina deve ser inspeccionada visualmente para observar se tem alguma partícula estranha e/ou aparência física anormal. Em caso de observar alguma destas circunstâncias, não administrar a vacina.
Instruções para a seringa pré-carregada após a ressuspensão
Eliminação de resíduos
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a regulamentação local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, DesconhecidaSubstância ativa: combinationsFabricante: Glaxosmithkline BiologicalsRequer receita médicaForma farmacêutica: INJETÁVEL, DesconhecidaSubstância ativa: combinationsFabricante: Glaxosmithkline BiologicalsRequer receita médicaForma farmacêutica: INJETÁVEL, DesconhecidaSubstância ativa: combinationsFabricante: Glaxosmithkline BiologicalsRequer receita médica
Alternativas a TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA em Україна
Médicos online para TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TWINRIX PEDIÁTRICO, SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.














