PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL

Como usar PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o paciente
Prokam50 mg pó para solução injetável
Cefuroxima
Leia todo o prospecto detenidamente antes de que lhe seja administrado este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo. Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Prokam e para que é utilizado
- O que precisa saber antes de que lhe administrem Prokam
- Como se administra Prokam
- Possíveis efeitos adversos
- Conservação de Prokam
- Conteúdo do envase e informação adicional
1. O que é Prokam e para que é utilizado
- Prokam contém uma substância ativa, cefuroxima (como cefuroxima sódica) que pertence a um grupo de antibióticos denominados cefalosporinas. Os antibióticos são utilizados para eliminar as bactérias ou germes que causam infecções.
Os antibióticos são utilizados para tratar infecções bacterianas e não servem para tratar infecções virais como a gripe ou o resfriado.
É importante que siga as instruções relativas à dose, ao intervalo de administração e à duração do tratamento indicadas pelo seu médico.
Não guarde nem reutilize este medicamento. Se uma vez finalizado o tratamento lhe sobrar antibiótico, devolva-o à farmácia para a sua correta eliminação. Não deve deitar os medicamentos pelo esgoto nem para o lixo.
- Este medicamento será utilizado se lhe for realizada uma cirurgia de catarata (opacidade do cristalino).
- A fim de prevenir uma infecção do olho, o cirurgião oftálmico lhe injetará este medicamento no olho no final da operação de catarata.
2. O que precisa saber antes de que lhe administrem Prokam
Não useProkam
- Se é alérgico (hipersensível) à cefuroxima ou a qualquer um dos antibióticos do grupo das cefalosporinas.
Advertências e precauções
Informa o seu médico,farmacêutico ou enfermeiro antes de começar a usar Prokam:
- se é alérgico a outros antibióticos como a penicilina,
- se tem risco de sofrer uma infecção devida a bactérias denominadas Staphylococcus aureusresistentes à meticilina,
- se tem risco de sofrer uma infecção grave,
- se lhe foi diagnosticada uma catarata complicada,
- se está previsto realizar-lhe uma cirurgia combinada no olho,
- se tem uma doença grave da tiróide.
Prokam só é administrado como uma injeção no olho (injeção intracameral).
Prokam só deve ser administrado em condições assépticas (significando limpeza e ausência de germes) próprias da cirurgia de catarata.
Cada frasco de Prokam deve ser utilizado para um só paciente.
Uso de Prokam com outros medicamentos
Comunique ao seu médico ou farmacêutico se está utilizando, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento
Gravidez elactação
- Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de que lhe seja administrado este medicamento.
- Prokam só lhe será administrado no caso em que o benefício supere os potenciais riscos.
Prokam contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose, isto é, é essencialmente “exento de sódio”.
3. Como se administra Prokam
- As injeções de Prokam serão administradas por um cirurgião oftálmico no final da cirurgia de catarata.
- Prokam é apresentado como um pó estéril, que se dissolve em solução salina para injeção antes da sua administração.
Se lhe for administrado demasiado, ou muito pouco Prokam
Este medicamento lhe será administrado por um profissional de saúde. Se acredita que se esqueceu de uma dose ou que recebeu demasiado medicamento, informe o seu médico ou enfermeiro.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20, indicando o medicamento e a quantidade ingerida.
4. Possíveis efeitos adversos
Assim como todos os medicamentos, Prokam pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os seguintes efeitos adversos são muito raros (podem afetar até 1 de cada 10.000 pessoas):
- Reação alérgica grave que causa dificuldade para respirar ou desmaios.
O seguinte efeito adverso foi notificado com uma frequência não conhecida (não pode ser estimada a partir dos dados disponíveis):
- Edema macular (visão borrosa ou distorcida perto ou no centro do seu campo de visão).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamento de uso humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Prokam
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta do frasco e do cartucho após CAD. A data de validade é o último dia do mês que se indica.
Não conserve a uma temperatura superior a 25ºC. Mantenha o frasco no embalagem exterior para protegê-lo da luz.
Para um só uso.
Após a reconstituição: deve utilizar imediatamente o produto.
Os medicamentos não devem ser deitados pelo esgoto nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deProkam
O princípio ativo é cefuroxima (na forma de cefuroxima sódica).
Cada frasco contém 50 mg de cefuroxima.
Após a reconstituição, 0,1 ml de solução contém 1 mg de cefuroxima.
Não há outros componentes.
Aspecto deProkame conteúdo do envase
Prokam é um pó para solução injetável branco a quase branco, contido em um frasco de vidro.
Cada caixa contém um, ou dez ou vinte frascos ou dez frascos juntamente com dez agulhas com filtro estéril de 5 micras. Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Representante local:
Laboratorios THEA S.A.
C/ Enric Granados, nº 86-88, 2ª planta
08008 Barcelona
Responsável pela fabricação:
BIOPHARMA S.R.L.
Via Delle Gerbere, 22/30 Santa Palomba
00134 ROMA
Itália
ou
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
França
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria, Bélgica, República Checa, Dinamarca, Finlândia, França, Alemanha, Itália, Islândia, Luxemburgo, Países Baixos, Noruega, Polônia, Portugal, Romênia, República Eslovaca, Eslovênia, Suécia, Reino Unido …………………………………………………Aprokam
Chipre, Grécia, Espanha…………………………………………………………..Prokam
Irlanda…………………………………………………………………………….APROK
Data da última revisão desteprospecto:Agosto 2019
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
Esta informação está destinada unicamente a profissionais do sector sanitário:
Incompatibilidades
Na bibliografia não há referências de incompatibilidades com os produtos usados habitualmente na cirurgia de catarata. Este medicamento não deve ser misturado com outros, excepto os mencionados a seguir [solução de cloreto de sódio 9 mg/ml (0,9%) para injeção].
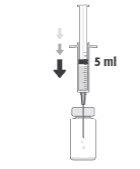
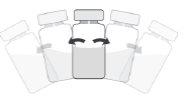
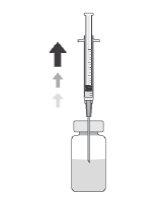
Como preparar e administrar Prokam
Frasco de um só uso, apenas para uso intracameral.
Após a reconstituição, Prokam deve ser administrado mediante injeção intraocular na câmara anterior do olho (injeção intracameral), por um cirurgião oftálmico, nas condições assépticas recomendadas da cirurgia de catarata.
Deve ser inspecionada visualmente a solução reconstituída, utilizando-se apenas se for uma solução incolor a amarelada e sem partículas visíveis.
Após a reconstituição, o produto deve ser utilizado imediatamente e não deve ser reutilizado.
A dose recomendada para cefuroxima é 1 mg em 0,1 ml de solução para injeção de cloreto de sódio 9 mg/ml (0,9%).
NÃO INJETAR MAIS DA DOSE RECOMENDADA.
O frasco é para um só uso.
Apenas um frasco para cada paciente. Colar a etiqueta desprendível do frasco na documentação do paciente.
Para preparar Prokampara a administração intracameral, siga as instruções seguintes: | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Após o seu uso, eliminar o sobrante da solução reconstituída. Não guarde para um uso posterior. |
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele, será realizada de acordo com a normativa local. Eliminar as agulhas utilizadas num contentor para objetos pontiagudos.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVELForma farmacêutica: COLÍRIO, 3,35 mg azitromicina di-hidratadaSubstância ativa: azithromycinFabricante: Laboratoires TheaRequer receita médicaForma farmacêutica: COLÍRIO, 0,3% gentamicinaSubstância ativa: gentamicinFabricante: Ntc S.R.L.Requer receita médicaForma farmacêutica: GEL OFTÁLMICO, 10 MG/GSubstância ativa: fusidic acidFabricante: Amdipharm LimitedRequer receita médica
Alternativas a PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL em Polonia
Médicos online para PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de PROKAM 50 mg PÓ PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.