LUVERIS 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como usar LUVERIS 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Dissolvente em frascos
Luveris 75UI pó e dissolvente para solução injetável
lutropina alfa
Leia todo o prospecto atentamente antes de começar a usar este medicamentoporque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Luveris e para que é utilizado
- O que necessita de saber antes de começar a usar Luveris
- Como usar Luveris
- Possíveis efeitos adversos
- Conservação de Luveris
- Conteúdo do envase e informação adicional
1. O que é Luveris e para que é utilizado
O que é Luveris
Luveris é um medicamento que contém lutropina alfa, uma Hormona Luteinizante recombinante (LH), que é essencialmente semelhante à hormona que se encontra de forma natural nos humanos, mas que é obtida mediante biotecnologia. Pertence à família de hormonas chamadas gonadotropinas, que intervêm no controlo normal da reprodução.
Para que é utilizado Luveris
Luveris é recomendado para o tratamento de mulheres adultas que produzem quantidades muito pequenas de algumas hormonas implicadas no ciclo reprodutivo natural. O medicamento é utilizado juntamente com outra hormona chamada hormona foliculoestimulante (FSH) para provocar o desenvolvimento dos folículos, que são as estruturas do ovário onde amadurecem os ovos (óvulos). Este tratamento é seguido da administração de uma dose única de Gonadotropina Coriónica humana (hCG), que provoca a libertação de um óvulo desde o folículo (ovulação).
2. O que necessita de saber antes de começar a usar Luveris
Não use Luveris
- se é alérgica às gonadotropinas (como a hormona luteinizante, a hormona foliculoestimulante ou a gonadotropina coriónica humana) ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se padece cancro do ovário, do útero ou da mama.
- se lhe foi diagnosticado um tumor cerebral.
- se tem um aumento de tamanho dos ovários ou bolsas de líquido nos ovários (quistes ováricos) de origem desconhecida.
- se tem hemorragias vaginais inexplicáveis.
Não utilize Luveris se apresentar algum dos factores anteriores. Se não tiver certeza, fale com o seu médico ou farmacêutico antes de utilizar este medicamento.
Advertências e precauções
Consulte o seu médico,farmacêutico ou enfermeiro antes de começar a usar Luveris.
Antes de iniciar o tratamento deve avaliar-se tanto a sua fertilidade como a do seu parceiro.
É recomendável que não use Luveris em caso de apresentar um quadro clínico que impossibilite um embarazo normal, como seria a situação em que os ovários não funcionam correctamente devido a uma doença denominada insuficiência ovárica primária ou malformações dos órgãos sexuais.
Porfiria
Antes de iniciar o tratamento informe o seu médico se si ou algum membro da sua família padece porfiria (uma incapacidade de descompor as porfirinas que pode transmitir-se de pais a filhos).
Síndroma de hiperestimulação ovárica (SHO)
Este medicamento estimula os ovários. Isto aumenta o risco de que apresente síndroma de hiperestimulação ovárica ou SHO. Este síndroma produz-se quando os seus folículos se desenvolvem em excesso e se convertem em quistes de grande tamanho. Se sofre dor abdominal, aumento de peso em muito pouco tempo, tem náuseas ou vómitos ou tem dificuldades para respirar, consulte de imediato com o seu médico, que pode indicar-lhe que deixe de usar este medicamento (ver secção 4 sob “Efeitos adversos graves”).
Se não está a ovular e respeita a dose e as pautas posológicas recomendadas, é menos provável que sofra SHO. O tratamento com Luveris raramente dá lugar a um SHO grave. Isto resulta mais provável se também se administra o medicamento utilizado para induzir a maturação folicular final (que contém Gonadotropina Coriónica humana, hCG). Ver secção 3 sob “Que quantidade se deve usar” para mais dados. Em caso de desenvolver um SHO, o seu médico pode não administrar-lhe hCG neste ciclo de tratamento e aconselhá-lo a que se abstenha de realizar o coito ou bem que utilize anticoncepcionais de barreira durante pelo menos quatro dias.
O seu médico assegurará um controlo cuidadoso da resposta ovárica, mediante ecografias e análises de sangue, antes e durante o tratamento.
Embarazo múltiplo
Ao usar Luveris existe um risco maior de que conceba mais de um bebé de cada vez (“embarazo múltiplo”, maioritariamente gémeos) do que se tivesse concebido de forma natural. Um embarazo múltiplo pode conlear complicações médicas para si e os seus bebés. Pode reduzir o risco de embarazo múltiplo utilizando a dose correcta de Luveris nos momentos indicados. Ao submeter-se a técnicas de reprodução assistida, o risco de ter um embarazo múltiplo vai associado à sua idade, à qualidade e ao número de óvulos fertilizados ou aos embriões que se lhe implantam.
Aborto espontâneo
Ao submeter-se a técnicas de reprodução assistida ou a estimulação ovárica para produzir óvulos, é mais provável que se produza um aborto espontâneo do que no promedio das mulheres.
Embarazo ectópico
As mulheres com antecedentes de doença das trompas de Falópio têm risco de embarazo ectópico (embarazo no qual o embrião se implanta fora do útero), independentemente de se o embarazo se consiga mediante concepção espontânea ou com tratamentos de fertilidade.
Problemas de coagulação do sangue (episódios tromboembólicos)
Consulte o seu médico antes de começar a usar Luveris se si ou algum familiar tiveram alguma vez coágulos sanguíneos na perna ou no pulmão, ou um ataque ao coração ou um acidente vascular cerebral. Pode correr um risco maior de coágulos sanguíneos graves ou de que coágulos existentes se agravem ao receber tratamento com Luveris.
Tumores dos órgãos sexuais
Foram comunicados tumores nos ovários e noutros órgãos sexuais, tanto benignos como malignos, em mulheres que receberam vários tratamentos farmacológicos para a infertilidade.
Defeitos congénitos
Os defeitos congénitos após a aplicação de técnicas de reprodução assistida podem ser ligeiramente maiores do que após embarazos espontâneos. Isto pode dever-se a diferenças relacionadas com os progenitores, como a idade da mãe e os antecedentes genéticos, intervenções relacionadas com técnicas de reprodução assistida e embarazo múltiplo.
Crianças e adolescentes
Luveris não é indicado para uso em crianças e adolescentes menores de 18 anos de idade.
Outros medicamentos e Luveris
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Não utilize Luveris misturado com outros medicamentos na mesma injeção, excepto a folitropina alfa, se o seu médico a prescrever.
Embarazo e lactação
Não utilize Luveris se está grávida ou em período de amamentação.
Consulte o seu médico ou farmacêutico antes de utilizar qualquer medicamento.
Condução e uso de máquinas
A influência de Luveris sobre a capacidade para conduzir e utilizar máquinas é nula ou insignificante.
Luveris contém sódio
Luveris contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
3. Como usar Luveris
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte de novo o seu médico.
Uso deste medicamento
O seu médico decidirá a dose e pauta de administração mais adequadas para si ao longo do tratamento.
Que quantidade se deve usar
Luveris é geralmente utilizado diariamente, durante um máximo de três semanas, de forma simultânea com as injeções de FSH.
- A dose inicial habitual éde 75 UI (1 frasco) de Luveris juntamente com 75 UI ou 150 UI de FSH.
- Em função da resposta,o seu médico pode incrementar a dose de FSH, preferentemente com aumentos de 37,5 a 75 UI cada 7-14 dias.
O seu médico pode decidir prolongar o tratamento até 5 semanas.
Quando se tiver obtido a resposta desejada, deve ser administrada uma única injeção de hCG, de 24 a 48 horas após a última injeção de Luveris e de FSH. É recomendável que realize o coito no mesmo dia da administração de hCG, assim como no dia seguinte. Como alternativa, também pode ser realizada inseminação intrauterina ou outro procedimento de reprodução médicamente assistida, a critério do seu médico.
Se se obtém uma resposta excessiva, deve interromper-se o tratamento e não administrar-se hCG (ver secção 4 sob “Síndroma de hiperestimulação ovárica (SHO)”). Para o seguinte ciclo, o seu médico prescrever-lhe-á uma dose de FSH mais baixa do que a do ciclo previo.
Forma de administração
Luveris deve ser administrado por via subcutânea, isto é, colocando a injeção logo abaixo da pele. Cada frasco é para um único uso.
Se administrar Luveris si mesma, leia atentamente as seguintes instruções:
- Lave as mãos. É importante que as suas mãos e os materiais que utilize estejam o mais limpos possível.
- Reúna tudo o que vai precisar. Encontre um local limpo e prepare-o tudo:
- um frasco de Luveris,
- um frasco de dissolvente,
- duas torundas de algodão embebidas em álcool,
- uma seringa,
- uma agulha de reconstituição para dissolver o pó com o dissolvente,
- uma agulha fina para a injeção subcutânea,
- um recipiente para objetos cortantes para deitar fora de forma segura os envases de vidro e as agulhas.
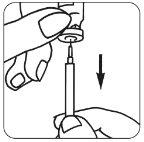
- Retire a cápsula de fecho protectora do frasco de dissolvente: Coloque a agulha de reconstituição
| na seringa e introduza um pouco de ar na seringa puxando o êmbolo aproximadamente até a marca de 1 ml. A continuación, introduza a agulha no frasco, empurre o êmbolo para expulsar o ar, coloque o frasco boca abaixo e retire suavemente todo o dissolvente. Coloque a seringa com cuidado sobre a mesa, procurando não tocar a agulha. |
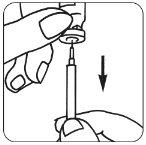
- Prepare a solução para injeção: Retire a cápsula de fecho protectora do frasco que contém
| o pó de Luveris,pegue a sua seringa e injete lentamente o dissolvente no frasco de Luveris. Mova suavemente sem retirar a seringa. Não o agite. |
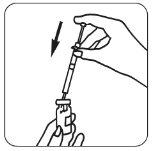
- Uma vez que o pó se tenha dissolvido (o que geralmente ocorre imediatamente), verifique que a
| solução obtida é límpida e não contém nenhuma partícula. Coloque o frasco boca abaixo e retire suavemente a solução na seringa. |
Você também pode misturar Luveris e folitropina alfa, como alternativa a injetar cada produto por separado. Depois de dissolver o pó de Luveris, carregue a solução na seringa e volte a injetá-la no envase que contém o pó de folitropina alfa. Uma vez que o pó se tenha dissolvido, retire a solução com a seringa. Verifique se existem partículas, como se indica mais acima, e não utilize a solução se não for límpida.
Podem ser dissolvidos até 3 envases de pó em 1 ml de dissolvente.
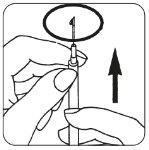
- Mude a agulha colocando a agulha finae elimine as possíveis bolhas de ar: Se vir alguma
| bolha de ar na seringa, pegue a seringa com a agulha para cima e dê golpes na seringa até que o ar se reúna na parte superior. Empurre o êmbolo suavemente até que desapareçam as bolhas de ar. |
- Injete a solução imediatamente: O seu médico ou enfermeiro ter-lhe-ão indicado onde deve
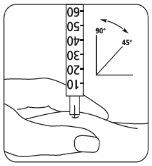
| colocar a injeção (p. ex., ventre, parte da frente da coxa). Limpe a zona escolhida com um algodão embebido em álcool. Puxe a pele com força e introduza a agulha com um ângulo de 45° a 90°, com um movimento semelhante ao dos dardos. Injete sob a pele, segundo as instruções recebidas. Não injete directamente numa veia. Introduza a solução pressionando suavemente sobre o êmbolo. Empregue todo o tempo que necessite até injetar a totalidade da solução. Retire imediatamente a agulha e limpe a pele com um algodão embebido em álcool realizando um movimento circular. |
- Dêjte fora de todo o material utilizado: Uma vez finalizada a injeção, dêjte fora imediatamente de todas as agulhas e envases de vidro vazios no recipiente para objetos cortantes que se fornece. Deve dêjte fora qualquer porção da solução não utilizada.
Se usar mais Luveris do que deve
Os efeitos de uma sobredose de Luveris são desconhecidos; no entanto, existe a possibilidade de que se produza um síndroma de hiperestimulação ovárica (ver secção 4). No entanto, isto só ocorrerá se se administrar hCG (ver secção 2 sob “Advertências e precauções”).
Se esquecer de usar Luveris
Não use uma dose dupla para compensar as doses esquecidas. Entre em contacto com o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Efeitos adversos graves
Entre em contacto com o seu médico de imediato se advertir algum dos efeitos adversos enumerados a seguir. O médico poderá indicar-lhe que deixe de usar Luveris.
Reacção alérgica
As reacções alérgicas, tais como erupção cutânea, rubor da pele, bolhas e inflamação da face com dificuldade para respirar, podem ser graves em certos casos. Este efeito adverso é muito raro (pode afectar até 1 de cada 10 000 pessoas).
Síndroma de hiperestimulação ovárica (SHO)
- A dor na região inferior do abdómen acompanhada de náuseas ou vómitos podem ser sintomas do síndroma de hiperestimulação ovárica (SHO). Os ovários podem ter reagido de forma excessiva ao tratamento e podem ter formado grandes bolsas de líquido ou quistes (ver secção 2 sob “Síndroma de hiperestimulação ovárica (SHO)”). Este efeito adverso é frequente (pode afectar até 1 de cada 10 pessoas). Se ocorrer isto, o seu médico terá que examiná-la o mais breve possível.
- Em casos muito raros, são dados complicações graves de coagulação sanguínea (episódios tromboembólicos), por geralmente com SHO grave. Isto pode causar dor no peito, falta de alento, acidente vascular cerebral ou ataque ao coração (ver secção 2 sob “Problemas de coagulação do sangue”).
Outros efeitos secundários frequentes
- Dor de cabeça
- Náuseas, vómitos, diarreia, molestias abdominais ou dor abdominal
- Bolsas de líquido nos ovários (quistes ováricos), dor no peito e dor pélvica
- Reacções locais no local de injeção, como são dor, picazão, hematomas, inflamação ou irritação
Não foi comunicado nenhum caso de torção do ovário nem hemorragias no abdómen após o tratamento com Luveris; no entanto, foram comunicados casos raros após o tratamento com gonadotropina menopáusica humana (hMG), um medicamento obtido a partir da urina, que também contém LH.
Pode produzir-se um embarazo ectópico (implantação do embrião fora do útero), especialmente em mulheres com antecedentes de doenças das trompas.
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Luveris
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e nos frascos após CAD. A data de validade é o último dia do mês que se indica.
Não conserve a uma temperatura superior a 25 °C. Conserve no embalagem original para protegê-lo da luz.
Não utilize este medicamento se observar indícios visíveis de deterioração, tais como descoloração do pó ou dano do envase.
O medicamento deve ser administrado imediatamente após dissolver o pó.
A solução não deve ser administrada se contém partículas ou não é límpida.
Os medicamentos não devem ser deitados fora pelos desagües nem para o lixo. Pergunte ao seu farmacêutico como deitar fora os envases e os medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Luveris
- O princípio ativo é lutropina alfa. Um frasco de pó injetável contém 75 UI (Unidades Internacionais).
- A lutropina alfa é Hormona Luteinizante humana recombinante, r-hLH, produzida mediante tecnologia de ADN recombinante.
- Os demais componentes do pó são polissorbato 20, sacarose, fosfato monossódico monohidratado, fosfato dissódico dihidratado, ácido fosfórico concentrado, hidróxido sódico, L-metionina e nitrogênio.
- O solvente é água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
- Luveris apresenta-se como um pó e solvente para solução injetável.
- Cada frasco de pó contém 75 UI de lutropina alfa e cada frasco de solvente contém 1 ml de água para preparações injetáveis.
- Luveris apresenta-se em caixas que contêm 1, 3 ou 10 frascos de pó juntamente com o mesmo número de frascos de solvente.
Título da autorização de comercialização
Merck Europe B.V.
Gustav Mahlerplein 102
1082 MA Amesterdão
Países Baixos
Responsável pela fabricação
Merck Serono S.p.A.
Via delle Magnolie 15
70026 Modugno (Bari)
Itália
Data da última revisão deste prospecto:06/2022
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
- País de registo
- Disponibilidade em farmáciasProblema de disponibilidade reportado
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a LUVERIS 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 150 UI/ 0,25 ml (11 microgramas/ 0,25 ml)Substância ativa: follitropin alfaFabricante: Gedeon Richter Plc.Requer receita médicaForma farmacêutica: INJETÁVEL, 150 UI/ 0,25 ml (11 microgramas/ 0,25 ml)Substância ativa: follitropin alfaFabricante: Gedeon Richter Plc.Requer receita médicaForma farmacêutica: INJETÁVEL, 150 UI/0,25 ml (11 microgramas/0,25 ml)Substância ativa: follitropin alfaFabricante: Gedeon Richter Plc.Requer receita médica
Médicos online para LUVERIS 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de LUVERIS 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.