EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO

Pergunte a um médico sobre a prescrição de EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO

Como usar EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO
Introdução
Prospecto: Informação para o paciente
Eylea 40 mg/ml solução injetável em frasco
aflibercepte
Leia todo o prospecto atentamente antes de receber este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Eylea e para que é utilizado
- O que precisa saber antes de receber Eylea
- Como será administrado Eylea
- Posíveis efeitos adversos
- Conservação de Eylea
- Conteúdo do envase e informações adicionais
1. O que é Eylea e para que é utilizado
Eylea é uma solução que é injetada no olho para tratar certas doenças oculares em pacientes adultos, designadas:
- degeneração macular associada à idade neovascular (exsudativa) comumente conhecida como DMAE exsudativa
- alteração da visão devida ao edema macular causado por um bloqueio das veias retinianas (oclusão da veia central da retina (OVCR) ou da ramo venosa da retina (ORVR))
- alteração da visão devida ao edema macular diabético (EMD)
- alteração da visão devida à neovascularização coroide miópica (NVC miópica).
Aflibercepte, o princípio ativo de Eylea, bloqueia a atividade de um grupo de fatores designados fator de crescimento endotelial vascular A (VEGF-A) e fator de crescimento placentário (PlGF).
Em pacientes com DMAE exsudativa e NVC miópica, quando estes fatores existem em quantidade excessiva influem na formação anormal de novos vasos sanguíneos no olho. Estes novos vasos sanguíneos podem causar uma fuga dos componentes do sangue para o interior do olho, com o consequente dano nos tecidos oculares responsáveis pela visão.
Em pacientes com OVCR, produz-se um bloqueio da veia principal que transporta sangue desde a retina. Devido a isso, os níveis de VEGF aumentam causando a fuga de fluido na retina e, portanto, a inchação da mácula (a parte da retina responsável pela visão fina), o que se conhece como edema macular.
Quando a mácula se enche de líquido, a visão central torna-se borrosa.
Em pacientes com ORVR, produz-se um bloqueio de uma ou mais ramas do vaso sanguíneo principal que transporta sangue desde a retina. Devido a isso, os níveis de VEGF aumentam causando a fuga de líquido na retina e, portanto, a inchação da mácula.
O edema macular diabético é uma inchação da retina que se produz em pacientes com diabetes devido à fuga de líquido dos vasos sanguíneos da mácula. A mácula é a parte da retina responsável pela visão fina. Quando a mácula se enche de líquido, a visão central torna-se borrosa.
Eylea demonstrou deter o crescimento dos novos vasos sanguíneos anormais no olho que frequentemente sangram ou apresentam fugas de líquido. Eylea pode ajudar a estabilizar e, em muitos casos, a melhorar a perda de visão produzida pela DMAE exsudativa, OVCR, ORVR, EMD e NVC miópica.
2. O que precisa saber antes de receber Eylea
Não deve receber Eylea
- se é alérgico a aflibercepte ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6)
- se tem uma infecção ativa ou suspeita que possa ter uma infecção no olho ou à sua volta (infecção ocular ou periocular)
- se padece uma inflamação grave do olho (indicada por dor ou vermelhidão).
Advertências e precauções
Consulte o seu médico antes de receber Eylea:
- Se sofre de glaucoma.
- Se tem antecedentes de visão de destelos de luz ou partículas flutuantes ou se de repente aumenta o tamanho e número de partículas flutuantes.
- Se foi operado ou tem programada uma cirurgia no olho nas quatro semanas anteriores ou nas quatro semanas seguintes.
- Se padece uma forma grave de OVCR ou bem ORVR (OVCR ou ORVR isquémicas), não está recomendado o tratamento com Eylea.
Além disso, é importante que saiba que:
- A segurança e eficácia de Eylea quando administrado em ambos os olhos ao mesmo tempo não foi estudada e se for utilizado desta forma pode dar lugar a um maior risco de que se produzam efeitos adversos.
- As injeções de Eylea podem produzir um aumento da pressão dentro do olho (pressão intraocular) em alguns pacientes nos 60 minutos seguintes à injeção. O seu médico fará um acompanhamento após cada injeção.
- Se desenvolver uma infecção ou inflamação na parte interna do olho (endoftalmitis) ou outras complicações, pode notar dor ou um aumento das molestias no olho, um agravamento do vermelhidão ocular, visão borrosa ou diminuída e aumento da sensibilidade à luz. É importante que todo sintoma que apareça seja diagnosticado e tratado o mais rápido possível.
- O seu médico verificará se tem outros fatores de risco que possam aumentar a possibilidade de que se produza um desgarro ou um desprendimento das camadas posteriores do olho (desgarro ou desprendimento de retina, ou bem um desgarro ou desprendimento do epitélio pigmentário da retina) em cujo caso Eylea será administrado com precaução.
- Eylea não deve ser utilizado durante a gravidez, a menos que o benefício potencial supere o risco potencial para o feto.
- As mulheres em idade fértil devem utilizar métodos anticonceptivos eficazes durante o tratamento e durante pelo menos três meses mais após a última injeção de Eylea.
O uso sistémico de inibidores do VEGF, substâncias semelhantes às que contém Eylea, está potencialmente relacionado com o risco de bloqueio dos vasos sanguíneos por coágulos de sangue (acontecimentos tromboembólicos arteriais) que podem dar lugar a um infarto de miocárdio ou um acidente cerebrovascular. Após a injeção de Eylea no olho, existe um risco teórico de que se possam produzir estes acontecimentos. Os dados sobre a segurança do tratamento de pacientes com OVCR, ORVR, EMD e NVC miópica que sofreram um acidente cerebrovascular, um acidente cerebrovascular transitório (ataque isquémico transitório), ou bem um infarto de miocárdio nos últimos 6 meses são limitados. Se algum destes casos lhe aplica, será administrado Eylea com precaução.
A experiência é só limitada no tratamento de:
- Pacientes com EMD devido à diabetes de tipo I.
- Pacientes diabéticos com valores médios de açúcar no sangue muito elevados (Hemoglobina glicosilada superior a 12%).
- Pacientes diabéticos com uma doença ocular provocada pela diabetes, conhecida como retinopatia diabética proliferativa.
Não existe experiência no tratamento de:
- Pacientes com infecções agudas.
- Pacientes com outras doenças oculares como desprendimento de retina ou buraco macular.
- Pacientes diabéticos com hipertensão não controlada.
- Pacientes não asiáticos com NVC miópica.
- Pacientes que foram tratados anteriormente por uma NVC miópica.
- Pacientes com danos fora da parte central da mácula (lesões extrafoveais) devido a uma NVC miópica.
Se algo do anterior lhe sucede, o seu médico terá em conta esta falta de informação no momento de o tratar com Eylea.
Crianças e adolescentes
Não foi estudado o uso de Eylea em crianças e adolescentes menores de 18 anos, porque a DMAE exsudativa, a OVCR, ORVR, EMD e a NVC miópica ocorrem principalmente em adultos. Por tanto, não procede o seu uso neste grupo de idade.
Uso de Eylea com outros medicamentos
Informa o seu médico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento.
Gravidez e lactação
- As mulheres em idade fértil devem utilizar métodos anticonceptivos eficazes durante o tratamento e durante pelo menos três meses mais após a última injeção de Eylea.
- Não há experiência com o uso de Eylea em mulheres grávidas. Não se deve utilizar Eylea durante a gravidez a menos que o benefício potencial supere o risco potencial para o feto. Se está grávida ou tem intenção de ficar grávida, comente com o seu médico antes do tratamento com Eylea.
- Podem passar para o leite materno quantidades pequenas de Eylea. Desconhece-se os efeitos em recém-nascidos/bebés lactantes. Eylea não está recomendado durante a lactação. Se é uma mulher em período de lactação, comente com o seu médico antes do tratamento com Eylea.
Condução e uso de máquinas
Após a injeção de Eylea pode experimentar algumas alterações visuais transitórias. Não conduza nem use máquinas enquanto duram estas alterações.
Eylea contém
- menos de 1 mmol de sódio (23 mg) por unidade de dose; isto é, essencialmente “exento de sódio”.
- 0,015 mg de polissorbato 20 em cada dose de 0,05 ml equivalente a 0,3 mg/ml. Os polissorbatos podem causar reações alérgicas. Informe o seu médico se tem qualquer alergia conhecida.
3. Como será administrado Eylea
Eylea será administrado por um médico com experiência na administração de injeções oculares, em condições assépticas (de limpeza e estéreis).
A dose recomendada é de 2 mg de aflibercepte (0,05 ml).
Eylea é administrado em forma de injeção no interior do olho (injeção intravítrea).
Antes da injeção, o seu médico utilizará um lavado ocular desinfectante para limpar cuidadosamente o seu olho para prevenir uma infecção. O seu médico também lhe administrará um anestésico local para reduzir ou prevenir qualquer dor que possa sentir com a injeção.
DMAE exsudativa
Os pacientes com DMAE exsudativa serão tratados com uma injeção mensal para as três primeiras doses, seguida de outra injeção após outros dois meses.
O seu médico decidirá então se o intervalo de tratamento entre as injeções pode manter-se cada dois meses ou estender-se gradualmente em intervalos de 2 ou 4 semanas se a sua doença se estabilizou. Se a sua doença piora, o intervalo entre as injeções pode ser encurtado.
Não é necessário que o seu médico o visite entre injeções, a menos que o seu médico considere o contrário ou você experimente algum problema.
Edema macular secundário a OVR (de ramo ou central)
O seu médico determinará o programa de tratamento mais adequado para si. O seu tratamento será iniciado com uma série de injeções de Eylea administradas uma vez ao mês.
O intervalo entre duas injeções não deve ser inferior a um mês.
O seu médico poderá decidir interromper o tratamento com Eylea se não se beneficia do tratamento contínuo.
O tratamento continuará com uma injeção uma vez ao mês até que a sua doença se estabilize. Pode precisar de três ou mais injeções mensais.
O seu médico controlará a sua resposta ao tratamento e poderá continuar o tratamento, incrementando de forma gradual o intervalo entre as injeções para estabilizar a sua doença. Em caso de piora com um intervalo entre tratamentos mais longo, o seu médico reduzirá o intervalo entre injeções.
Em função da sua resposta ao tratamento, o seu médico decidirá o programa de seguimento e tratamento.
Edema macular diabético (EMD)
Os pacientes com EMD serão tratados com uma injeção mensal para as cinco primeiras doses consecutivas, e a continuação, uma injeção cada dois meses.
O intervalo entre tratamentos pode manter-se cada dois meses ou ajustar-se segundo a sua doença em função da exploração realizada pelo seu médico. O seu médico decidirá o programa de visitas de seguimento.
O seu médico poderá decidir a interrupção do tratamento com Eylea se verificar que você não se beneficia do tratamento contínuo.
Neovascularização coroide (NVC) miópica
Os pacientes com NVC miópica serão tratados com uma única injeção. Só receberá mais injeções se as explorações do seu médico revelarem que a sua doença não melhorou.
O intervalo entre duas injeções não deve ser inferior a um mês.
Se a sua doença desaparece e depois regressa, o seu médico pode reiniciar o tratamento.
O seu médico decidirá sobre o programa de revisões de seguimento.
Se não receber uma dose de Eylea
Pida uma nova consulta para que o examinem e lhe administrem a injeção.
Interrupção do tratamento com Eylea
Consulte o seu médico antes de interromper o tratamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Potencialmente poderiam produzir-se reações alérgicas(hipersensibilidade). Estas podem ser graves erequerem que se ponha em contacto com o seu médico imediatamente.
Com a administração de Eylea podem produzir-se alguns efeitos adversos que afetam os olhos que são devidos ao procedimento de injeção. Alguns podem ser graves, incluyendo cegueira, uma infecçãograve ou inflamação no interior do olho(endoftalmitis), desprendimento, desgarro ou hemorragia da camada sensível à luz na parte posterior do olho(desprendimento ou desgarro da retina), enturbiação do cristalino(catarata), hemorragia no olho(hemorragia vítrea), desprendimento da substância semelhante a um gel que se encontra no interior do olho em contacto com a retina(desprendimento de vítreo) e aumento da pressão no interior do olho(ver secção 2). Estes efeitos adversos graves que afetam os olhos produziram-se em menos de 1 de 1.900 injeções durante os ensaios clínicos.
Se nota uma diminuição repentina da visão ou um aumento da dor e vermelhidão no olho após a injeção, consulte imediatamente o seu médico.
Lista dos efeitos adversos comunicados
A seguir inclui-se uma lista dos efeitos adversos comunicados como possivelmente relacionados com o procedimento de injeção ou com o medicamento. Não deve alarmar-se, porque pode que você não experimente nenhum deles. Consulte sempre com o seu médico acerca de qualquer suspeita de efeito adverso.
Efeitos adversos muito frequentes(podem afetar mais de 1 de cada 10 pessoas):
- pioria da visão
- sangramento na parte posterior do olho (hemorragia retiniana)
- sangue no olho devido ao sangramento de pequenos vasos sanguíneos nas camadas externas do olho
- dor ocular
Efeitos adversos frequentes(podem afetar até 1 de cada 10 pessoas):
- desprendimento ou desgarro de uma das camadas da parte posterior do olho que produzem destelos de luz com manchas flutuantes que por vezes progride para perda de visão (desgarro*/desprendimento do epitélio pigmentário da retina, desgarro/desprendimento da retina)
- degeneração da retina (que causa alterações da visão)
- sangramento no olho (hemorragia vítrea)
- certas formas de enturbiação do cristalino (catarata)
- danos na camada superficial do globo ocular (a córnea)
- aumento da pressão no interior do olho
- manchas na visão (partículas flutuantes)
- desprendimento da substância semelhante a um gel que se encontra no interior do olho da retina (desprendimento vítreo, que resulta em destelos de luz com manchas flutuantes)
- sensação de ter algo dentro do olho
- aumento da produção de lágrimas
- inchação do párpado
- sangramento no local de injeção
- vermelhidão do olho
- Efeitos adversos que se sabe estão associados à DMAE exsudativa; observados unicamente em pacientes com DMAE exsudativa.
Efeitos adversos pouco frequentes(podem afetar até 1 de cada 100 pessoas):
- reações alérgicas (hipersensibilidade)**
- inflamação ou infecção grave dentro do olho (endoftalmitis)
- inflamação do íris ou de outras partes do olho (iritis, uveíte, iridociclite, células flutuantes na câmara anterior)
- sensação anormal no olho
- irritação no párpado
- inchação da camada superficial do globo ocular (córnea)
- Foram notificadas reações alérgicas como erupção, picazón (prurido), ronchas (urticária) e alguns casos de reações alérgicas (anafilácticas/anafilactoides) graves.
Efeitos adversos raros(podem afetar até 1 de cada 1.000 pessoas):
- cegueira
- enturbiação do cristalino devido a lesão (catarata traumática)
- inflamação da substância semelhante a um gel que se encontra no interior do olho
- pus no olho
Frequência não conhecida(não pode ser estimada a partir dos dados disponíveis):
- inflamação da parte branca do olho associada com vermelhidão e dor (esclerite)
Nos ensaios clínicos observou-se um aumento da incidência de sangramento dos vasos sanguíneos pequenos nas camadas externas do olho (hemorragia conjuntival) em pacientes com DMAE exsudativa que recebiam tratamento com medicamentos anticoagulantes. Este aumento da incidência foi comparável nos pacientes tratados com ranibizumab e com Eylea.
O uso sistémico de inibidores do VEGF, substâncias semelhantes às que contém Eylea, está potencialmente relacionado com o risco de formação de coágulos de sangue que bloqueiam os vasos sanguíneos (acontecimentos tromboembólicos arteriais) que podem dar lugar a um infarto de miocárdio ou uma embolia. Há um risco teórico de que possa produzir-se este tipo de acontecimentos após a injeção de Eylea no olho.
Como com todas as proteínas terapêuticas, existe a possibilidade de uma reação imune (formação de anticorpos) com Eylea.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Eylea
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece na caixa e na etiqueta após “CAD/EXP”. A data de validade é o último dia do mês que se indica.
- Conservar na geladeira (entre 2 ºC e 8 ºC). Não congelar.
- O frasco sem abrir pode ser conservado fora da geladeira por baixo de 25 ºC durante um máximo de 24 horas.
- Conservar no embalagem original para protegê-lo da luz.
- Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos recipientes e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Eylea
- O princípio ativo é: aflibercepte. Um frasco contém um volume extrair de pelo menos 0,1 ml, equivalente a pelo menos 4 mg de aflibercepte. Um frasco fornece uma dose de 2 mg de aflibercepte em 0,05 ml.
- Os outros componentes são: polissorbato 20 (E 432), dihidrogenofosfato de sódio monohidratado (para o ajuste do pH), hidrogenofosfato de disódio heptahidratado (para o ajuste do pH), cloreto de sódio, sacarose, água para preparações injetáveis.
Ver “Eylea contém” na seção 2 para mais informações.
Aspecto do produto e conteúdo do envase
Eylea é uma solução injetável (injetável) em frasco. A solução é incolora a amarelo pálido.
Envase com 1 frasco + 1 agulha de filtro.
Título da autorização de comercialização
Bayer AG
51368 Leverkusen
Alemanha
Responsável pela fabricação
Bayer AG
Müllerstraße 178
13353 Berlim
Alemanha
Podem solicitar mais informações respeito a este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica / Bélgica / Bélgica Bayer SA-NV Tel: +32-(0)2-535 63 11 | Lituânia UAB Bayer Tel: +370-5-233 68 68 |
Bulgária ????? ???????? ???? Tel: +359-(0)2-424 72 80 | Luxemburgo / Luxemburgo Bayer SA-NV Tel: +32-(0)2-535 63 11 |
República Tcheca Bayer s.r.o. Tel: +420-266 101 111 | Hungria Bayer Hungária KFT Tel: +36-1-487 4100 |
Dinamarca Bayer A/S Tel: +45-45 235 000 | Malta Alfred Gera and Sons Ltd. Tel: +356-21 44 62 05 |
Alemanha Bayer Vital GmbH Tel: +49-(0)214-30 513 48 | Países Baixos Bayer B.V. Tel: +31–23-799 1000 |
Estônia Bayer OÜ Tel: +372-655 85 65 | Noruega Bayer AS Tel: +47-23 13 05 00 |
Grécia Bayer Ελλάς ΑΒΕΕ Tel: +30-210-618 75 00 | Áustria Bayer Áustria Ges. m. b. H. Tel: +43-(0)1-711 460 |
Espanha Bayer Hispania S.L. Tel: +34-93-495 65 00 | Polônia Bayer Sp. z o.o. Tel: +48-22-572 35 00 |
França Bayer HealthCare Tel (N° verde): +33-(0)800 87 54 54 | Portugal Bayer Portugal, Lda. Tel: +351-21-416 42 00 |
Croácia Bayer d.o.o. Tel: + 385-(0)1-6599 900 | Romênia SC Bayer SRL Tel: +40-(0)21-529 59 00 |
Irlanda Bayer Limited Tel: +353-(0)1-216 3300 | Eslovênia Bayer d. o. o. Tel: +386-(0)1-58 14 400 |
Islândia Icepharma hf. Tel: +354-540 80 00 | República Eslovaca Bayer, spol. s r.o. Tel: +421-(0)2-59 21 31 11 |
Itália Bayer S.p.A. Tel: +39-02-3978 1 | Finlândia Bayer Oy Tel: +358-(0)20-78521 |
Chipre NOVAGEM Limited Tel: +357-22-48 38 58 | Suécia Bayer AB Tel: +46-(0)8-580 223 00 |
Letônia SIA Bayer Tel: +371-67 84 55 63 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
Se deseja informação local, escaneie aqui para acessar o site https://www.pi.bayer.com/eylea2.
É incluído um código QR com o link para o prospecto.
<------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
O frasco deve ser utilizado para o tratamento de um único olho.
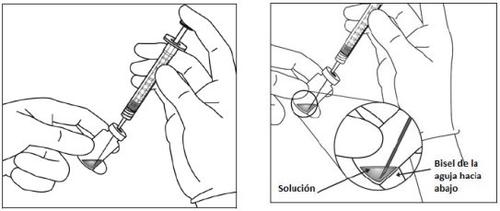
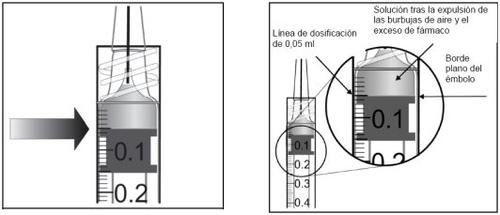
O frasco contém mais quantidade do que a dose recomendada de 2 mg de aflibercepte (equivalente a 0,05 ml). O excesso de volume deve ser eliminado antes da administração.
Antes da administração, a solução deve ser inspecionada visualmente para detectar a presença de partículas e/ou um cambio de cor ou qualquer cambio no aspecto físico. Se observar qualquer um deles, não utilize o medicamento.
O frasco sem abrir de Eylea pode ser conservado fora da geladeira por baixo de 25°C durante um máximo de 24 horas. Após a abertura do frasco, proceda sob condições assépticas.
Para a injeção intravítrea deve ser usada uma agulha de injeção de 30 G x ½ polegada (1,27 cm).
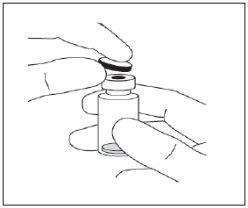
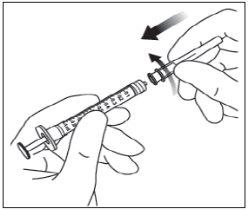
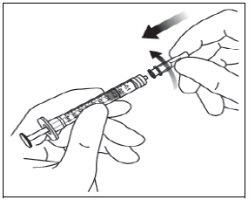
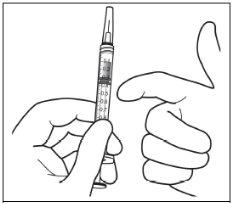
Instruções de uso do frasco:
|
|
|
|
| |
| |
| |
| |
Nota: a agulha de filtro não deve ser utilizada para a injeção intravítrea. | |
|
|
|
|
| |
| |
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCOForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Celltrion Healthcare Hungary Kft.Requer receita médica
Alternativas a EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO em Ucrania
Médicos online para EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de EYLEA 40 mg/ml SOLUÇÃO INJETÁVEL EM FRASCO – sujeita a avaliação médica e regras locais.