CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA

Como usar CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA
Introdução
Prospecto:informação para o utilizador
Cervarix suspensão injetável em seringa precarregada
Vacina contra o Vírus do Papiloma Humano [Tipos 16, 18]
(Recombinante, adjuvada, adsorvida)
Leia todo o prospecto atentamente antes de começar a receber esta vacina,porque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Cervarix e para que é utilizado
- O que precisa saber antes de receber Cervarix
- Como administrar Cervarix
- Posíveis efeitos adversos
- Conservação de Cervarix
- Conteúdo do envase e informação adicional
1. O que é Cervarix e para que é utilizado
Cervarix é uma vacina que está indicada para proteger pessoas a partir dos 9 anos de idade contra as doenças causadas pela infecção pelo Vírus do Papiloma Humano (VPH).
Estas doenças incluem:
- câncer de colo do útero (ou seja, de colo uterino ou matriz) e câncer anal,
- lesões precancerosas de colo do útero, vulva, vagina e ânus (alterações nas células genitais ou anais que têm risco de se transformar em câncer).
Os tipos do Vírus do Papiloma Humano (VPH) contidos na vacina (tipos 16 e 18) são responsáveis por, aproximadamente, 70% dos cânceres de colo do útero, 90% dos cânceres anais, 70% das lesões precancerosas da vulva e da vagina relacionadas com o VPH e 78% das lesões precancerosas do ânus relacionadas com o VPH. Outros tipos do VPH também podem causar cânceres ano-genitais. Cervarix não protege contra todos os tipos do VPH.
Quando se vacina uma pessoa com Cervarix, o sistema imunológico (o sistema de defesa natural do organismo) gera anticorpos contra os VPH tipos 16 e 18.
Cervarix não é infecciosa e, portanto, não pode causar doenças relacionadas com o VPH.
Cervarix não é utilizado para curar doenças relacionadas com o VPH que já estejam presentes no momento da vacinação.
Cervarix deve ser utilizado de acordo com as recomendações oficiais.
2. O que precisa saber antes de começar a receber Cervarix
Cervarix não deve ser administrado
- se for alérgico a algum dos princípios ativos ou a algum dos outros componentes desta vacina (incluídos na secção 6). Os sinais de uma reação alérgica podem incluir erupção cutânea com picazón, dificuldade para respirar e inchação da face ou língua
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de receber Cervarix:
- se tiver um problema de coagulação ou aparecerem hematomas com facilidade
- se tiver alguma doença que reduza a sua resistência à infecção, como uma infecção por VIH
- se tiver uma infecção grave com febre alta. Pode ser necessário que adie a vacinação até que se recupere. Uma infecção de pouca importância, como um resfriado, não deveria ser um problema para a vacinação, mas antes de se vacinar comente isso com o seu médico.
Antes ou depois de qualquer injeção, poderá ocorrer um desmaio (especialmente em adolescentes), por isso deve informar o seu médico ou enfermeiro se você ou o seu filho desmaiou em ocasiões anteriores após a administração de uma injeção.
Como todas as vacinas, pode ser que Cervarix não proteja completamente todas as pessoas que se vacinam.
Cervarix não protege das doenças causadas pela infecção pelos tipos 16 ou 18 do VPH se, no momento da vacinação, os sujeitos já estiverem infectados pelos tipos 16 ou 18 do Vírus do Papiloma Humano.
Embora a vacinação possa protegê-lo contra o câncer de colo do útero, não é um substituto do exame ginecológico de rotina do colo do útero. Você deve seguir os conselhos do seu médico relativamente à realização de citologias do colo do útero/prueba de Papanicolaou (prueba para detectar as alterações nas células do colo do útero causadas por uma infecção por VPH) e ao uso de medidas preventivas e protectoras.
Como Cervarix não protege contra todos os tipos do Vírus do Papiloma Humano, deve continuar a tomar as precauções apropriadas para evitar o contágio do VPH e das doenças de transmissão sexual.
Cervarix não protege contra outras doenças que não sejam causadas pelo Vírus do Papiloma Humano.
Outros medicamentos e Cervarix
Cervarix pode ser administrado com uma vacina combinada de reforço que contenha difteria (d), tétanos (T) e pertussis [acelular] (pa), com ou sem poliomielite inativada (IPV) (vacinas dTpa, dTpa-IPV), com uma vacina combinada anti-hepatite A e anti-hepatite B (Twinrix), com uma vacina anti-hepatite B (Engerix B) ou com uma vacina conjugada com toxoide tetânico contra os serogrupos meningocócicos A, C, W-135 e Y (MenACWY-TT), em um local de injeção diferente (outra parte do seu corpo, por exemplo, outro braço) na mesma visita.
Pode ser que Cervarix não tenha um efeito óptimo se você usar medicamentos que suprimam o sistema imunológico.
Nos estudos clínicos, o uso de anticoncepcionais orais (por exemplo, a pílula) não diminuiu a proteção obtida por Cervarix.
Informar o seu médico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento ou se recebeu recentemente qualquer outra vacina.
Gravidez, lactação e fertilidade
Se está grávida, ficou grávida durante o período de vacinação ou está tentando ficar grávida, recomenda-se que adie ou interrompa a vacinação até o final da gravidez.
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de receber esta vacina.
Condução e uso de máquinas
É pouco provável que Cervarix afete a sua capacidade para conduzir ou usar máquinas. No entanto, não conduza ou maneje máquinas se não se encontrar bem.
Cervarix contém sódio
Esta vacina contém menos de 1 mmol de sódio (23 mg) por dose; isto é essencialmente “isento de sódio”.
3. Como administrar Cervarix
Como a vacina é administrada
O médico ou o enfermeiro lhe administrará Cervarix por meio de uma injeção no músculo da parte superior do braço.
Quantidade administrada
Cervarix é indicado em pessoas a partir dos 9 anos de idade.
O número total de injeções que receberá depende da sua idade no momento da primeira injeção.
Se tiver entre 9 e 14 anos
Receberá 2 injeções:
Primeira injeção: na data escolhida.
Segunda injeção: entre 5 e 13 meses após a primeira injeção.
Se tiver 15 anos ou mais
Receberá 3 injeções:
Primeira injeção: na data escolhida.
Segunda injeção: 1 mês após a primeira injeção.
Terceira injeção: 6 meses após a primeira injeção.
Em caso necessário, o esquema de vacinação pode ser mais flexível. Consulte o seu médico para mais informações.
Uma vez administrada a primeira dose de Cervarix, recomenda-se que se utilize Cervarix (e não outra vacina contra o VPH) para completar o esquema de vacinação.
Não se recomenda o uso de Cervarix em pessoas menores de 9 anos de idade.
A vacina nunca deve ser injetada em uma veia.
Se esquecer uma dose
É importante que siga as instruções indicadas pelo seu médico ou enfermeiro relativamente às visitas posteriores. Se esquecer de voltar ao seu médico na data agendada, peça conselho ao seu médico.
Se não terminar o ciclo completo de vacinação (duas ou três injeções, dependendo da sua idade no momento da vacinação), pode ser que não obtenha o melhor efeito e proteção da vacinação.
4. Posíveis efeitos adversos
Como todos os medicamentos, esta vacina pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos que ocorreram durante os ensaios clínicos com Cervarix foram:
- Muito frequentes (efeitos adversos que ocorrem em mais de 1 em cada 10 doses de vacina): dor ou desconforto no local da injeção, vermelhidão ou inflamação no local da injeção, dor de cabeça, dores musculares, sensibilidade ou fraqueza muscular (não causados pelo exercício físico), cansaço.
- Frequentes (efeitos adversos que ocorrem em menos de 1 em cada 10, mas em mais de 1 em cada 100 doses de vacina): sintomas gastrointestinais, incluindo náuseas, vômitos, diarreia e dor abdominal, picazón, vermelhidão da pele e erupção cutânea, urticária, dor nas articulações, febre (?38°C).
- Pouco frequentes (efeitos adversos que ocorrem em menos de 1 em cada 100, mas mais de 1 em cada 1.000 doses de vacina): infecção nas vias respiratórias superiores (infecção de nariz, garganta ou traqueia), tontura, outras reações no local da injeção, como endurecimento, formigamento ou adormecimento da zona.
Os efeitos adversos observados durante a comercialização de Cervarix incluem:
- reações alérgicas. Estas podem ser reconhecidas por:
- erupção cutânea com picazón nas mãos e pés,
- inchação dos olhos e da face,
- dificuldade para respirar ou engolir,
- queda repentina da pressão sanguínea e perda de consciência.
Normalmente, estas reações aparecerão antes de abandonar a consulta do médico. No entanto, se o seu filho sofrer algum destes sintomas, deve contactar urgentemente um médico.
- inchação dos gânglios do pescoço, das axilas ou das virilhas
- desmaio, algumas vezes acompanhado de tremores ou rigidez.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano, https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Cervarix
Mantenha esta vacina fora da vista e do alcance das crianças.
Não utilize esta vacina após a data de validade que aparece no envase. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2°C e 8°C).
Não congelar.
Conservar no embalagem original para protegê-la da luz.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, você ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deCervarix
- Os princípios ativos são:
Proteína L1 do Vírus do Papiloma Humano1 tipo 162,3,4 20 microgramas
Proteína L1 do Vírus do Papiloma Humano1 tipo 182,3,4 20 microgramas
1Vírus do Papiloma Humano = VPH
2adjuvada com AS04 que contém:
3-O-desacil-4’-monofosforil lípido A (MPL)3 50 microgramas
3adsorvida em hidróxido de alumínio, hidratado (Al(OH)3) 0,5 miligramas de Al3+
em total
4Proteína L1 em forma de partículas não infecciosas semelhantes ao vírus (VLPs) produzidas por tecnologia de ADN recombinante usando um sistema de expressão em Baculovirus que utiliza células Hi-5 Rix4446 derivadas do inseto Trichoplusia ni.
- Os outros componentes são: cloreto de sódio (NaCl), dihidrogenofosfato de sódio dihidratado (NaH2PO4.2 H2O) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Suspensão injetável em seringa precarregada.
Cervarix é uma suspensão branca turva.
Cervarix está disponível em seringa precarregada de 1 dose, com ou sem agulhas separadas; tamanhos de envase de 1 e 10.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89
B-1330 Rixensart, Bélgica
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 | Lituânia GlaxoSmithKline Biologicals SA Tel: +370 80000334 |
Bulgária GlaxoSmithKline Biologicals SA Tel: + 359 80018205 | Luxemburgo GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 |
República Checa GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 | Hungria GlaxoSmithKline Biologicals SA Tel: + 36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tel: + 45 36 35 91 00 | Malta GlaxoSmithKline Biologicals SA Tel: + 356 80065004 |
Alemanha GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 | Países Baixos GlaxoSmithKline BV Tel: + 31 (0)30 69 38 100 |
Estônia GlaxoSmithKline Biologicals SA Tel: +372 8002640 | Noruega GlaxoSmithKline AS Tel: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Μονοπρ?σωπη A.E.B.E Tel: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
Espanha GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polônia GSK Services Sp. z o.o. Tel: + 48 (22) 576 9000 |
França Laboratoire GlaxoSmithKline Tel: + 33 (0) 1 39 17 84 44 Croácia GlaxoSmithKline Biologicals SA Tel: + 385 800787089 | Portugal GlaxoSmithKline - Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 Romênia GlaxoSmithKline Biologicals SA Tel: +40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Ltd Tel: + 353 (0)1 495 5000 | Eslovênia GlaxoSmithKline Biologicals SA Tel: + 386 80688869 |
Islândia Vistor hf. Tel: +354 535 7000 | Eslováquia GlaxoSmithKline Biologicals SA Tel: + 421 800500589 |
Itália GlaxoSmithKline S.p.A. Tel: + 39 (0)45 7741 111 | Finlândia GlaxoSmithKline Oy Tel: + 358 10 30 30 30 |
Chipre GlaxoSmithKline Biologicals SA Tel: + 357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia GlaxoSmithKline Biologicals SA Tel: + 371 80205045 | Reino Unido (Irlanda do Norte) GlaxoSmithKline Biologicals SA Tel: +44 (0)800 221 441 |
Data da última revisão deste prospecto:04/2023
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu, e na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/).
-----------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais de saúde:
Uma vez fora do frigorífico, Cervarix deve ser administrado o mais rápido possível. No entanto, foi demonstrada sua estabilidade quando armazenado fora do frigorífico por até 3 dias a uma temperatura entre 8°C e 25°C ou até 1 dia a uma temperatura entre 25°C e 37°C. Se não for utilizado após este período, descarte a vacina.
Durante a conservação da seringa, pode ser observado um depósito branco e um sobrenadante transparente. Isso não é sinal de deterioração.
Deve-se examinar visualmente o conteúdo da seringa tanto antes como após agitar para observar se existe alguma partícula estranha e/ou variação do aspecto físico antes de sua administração.
Em caso de observar alguma dessas circunstâncias, deve descartar a vacina.
A vacina deve ser agitada bem antes de seu uso.
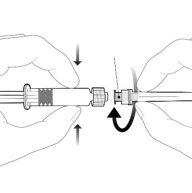
Instruções para a seringa precarregada
| Segure a seringa pelo corpo, não pelo émbolo. Desrosqueie a tampa da seringa girando-a no sentido contrário ao das agulhas do relógio. |
| Para inserir a agulha, conecte a base ao adaptador luer-locke gire um quarto de volta no sentido das agulhas do relógio até que sinta que se bloqueia. Não retire o émbolo da seringa do corpo. Se isso ocorrer, não administre a vacina. |
Eliminação de resíduos
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 20 µg / 20 µgSubstância ativa: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequer receita médicaSubstância ativa: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequer receita médicaSubstância ativa: papillomavirus (human types 16, 18)Fabricante: Glaxosmithkline BiologicalsRequer receita médica
Alternativas a CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA em Ukraina
Médicos online para CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de CERVARIX SUSPENSÃO PARA INJEÇÃO EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.