ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA

Pergunte a um médico sobre a prescrição de ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA

Como usar ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA
Introdução
Prospecto: informação para o utilizador
ANDEMBRY 200 mg solução injetável em caneta pré-carregada
garadacimab
Este medicamento está sujeito a monitorização adicional, o que facilitará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, pois contém informação importante para si.
- Conservar este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se experimentar qualquer tipo de efeito secundário, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é ANDEMBRY e para que é utilizado
- O que precisa saber antes de começar a usar ANDEMBRY
- Como usar ANDEMBRY
- Efeitos adversos possíveis
- Conservação de ANDEMBRY
- Conteúdo do envase e informação adicional
- Instruções de uso
1. O que é ANDEMBRY e para que é utilizado
ANDEMBRY contém o princípio ativo garadacimab.
ANDEMBRY é um medicamento utilizado em pacientes a partir de 12 anos de idade com angioedema hereditário (AEH) para prevenir as crises de angioedema.
O AEH é uma doença que provoca episódios recorrentes de inchaço de rápida aparência, conhecidos como crises de AEH, em distintas partes do corpo, incluindo:
- mãos e pés;
- face, pálpebras, lábios ou língua;
- laringe e garganta, o que pode dificultar a respiração;
- genitais;
- estômago e intestino.
As crises de AEH podem ser dolorosas e incapacitantes. As crises que afetam a garganta ou a laringe podem ser perigosas ou mesmo pôr em risco a vida.
Embora o AEH muitas vezes se apresente em famílias, algumas pessoas podem não ter antecedentes familiares. São conhecidos três tipos de AEH, de acordo com o tipo de defeito genético e seu efeito sobre uma proteína que circula pelo sangue, denominada inibidor da C1 esterase (C1-INH). Uma pessoa pode ter níveis baixos de C1-INH no organismo (AEH tipo I), C1-INH de funcionamento deficiente (AEH tipo II) ou AEH com C1-INH de funcionamento normal (AEH tipo III). O último tipo é extremamente raro. Os três tipos produzem os mesmos sintomas clínicos de inchaço localizado.
O C1-INH regula um processo no organismo que controla a produção de uma substância inflamatória denominada bradicinina. A sobreprodução de bradicinina provoca inchaço e inflamação em pessoas com AEH.
O princípio ativo de ANDEMBRY, garadacimab, bloqueia a ativação de uma proteína conhecida como fator XIIa (FXIIa), que participa na estimulação da produção de bradicinina. Ao bloquear a atividade do FXIIa, garadacimab reduz o nível de bradicinina, para prevenir assim os ataques de AEH. Algumas subcategorias de AEH com C1-INH normal podem não responder ao tratamento com garadacimab. Fale com o seu médico se tiver alguma preocupação sobre o seu medicamento.
2. O que precisa saber antes de começar a usar ANDEMBRY
Não use ANDEMBRY
Se é alérgico a garadacimab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
- Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar ANDEMBRY.
- Se tiver uma reação alérgica grave a ANDEMBRY com sintomas como urticária, opressão no peito, dificuldade para respirar, sibilância, hipotensão ou anafilaxia, informe o seu médico, farmacêutico ou enfermeiro imediatamente.
- Trate uma crise de angioedema hereditário com o seu medicamento de resgate habitual sem tomar doses adicionais de ANDEMBRY.
Mantenha um registo
Recomenda-se encarecidamente que, cada vez que se administre ANDEMBRY, anote o nome e o número de lote do medicamento. Desta forma, manterá um registo dos lotes utilizados.
Provas analíticas
Informe o seu médico se está usando ANDEMBRY antes de realizar provas analíticas para medir a coagulação do seu sangue. Isto deve-se a que ANDEMBRY pode interferir com algumas provas analíticas e dar lugar a resultados inexatos.
Crianças e adolescentes
Não se recomenda o uso de ANDEMBRY em crianças menores de 12 anos de idade. Isto deve-se a que não foi estudado neste grupo de idade.
Outros medicamentos e ANDEMBRY
Informe o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou pudesse ter que utilizar qualquer outro medicamento.
Não se conhece que ANDEMBRY afete outros medicamentos nem que seja afetado por outros medicamentos.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar ANDEMBRY. Existe informação limitada sobre a segurança do uso de ANDEMBRY durante a gravidez e a amamentação. Como medida de precaução, é preferível evitar o uso de ANDEMBRY durante a gravidez. O seu médico discutirá com si os riscos e benefícios de tomar este medicamento.
Condução e uso de máquinas
A influência deste medicamento sobre a capacidade para conduzir e utilizar máquinas é nula ou insignificante.
ANDEMBRY contém prolina.
Este medicamento contém 19,3 mg de prolina em cada caneta pré-carregada, equivalente a 16,1 mg/ml. A prolina pode ser prejudicial para os pacientes com hiperprolinemia, uma doença genética rara em que a prolina se acumula no organismo. Se si (ou o seu filho) padece hiperprolinemia, não utilize este medicamento a menos que o seu médico o recomende.
ANDEMBRY contém polissorbato 80.
Este medicamento contém 0,24 mg de polissorbato 80 em cada caneta pré-carregada, o que equivale a 0,2 mg/ml. Os polissorbatos podem causar reações alérgicas. Informe o seu médico se tiver alguma alergia conhecida.
3. Como usar ANDEMBRY
ANDEMBRY é apresentado em uma caneta pré-carregada de uso único. O seu tratamento começará sob a supervisão e gestão de um profissional de saúde.
Siga exatamente as instruções de administração do medicamento contidas neste prospecto ou as indicadas pelo seu médico, farmacêutico ou enfermeiro. Em caso de dúvida ou de qualquer outra pergunta sobre o uso deste medicamento, consulte novamente o seu médico, farmacêutico ou enfermeiro.
Quanto ANDEMBRY usar
A dose recomendada de ANDEMBRY é uma dose de carga inicial de 400 mg administrada em duas injeções de 200 mg no primeiro dia de tratamento, seguida de uma dose mensal de 200 mg.
Como injetar ANDEMBRY
Pode autoadministrar ANDEMBRY ou um cuidador pode administrá-lo. Em ambos os casos, si ou o seu cuidador devem ler e seguir atentamente as instruções da secção 7, “Instruções de uso”.
- ANDEMBRY é administrado por via subcutânea (“injeção subcutânea”) na barriga (abdomen), no músculo da coxa ou na parte superior do braço.
- Um médico, farmacêutico ou enfermeiro deve mostrar-lhe como administrar ANDEMBRY corretamente antes de usá-lo pela primeira vez. Não se autoadministre nem permita que um cuidador lhe administre até não ter recebido formação sobre como injetar o medicamento.
- Use cada caneta pré-carregada apenas uma vez.
- Se a caneta não funcionar como está previsto, informe o seu médico, farmacêutico ou enfermeiro o mais breve possível.
- Recomenda-se rotar entre locais de injeção.
Se usar mais ANDEMBRY do que deve
Informe o seu médico, farmacêutico ou enfermeiro se usar demasiado ANDEMBRY.
Se esquecer de usar ANDEMBRY
Se esquecer de uma dose de ANDEMBRY, administre a sua dose o mais breve possível. Se não tiver certeza de quando injetar ANDEMBRY após uma dose esquecida, consulte o seu médico, farmacêutico ou enfermeiro.
Se interromper o tratamento com ANDEMBRY
É importante que continue a administrar-se ANDEMBRY de acordo com as indicações do seu médico, mesmo que se sinta melhor.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Informe o seu médico, farmacêutico ou enfermeiro se notar algum dos seguintes efeitos secundários.
Frequentes(podem afetar até 1 de cada 10 pessoas):
- Reações no local de administração que incluem rubor, hematomas, prurido e urticária
- Cefaleia
- Dor abdominal
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito secundário, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional incluído no Apêndice V.
Ao comunicar efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de ANDEMBRY
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece na caixa exterior e na etiqueta após EXP. A data de validade é o último dia do mês que se indica.
Conservar no frigorífico (entre 2 °C - 8 °C). Não congelar. Conservar a caneta pré-carregada no embalagem exterior para protegê-la da luz.
A caneta pré-carregada pode ser conservada a temperatura ambiente (até 25 °C) durante um período único de até 2 meses, mas não além da data de validade.
Não volte a armazenar ANDEMBRY no frigorífico após o ter conservado a temperatura ambiente.
Não use este medicamento se observar sinais de deterioração como partículas ou alteração da cor da solução.
Os medicamentos não devem ser eliminados pelos esgotos nem para o lixo. Pergunte ao seu farmacêutico como se desfazer dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de ANDEMBRY
- O princípio ativo é garadacimab. Cada caneta precarregada contém 200 mg de garadacimab em 1,2 ml de solução.
- Os outros componentes são histidina, monohidrocloruro de arginina, prolina, polissorbato 80 e água para preparações injetáveis; ver seção 2 “ANDEMBRY contém prolina e polissorbato 80”.
Aspecto de ANDEMBRY e conteúdo do envase
ANDEMBRY apresenta-se como uma solução injetável de cor amarelo pardacento a amarelo, ligeiramente opalescente a transparente, em uma caneta precarregada.
ANDEMBRY apresenta-se em envases individuais que contêm uma caneta precarregada de 1,2 ml e em envases múltiplos de 3 estuches, cada um dos quais contém 1 caneta precarregada.
Pode ser que apenas alguns tamanhos de envase sejam comercializados.
Título de autorização de comercialização e responsável pela fabricação
CSL Behring GmbH
Emil-von-Behring-Strasse 76
D-35041 Marburgo
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica CSL Behring NV Tel: +32 15 28 89 20 | Lituânia CentralPharma Communications UAB Tel: +370 5 243 0444 |
| Luxemburgo CSL Behring NV Tel: +32 15 28 89 20 |
República Checa CSL Behring s.r.o. Tel: +420 702 137 233 | Hungria CSL Behring Kft. Tel: +36 1 213 4290 |
Dinamarca CSL Behring AB Tlf: +46 8 544 966 70 | Malta AM Mangion Ltd. Tel: +356 2397 6333 |
Alemanha CSL Behring GmbH Tel: +49 6190 75 84810 | Países Baixos CSL Behring BV Tel: +31 85 111 96 00 |
Estônia CentralPharma Communications OÜ Tel: +3726015540 | Noruega CSL Behring AB Tlf: +46 8 544 966 70 |
Grécia CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Áustria CSL Behring GmbH Tel: +43 1 80101 1040 |
Espanha CSL Behring S. A. Tel: +34 933 67 1870 | Polônia CSL Behring Sp. z o.o. Tel.: +48 22 213 22 65 |
França CSL Behring SA Tél: +33 1 53 58 54 00 | Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
Croácia Marti Farm d.o.o. Tel: +385 1 5588297 | Romênia Prisum Healthcare S.R.L. Tel: +40 21 322 01 71 |
Irlanda CSL Behring GmbH Tel: +49 69 305 17254 | Eslovênia EMMES BIOPHARMA GLOBAL s.r.o. - podružnica v Sloveniji Tel: +386 41 42 0002 |
Islândia CSL Behring AB Sími: +46 8 544 966 70 | República Eslovaca CSL Behring Slovakia s.r.o. Tel: +421 911 653 862 |
Itália CSL Behring S.p.A. Tel: +39 02 34964 200 | Finlândia CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Chipre CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Suécia CSL Behring AB Tel: +46 8 544 966 70 |
Letônia CentralPharma Communications SIA Tel: +371 6 7450497 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu Também existem links para outros sites sobre doenças raras e medicamentos órfãos.
- Instruções de uso
ANDEMBRY solução injetável em
caneta precarregada
para uso subcutâneo
Importante:
Esta caneta precarregada funciona de maneira diferente de outros dispositivos de administração subcutânea. Leia atentamente as instruções de uso antes de usá-la e cada vez que receber uma nova caneta precarregada, pois pode haver informações atualizadas. Esta informação não substitui a consulta com seu profissional de saúde sobre sua doença ou tratamento. Em pacientes adolescentes, ANDEMBRY deve ser administrado sob a supervisão de um adulto. Certifique-se de ter recebido treinamento de seu profissional de saúde antes de usar esta caneta precarregada pela primeira vez. |
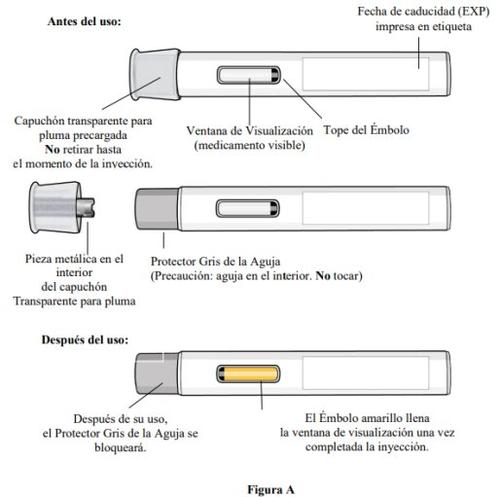
Partes da caneta (ver figura A):
Continue com as seguintes seções para preparar e realizar a injeção.
Leia a seguinte informação de segurança:
- Mantenha a caneta precarregada em sua caixa de cartão original até seu uso, para protegê-la da luz.
- Nãoretire o capuchão transparente para caneta recarregada até o momento da injeção.
- Nãovolte a colocar o capuchão transparente da caneta precarregada após retirá-lo, pois poderia iniciar a injeção e causar lesões.
- A caneta precarregada contém 1 dose e é para uso único. Nãoreutilize a mesma seringa precarregada.
- Nãouse a caneta precarregada se a data de validade tiver sido ultrapassada.
- A caneta precarregada é apenas para injeção subcutânea (sob a pele).
- Nãouse a caneta precarregada se ela parecer danificada, tiver rachaduras, perder medicamento ou tiver caído. Nesses casos, descarte a caneta precarregada como descrito no paso 11. Eliminação da caneta precarregadae use uma nova.
- Nãoadministre o medicamento através da roupa.
- Nãotoque nem tente remover o protetor gris da agulha em nenhum momento.
- Mantenha ANDEMBRY fora do alcance e da vista das crianças.
Entre em contato com o profissional de saúde que o atende se tiver alguma dúvida.
Como devo conservar ANDEMBRY?
- Conservar ANDEMBRY caneta precarregada em refrigerador, entre 2 °C e 8 °C, em sua caixa original até seu uso, para protegê-lo da luz.
- Nãocongelar. Se a caneta precarregada foi congelada, não a usemesmo se estiver descongelada.
- Retire a caneta precarregada do refrigerador 30 minutos antes de seu uso, para deixar que atinja a temperatura ambiente.
Conservação alternativa (temperatura ambiente):
- Em caso de necessidade, por exemplo, quando viajar, a caneta precarregada pode ser conservada a temperatura ambiente (até 25 °C) durante um período único de até 2 meses, mas não além da data de validade.
- Se decidir conservar a caneta precarregada a temperatura ambiente:
- No espaço fornecido na caixa de cartão, escreva a data em que retirou a caneta precarregada do refrigerador para ajudá-lo a manter um registro de quanto tempo ela foi conservada a temperatura ambiente.
- Nãovolte a refrigerar a caneta precarregada após ela ter atingido a temperatura ambiente.
- Descarte a caneta precarregada se ela foi conservada a temperatura ambiente por mais de 2 meses (ver paso 11. Eliminação da caneta precarregada).
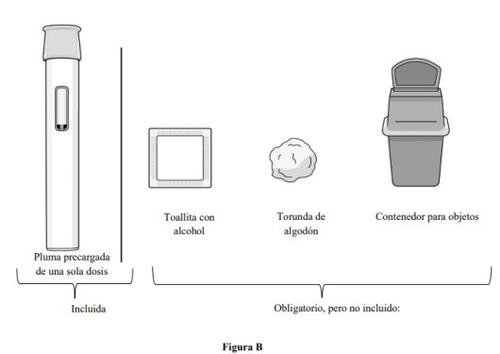
Materiais necessários para a injeção com caneta precarregada (ver figura B):
Incluído na caixa de cartão:
- 1 caneta precarregada de dose única
Materiais necessários, mas não incluídos na caixa de cartão:
- 1 compressa com álcool
- 1 torunda de algodão ou uma gaze
- 1 contêiner para objetos pontiagudos ou resistente à perfuração para sua eliminação (ver o paso 11. Eliminação da caneta precarregada).
Preparação para a administração
Não retire o capuchão transparente para caneta recarregada até justo antes da administração.
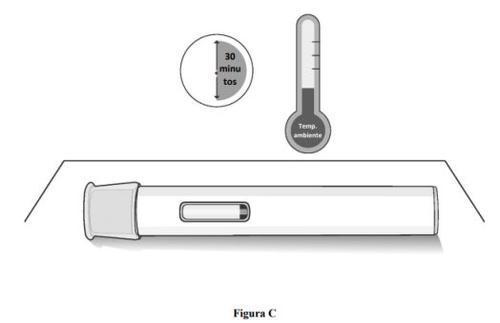
Paso 1. Deixe que a caneta precarregada atinja a temperatura ambiente.
- Retire a caneta precarregada da caixa de cartão e coloque-a sobre uma superfície plana e limpa.
- Aguarde 30 minutospara que o medicamento atinja a temperatura ambiente se ele foi conservado no refrigerador (ver figura C).
- Injectar o medicamento frio pode causar desconforto.
- Nãotente acelerar o processo de aquecimento de nenhuma forma. Por exemplo, nãoo aqueça no micro-ondas, em água quente ou o deixe exposto à luz solar direta.
Paso 2. Verifique a data de validade
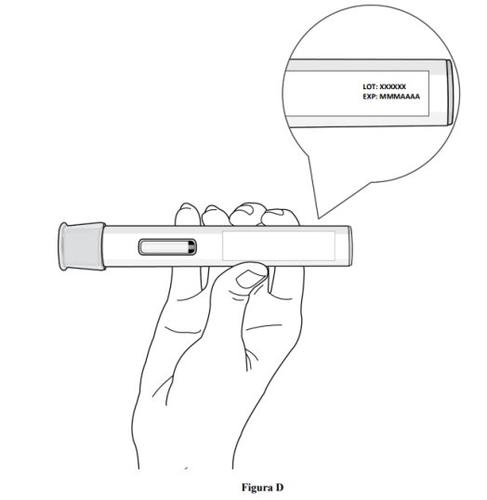
- Verifique a data de validade que figura na etiqueta da caneta precarregada (ver figura D).
- Não usea caneta precarregada se a data de validade tiver sido ultrapassada.
- Não usea caneta precarregada se ela foi conservada a temperatura ambiente por mais de 2 meses.
- Se a data de validade tiver sido ultrapassada ou se a caneta precarregada foi conservada a temperatura ambiente por mais de 2 meses, descarte a caneta precarregada de forma segura e obtenha uma nova (ver paso 11. Eliminação da caneta precarregada).
Paso 3. Inspeccione a caneta precarregada e o medicamento
- Verifiqueque a caneta precarregada não esteja danificada.
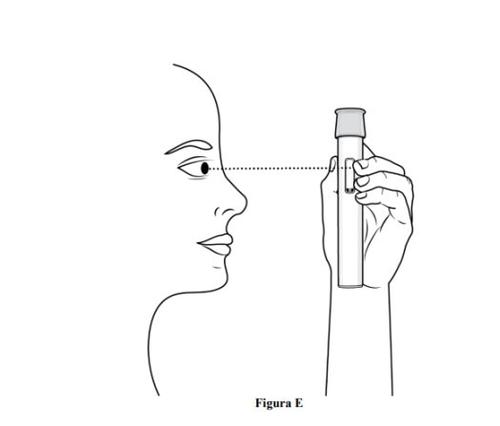
- Inspeccioneo medicamento através da janela de visualização da caneta precarregada (ver figura E).
- É normal ver bolhas de ar, nãotente eliminá-las.
- O medicamento deve ser de cor amarelo pardacento a amarelo e pode parecer ligeiramente opalescente a transparente.
- Não usea caneta precarregada, descarte-a de forma segura e obtenha uma nova (ver paso 11. Eliminação da caneta precarregada) se:
- O medicamento está descolorido ou contém partículas.
- A caneta precarregada parece danificada ou apresenta rachaduras.
- A caneta precarregada apresenta vazamentos.
- A caneta precarregada caiu sobre uma superfície dura, mesmo que não pareça danificada.
Escolha e prepare um local de injeção
Paso 4. Lave as mãos.
- Lave as mãos com água e sabão ou use uma solução desinfetante (ver figura F).
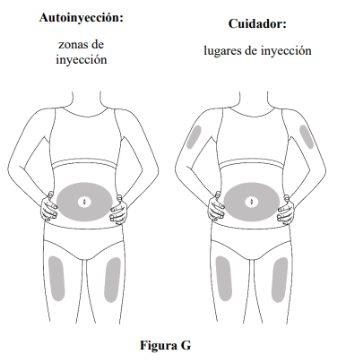
Paso 5. Selecione o local da administração SC
- Injecte no quadril ou no abdômen, mas mantenha-se a 2 cm do umbigo (ver figura G).
- Se outra pessoa (cuidador) lhe administrar a injeção, também pode usar a parte superior do braço. Nãotente se injectar você mesmo na parte superior do braço.
- Alterne (ou seja, gire) o local com cada injeção. Não injectena mesma zona várias vezes se a pele estiver danificada.
- Nãoinjecte no umbigo, sardas, cicatrizes ou hematomas, ou em áreas onde a pele esteja sensível, vermelha, dura ou lesionada.
Paso 6. Preparação do local de injeção
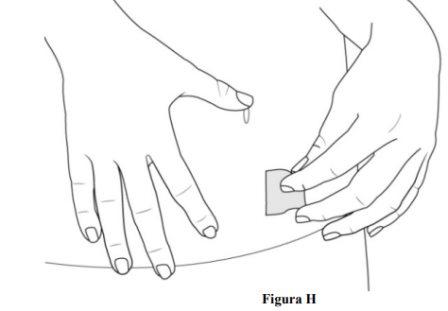
- Limpe o local de injeção com uma compressa com álcool (ver figura H).
- Deixe a pele secar ao ar.
- Nãotoque novamente esta zona antes da administração.
- Nãoabane nem sopre sobre a área da pele que você limpou.
Injeção do medicamento com a caneta precarregada
Complete a injeção sem pausas. Leia todos os passos antes de começar. Nãoretire o capuchão transparente até o momento da injeção. |
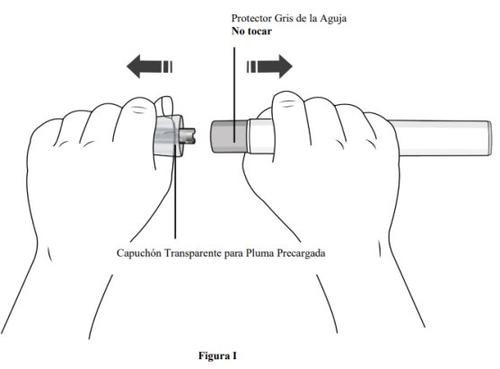
Paso 7. Retire o capuchão transparente da caneta precarregada e descarte-o
- Segure a caneta precarregada com uma mão e retireo capuchão transparente da caneta precarregada puxando-o com a outra mão.
- Nãogire o capuchão transparente (ver figura I). Se não puder remover o capuchão transparente, peça ajuda a um médico ou entre em contato com seu profissional de saúde.
- O capuchão transparente tem uma parte metálica em seu interior, isso é normal.
- Nãovolte a colocar o capuchão transparente após retirá-lo, pois poderia iniciar a injeção e causar lesões.
- Descarte o capuchão da agulha em um contêiner para objetos pontiagudos ou resistente à perfuração.
Importante:
|
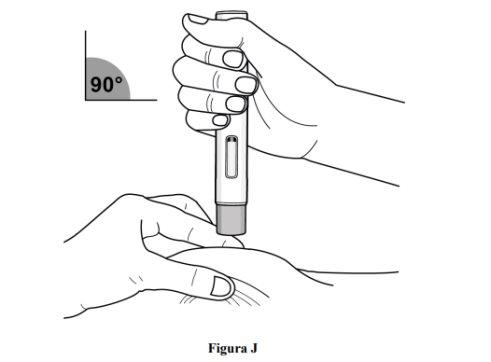
Paso 8. Puxe a pele e coloque a caneta precarregada no local de injeção
Imediatamente após retirar o capuchão transparente da caneta recarregada, complete os seguintes passos sem parar:
- Puxe suavemente a zona de pele limpa ao redor do local de injeção e segure a zona firmemente até que a injeção seja concluída (ver figura J).
- Coloque a caneta precarregada em um ângulo de 90° sobre o local de injeção limpo (ver figura J).
- Certifique-se de poder ver a janela de visualização.
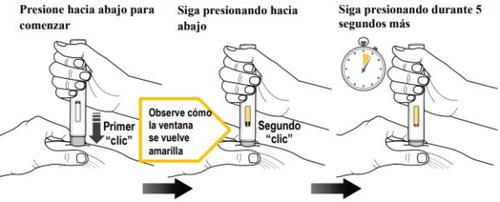
Paso 9. Injeção do Medicamento(ver figura K)
| Deve ler todo o conteúdo do passo 9 antes da administração. A injeção pode levar até 15 segundos. Para se certificar de receber uma dose completa, deve manter a caneta precarregada firmemente pressionada contra a pele puxada até que:
e
|
Pressione o protetor gris da agulha firmemente contra a pele puxada para iniciar a administração e continue pressionando até concluir todos os passos seguintes. | ||
| ||
Pressione para baixo para iniciara injeção e aguarde para ouvir um primeiro “clic”. | Mantenha pressionadaa caneta precarregada para baixo e observe a janela de visualização. | Mantenha pressionadaa caneta precarregada para baixodurante 5 segundos mais para garantir a dose completa. |
|
amarela e
| |
Continue pressionandoa caneta precarregada para baixo. | Continue pressionandoa caneta precarregada para baixo. |
Figura K
- Nãoretire a caneta precarregada até que o êmbolo amarelo pare de se mover e preencha completamente a janela de visualização, e sejam passados 5 segundos após o segundo “clic”.
- Não retire, incline nem gire a caneta precarregada durante a injeção.
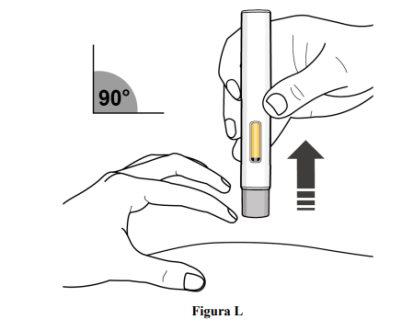
Paso 10. Pare de puxar e retire a caneta precarregada
- Pare de puxar a pele e retire a caneta precarregada da pele com um ângulo de 90º (ver figura L).
- À medida que a caneta precarregada se levanta da pele, o protetor gris da agulha voltará à posição original (antes do uso) e se bloqueará em sua posição para cobrir a agulha.
Importante: Se acredita que não recebeu a dose completa, entre em contato imediatamente com seu prestador de assistência à saúde.
- Se houver um pouco de sangramento no local de injeção, pode pressionar com uma torunda de algodão ou uma gaze sobre a zona da injeção.
- Nãoesfregue a área da injeção.
- lugar de injeção.
- Se necessário, pode cobrir o local de administração com um pequeno penso adesivo.
Resíduos
Paso 11. Eliminação da pluma pré-carregada
- Nãoreutilize a seringa pré-carregada.
- Depois de administrar a dose, coloque a pluma pré-carregada em um recipiente para objetos perfurantes ou em um recipiente resistente a perfurações fechado (ver figura M).
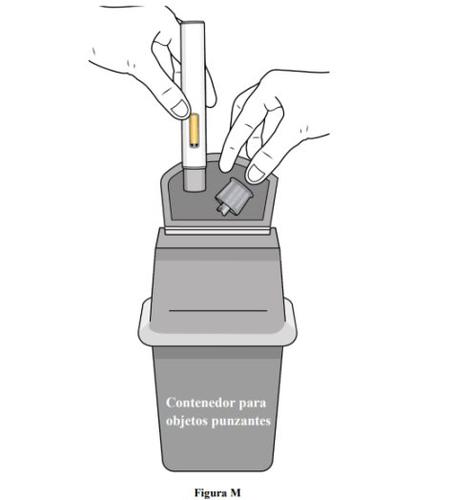

- Se não tiver um recipiente para objetos perfurantes ou um recipiente fechado resistente a perfurações, pode utilizar um recipiente doméstico que seja:
- Fabricado em plástico resistente.
- Pode ser fechado com uma tampa hermética e resistente a perfurações, sem que as partes afiadas possam sair.
- Estável em posição vertical durante o uso
- Resistente a vazamentos
- Devidamente etiquetado para advertir sobre resíduos perigosos dentro do recipiente
- Quando o seu recipiente de objetos perfurantes estiver quase cheio, deverá seguir as diretrizes locais para saber qual é a forma correta de eliminá-lo. Pergunte ao seu farmacêutico ou profissional de saúde para obter mais informações sobre como eliminar o seu recipiente de objetos perfurantes.
- Nãoelimine o recipiente de objetos perfurantes usado com a lixo doméstico a menos que as diretrizes locais o permitam.
- Nãorecicle o seu recipiente de objetos perfurantes usado.
Paso 12. Acompanhamento do tratamento
- Se o seu médico o requerer, registre a administração em um diário para ajudar a realizar um acompanhamento do seu medicamento.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDAForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 2000 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 3000 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médica
Médicos online para ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ANDEMBRY 200 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA – sujeita a avaliação médica e regras locais.