
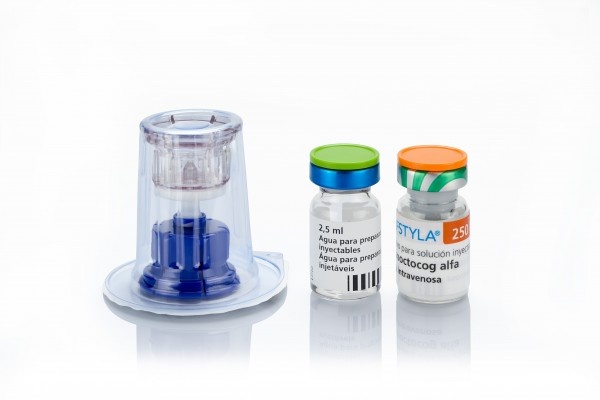
AFSTYLA 3.000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como usar AFSTYLA 3.000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
AFSTYLA 250 UI, pó e dissolvente para solução injectável
AFSTYLA 500 UI, pó e dissolvente para solução injectável
AFSTYLA 1.000 UI, pó e dissolvente para solução injectável
AFSTYLA 1.500 UI, pó e dissolvente para solução injectável
AFSTYLA 2.000 UI, pó e dissolvente para solução injectável
AFSTYLA 2.500 UI, pó e dissolvente para solução injectável
AFSTYLA 3.000 UI, pó e dissolvente para solução injectável
lonoctocog alfa (factor VIII de coagulação recombinante de cadeia única)
Leia todo o prospecto atentamente antes de si ou seu filho começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas a si ou ao seu filho, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é AFSTYLA e para que é utilizado
- O que necessita de saber antes de si ou seu filho começar a usar AFSTYLA
- Como usar AFSTYLA
- Possíveis efeitos adversos
- Conservação de AFSTYLA
- Conteúdo do envase e informação adicional
1. O que é AFSTYLA e para que é utilizado
AFSTYLA é um produto com factor VIII de coagulação humano que se produz mediante tecnologia de ADN recombinante. O princípio ativo de AFSTYLA é lonoctocog alfa.
AFSTYLA é utilizado para tratar e prevenir os episódios hemorrágicos em doentes com hemofilia A (deficiência congénita do factor VIII). O factor VIII é uma proteína necessária para a coagulação sanguínea. Os doentes com hemofilia A carecem desta proteína, pelo que o sangue não coagula tão rapidamente como deveria e há uma maior tendência para sangrar. AFSTYLA actua substituindo o factor VIII ausente nos doentes com hemofilia A, tornando possível a coagulação normal do sangue.
AFSTYLA pode ser utilizado em todos os grupos etários.
2. O que necessita de saber antes de começar a usar AFSTYLA
Não use AFSTYLA
- Se o doente de Afstyla experimentou uma reação alérgica potencialmente mortal a AFSTYLA ou a algum dos seus componentes (incluídos na secção 6).
- Se o doente de Afstyla é alérgico a proteínas de hámster.
Advertências e precauções
Rastreabilidade
É importante manter um registo do número do lote de AFSTYLA.
Por conseguinte, cada vez que usar um novo pacote de AFSTYLA, anote a data e o número do lote (que está na caixa após “Lote”) e guarde esta informação num local seguro.
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar AFSTYLA.
- É possível que ocorram reações alérgicas (hipersensibilidade). O produto contém resíduos de proteínas de hámster (ver também "Não use AFSTYLA"). Se manifestarem sintomas de alergia, interrompa o tratamento imediatamente e contacte o seu médico.O seu médico deve informá-lo sobre os primeiros sinais das reações de alergia. Estes incluem urticárias, erupção cutânea generalizada, pressão no peito, dificuldade para respirar, queda da pressão arterial e anafilaxia (uma reação alérgica grave que causa dificuldades respiratórias graves e tonturas).
- A formação de inibidores(anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos compostos por factor VIII. Estes inibidores, especialmente em grandes quantidades, impedem que o tratamento funcione corretamente. O senhor ou seu filho serão supervisionados cuidadosamente para verificar se desenvolvem inibidores. Se a hemorragia ou a de seu filho não estiver a ser controlada com AFSTYLA, consulte o seu médico imediatamente.
- Se lhe disseram que o senhor ou seu filho sofrem de uma doença cardíaca ou tem risco de sofrer dela, informe o seu médico ou farmacêutico.
- Se for utilizado um dispositivo de acesso venoso central (DAVC) para a injeção de AFSTYLA, o seu médico deve considerar e comentar o risco de complicações, como infecções locais, bactérias no sangue (bacteriemia) e a formação de coágulos (trombose) nos vasos sanguíneos no local de inserção.
Outros medicamentos e AFSTYLA
Informa o seu médico ou farmacêutico se está a usar, usou recentemente ou pode ter que usar qualquer outro medicamento.
Gravidez e amamentação
- Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de usar este medicamento.
- Durante a gravidez e o período de amamentação, AFSTYLA só deve ser administrado se for claramente necessário.
Condução e uso de máquinas
AFSTYLA não afeta a sua capacidade para conduzir ou usar máquinas.
AFSTYLA contém sódio
Este medicamento contém 35 mg de sódio (componente principal do sal de cozinha) em cada frasco. Isto equivale a 1,8% da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar AFSTYLA
O seu tratamento deve ser supervisionado por um médico com experiência no tratamento de distúrbios de coagulação do sangue.
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
Dose
A quantidade de AFSTYLA que o senhor ou seu filho necessitam e a duração do tratamento dependem:
- da gravidade da sua doença
- do local e da intensidade da hemorragia
- do seu estado clínico e sua resposta clínica
- do seu peso corporal
Siga as instruções indicadas pelo seu médico.
Reconstituição e administração
Instruções gerais
- O pó deve ser misturado com o dissolvente (líquido) e extraído do frasco em condições assépticas.
- AFSTYLA não deve ser misturado com outros medicamentos ou dissolventes, excepto os mencionados na secção 6.
- A solução deve ser transparente ou ligeiramente opalescente, entre amarela e incolor, isto é, pode brilhar quando exposta à luz, mas não deve conter qualquer partícula visível. Depois de filtrar ou extrair a solução (ver mais adiante), deve ser revista antes do uso. Não use a solução se estiver visivelmente turva ou se contiver flóculos ou partículas.
- A eliminação do produto não utilizado e de todos os materiais residuais será realizada de acordo com a regulamentação local e as instruções do seu médico.
Reconstituição e administração
Sem abrir nenhum dos frascos, certifique-se de que o pó de AFSTYLA e o líquido estão à temperatura ambiente ou corporal. Isto pode ser feito deixando os frascos à temperatura ambiente durante uma hora aproximadamente ou segurando-os com as mãos durante alguns minutos. Não exponha os frascos ao calor directo. Os frascos não devem ser aquecidos acima da temperatura corporal (37 ºC).
Retire com cuidado as cápsulas protectoras dos frascos e, a seguir, limpe a parte exposta dos tampões de borracha com uma toalhita impregnada de álcool. Deixe secar os frascos antes de abrir o envase do Mix2Vial (que contém o trasvasador com filtro) e, a seguir, siga as instruções que se indicam a seguir.
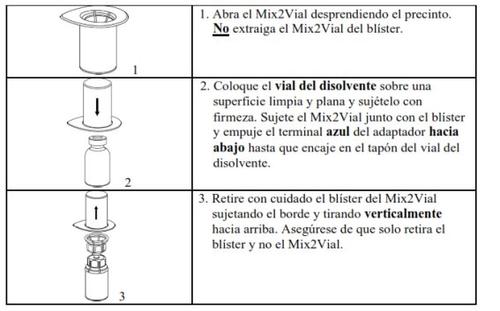

Use o kit de venopunção fornecido com o produto e insira a agulha numa veia. Deixe que o sangue flua até ao fim do tubo. Ligue a seringa ao extremo de bloqueio rosqueado do kit de venopunção. Injecte lentamente a solução reconstituída (a uma velocidade que lhe resulte confortável, até um máximo de 10 ml/min) na veiade acordo com as instruções que lhe deu o seu médico. Tente que não entre sangue na seringa que contém o produto.
Verifique se experimenta efeitos adversos logo após a injeção. Se experimentar algum efeito adverso que possa estar relacionado com a administração de AFSTYLA, a injeção deve ser interrompida (ver também a secção 2).
Uso em crianças e adolescentes
AFSTYLA pode ser utilizado em crianças e adolescentes de todas as idades. No caso das crianças menores de 12 anos, pode ser necessário doses mais altas ou injeções mais frequentes. Em crianças maiores de 12 anos, pode ser utilizada a mesma dose que em adultos.
Se usar mais AFSTYLA do que deve
Se foi injectada mais AFSTYLA do que deve, informe disso ao seu médico.
Se esquecer de usar AFSTYLA
Não administre uma dose dupla para compensar a dose esquecida. Administre imediatamente a próxima dose e siga as instruções do seu médico.
Se interromper o tratamento com AFSTYLA
Se interromper o uso de AFSTYLA, pode deixar de estar protegido contra o sangramento ou pode não deixar de sangrar se sofre de um sangramento actualmente. Não deixe de usar AFSTYLA sem consultar antes o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, AFSTYLA pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Deixe de usar imediatamente o medicamento e contacte o seu médico:
- se notar sintomas de reações alérgicas
- É possível que ocorram reações alérgicas que incluem os sintomas seguintes: urticárias, erupção cutânea generalizada (erupção com picazón), pressão no peito, sibilância, pressão sanguínea baixa e anafilaxia (reação grave que causa dificuldades respiratórias graves e tonturas). Se isto acontecer, deve interromper o medicamento imediatamente e contactar o seu médico.
- se notar que o medicamento deixou de funcionar corretamente(sangramento não cessa) Para as crianças que não foram tratadas previamente com medicamentos do factor VIII, os anticorpos inibidores (ver secção 2) podem formar-se com muita frequência (mais de 1 em cada 10 doentes); no entanto, em doentes que receberam tratamento previo com factor VIII (mais de 150 dias de tratamento) o risco é pouco comum (menos de 1 em cada 100 doentes). Se o senhor ou seu filho desenvolveram um inibidor devido ao medicamento, podem experimentar um sangramento persistente. Se isto acontecer, deve comunicar-se imediatamente com o seu médico.
Efeitos adversos frequentes (podem afectar até 1 em cada 10 pessoas)
- Formigueiro ou entorpecimento (parestesia).
- Erupção cutânea.
- Febre.
Efeitos adversos pouco frequentes (podem afectar até 1 em cada 100 pessoas)
- Prurido.
- Enrubescimento da pele.
- Dor na zona de injeção.
- Arrepios.
- Sensação de calor.
Efeitos adversos em crianças e adolescentes
Não se observaram diferenças específicas de idade nas reações adversas entre as crianças, os adolescentes e os adultos.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de AFSTYLA
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não use este medicamento após a data de validade que aparece na etiqueta e na caixa.
- Conservar na geladeira (entre 2 °C e 8 °C).
- Antes de reconstituir o pó de AFSTYLA, pode ser conservado à temperatura ambiente (por debaixo dos 25 °C) durante um período único não superior a 3 meses, dentro da data de validade impressa nas caixas e nos frascos. Anote a data em que começar a conservar AFSTYLA à temperatura ambiente na caixa do medicamento.
- Uma vez que o medicamento seja retirado da geladeira, não deve ser devolvido à mesma.
- Não congelar.
- Conservar o frasco dentro da sua caixa para protegê-lo da luz.
- Uma vez reconstituído o medicamento, deve ser utilizado preferentemente de imediato.
- Se o produto reconstituído não for administrado imediatamente, os tempos e as condições de conservação antes do uso são da responsabilidade do utilizador.
6. Conteúdo do envase e informação adicional
Composição de AFSTYLA
O princípio ativo é:
250 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 100 UI/ml de lonoctocog alfa.
500 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 200 UI/ml de lonoctocog alfa.
1.000 UI por frasco; após a reconstituição com 2,5 ml de água para preparações injetáveis, a solução contém 400 UI/ml de lonoctocog alfa.
1.500 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 300 UI/ml de lonoctocog alfa.
2.000 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 400 UI/ml de lonoctocog alfa.
2.500 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 500 UI/ml de lonoctocog alfa.
3.000 UI por frasco; após a reconstituição com 5 ml de água para preparações injetáveis, a solução contém 600 UI/ml de lonoctocog alfa.
Os outros componentes são:
L-histidina, polissorbato 80, cloreto de cálcio dihidratado, cloreto de sódio (ver último item da seção 2), sacarose.
Veículo: água para preparações injetáveis.
Aspecto de AFSTYLA e conteúdo do envase
AFSTYLA é apresentado sob a forma de pó ou massa friável de cor branca ou ligeiramente amarelada e veículo para solução injetável transparente e incolor.
A solução reconstituída deve ser transparente ou ligeiramente opalescente, entre amarela e incolor, ou seja, pode brilhar quando exposta à luz, mas não deve conter nenhuma partícula visível.
Apresentações
Um envase com 250, 500 ou 1.000 UI que contém:
1 frasco com pó
1 frasco com 2,5 ml de água para preparações injetáveis
1 transferidor com filtro 20/20
Uma caixa interior que contém:
1 seringa de 5 ml descartável
1 equipo de venopunção
2 compressas impregnadas de álcool
1 curativo não estéril
Um envase com 1.500, 2.000, 2.500 ou 3.000 UI que contém:
1 frasco com pó
1 frasco com 5 ml de água para preparações injetáveis
1 transferidor com filtro 20/20
Uma caixa interior que contém:
1 seringa de 10 ml descartável
1 equipo de venopunção
2 compressas impregnadas de álcool
1 curativo não estéril
Pode ser que apenas alguns tamanhos de envase sejam comercializados.
Acondicionamentos primários
250 UI | Frasco de vidro com tampa de borracha, disco laranja de plástico e cápsula de alumínio verde listrado |
500 UI | Frasco de vidro com tampa de borracha, disco azul de plástico e cápsula de alumínio verde listrado |
1.000 UI | Frasco de vidro com tampa de borracha, disco verde de plástico e cápsula de alumínio verde listrado |
1.500 UI | Frasco de vidro com tampa de borracha, disco turquesa de plástico e cápsula de alumínio verde listrado |
2.000 UI | Frasco de vidro com tampa de borracha, disco roxo de plástico e cápsula de alumínio verde listrado |
2.500 UI | Frasco de vidro com tampa de borracha, disco cinza claro de plástico e cápsula de alumínio verde listrado |
3.000 UI | Frasco de vidro com tampa de borracha, disco amarelo de plástico e cápsula de alumínio verde listrado |
Título da autorização de comercialização e responsável pela fabricação
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica CSL Behring NV Tel: +32 15 28 89 20 | Lituânia CentralPharma Communications UAB Tel: +370 5 243 0444 |
| Luxemburgo CSL Behring NV Tel: +32 15 28 89 20 |
República Tcheca CSL Behring s.r.o. Tel: + 420 702 137 233 | Hungria CSL Behring Kft. Tel.: +36 1 213 4290 |
Dinamarca CSL Behring AB Tlf: +46 8 544 966 70 | Malta AM Mangion Ltd. Tel: +356 2397 6333 |
Alemanha CSL Behring GmbH Tel: +49 6190 75 84810 | Países Baixos CSL Behring BV Tel: + 31 85 111 96 00 |
Estônia CentralPharma Communications OÜ Tel: +3726015540 | Noruega CSL Behring AB Tlf: +46 8 544 966 70 |
Grécia CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Áustria CSL Behring GmbH Tel: +43 1 80101 1040 |
Espanha CSL Behring S.A. Tel: +34 933 67 1870 | Polônia CSL Behring Sp.z o.o. Tel: +48 22 213 22 65 |
França CSL Behring S.A. Tél: + 33 –(0)-1 53 58 54 00 | Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
Croácia Marti Farm d.o.o. Tel: +385 1 5588297 | Romênia Prisum Healthcare S.R.L. Tel: +40 21 322 0171 |
Irlanda CSL Behring GmbH Tel: +49 6190 75 84700 Islândia CSL Behring AB Sími: +46 8 544 966 70 | Eslovênia Emmes Biopharma Global s.r.o. podružnica v Sloveniji Tel:+ 386 41 42 0002 República Eslovaca CSL Behring Slovakia s.r.o. Tel: +421 911 653 862 |
Itália CSL Behring S.p.A. Tel: +39 02 34964 200 | Finlândia CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Chipre CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Suécia CSL Behring AB Tel: +46 8 544 966 70 |
Letônia CentralPharma Communications SIA Tel: +371 6 7450497 | |
Data da última revisão deste prospecto: {MM/AAAA}
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
----------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
Monitorização do tratamento
Durante o tratamento, recomenda-se controlar adequadamente os níveis de fator VIII para determinar a dose que deve ser administrada e a frequência das injeções. As respostas dos pacientes ao fator VIII podem variar, o que demonstra que possuem diferentes meias-vidas e recuperações. Pode ser que a dose baseada no peso corporal precise ser ajustada em pacientes com peso insuficiente ou excesso de peso. No caso especial de intervenções cirúrgicas maiores, é indispensável controlar com precisão a terapia de substituição mediante análise da coagulação (atividade do fator VIII plasmático).
Ao utilizar um ensaio de coagulação de uma etapa baseado no tempo de tromboplastina parcial ativada (TTPa) in vitropara determinar a atividade do fator VIII nas amostras de sangue dos pacientes, os resultados da atividade do fator VIII plasmático podem ser significativamente afetados tanto pelo tipo de reagente de TTPa quanto pelo padrão de referência utilizado no ensaio. Também podem ocorrer discrepâncias significativas entre os resultados obtidos no ensaio de coagulação de uma etapa baseado no TTPa e os obtidos no ensaio cromogênico de acordo com a Farmacopeia Europeia. Isso é especialmente importante quando se muda o laboratório ou os reagentes utilizados no ensaio.
A atividade do fator VIII plasmático nos pacientes que recebem AFSTYLA com um ensaio cromogênico ou um ensaio de coagulação de uma etapa deve ser controlada para orientar a dose administrada e a frequência das injeções repetidas. O resultado do ensaio cromogênico reflete com mais precisão o potencial hemostático clínico de AFSTYLA, por isso é o método preferido. O resultado do ensaio de coagulação de uma etapa subestima o nível de atividade do fator VIII em comparação com o resultado do ensaio cromogênico em aproximadamente 45%. Se for utilizado um ensaio de coagulação de uma etapa, o resultado deve ser multiplicado por um fator de conversão de 2 para determinar o nível de atividade do fator VIII do paciente.
Posologia
A dose e a duração da terapia de substituição dependem da gravidade da deficiência de fator VIII, da localização e extensão da hemorragia e do estado clínico do paciente.
O número de unidades de fator VIII administradas é expresso em Unidades Internacionais (UI), que correspondem ao padrão concentrado atual da OMS para medicamentos com fator VIII. A atividade do fator VIII no plasma é expressa como um percentual (em relação ao plasma humano normal) ou, preferencialmente, em Unidades Internacionais (em relação a um padrão internacional para o fator VIII no plasma).
Uma Unidade Internacional (UI) de atividade do fator VIII equivale à quantidade de fator VIII presente em 1 ml de plasma humano normal.
A atribuição de potência é determinada por um ensaio de substratos cromogênicos.
Os níveis plasmáticos de fator VIII podem ser monitorizados por um ensaio de substratos cromogênicos ou um ensaio de coagulação de uma etapa.
Tratamento a demanda
O cálculo da dose necessária de fator VIII baseia-se no achado empírico de que 1 Unidade Internacional (UI) de fator VIII por kg de peso corporal aumenta a atividade plasmática do fator VIII em 2 UI/dl.
A dose requerida é determinada usando a fórmula seguinte: Dose (UI) = peso corporal (kg) x aumento desejado do fator VIII (UI/dl ou % do nível normal) x 0,5 (UI/kg por UI/dl)
A dose e a frequência de administração devem ser sempre estabelecidas com base na eficácia clínica observada em cada caso.
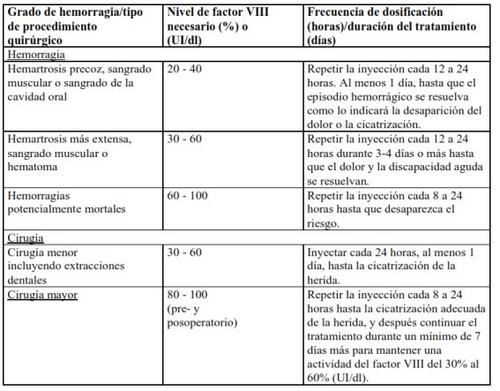
No caso dos eventos hemorrágicos seguintes, a atividade do fator VIII não deve ser inferior ao nível de atividade plasmática estabelecido (em % do nível normal ou UI/dl) durante o período correspondente. A tabela seguinte pode ser usada como guia posológica em episódios hemorrágicos e cirurgia:
Tratamento profilático
A pauta de tratamento inicial recomendada é de 20 a 50 UI/kg de AFSTYLA administradas 2 ou 3 vezes por semana. A pauta pode ser ajustada com base na resposta do paciente.
População pediátrica
A pauta de tratamento inicial recomendada em crianças (de 0 a < 12 anos de idade) é de 30 a 50 UI por kg de AFSTYLA administradas 2 ou 3 vezes por semana. Pode ser que em crianças < 12 anos sejam necessárias doses mais frequentes ou mais altas devido ao maior clearance que ocorre nesse grupo etário.
Nos adolescentes com 12 anos ou mais de idade, as doses recomendadas são as mesmas que para os adultos.
População de idade avançada
Nos estudos clínicos de AFSTYLA, não foram incluídos sujeitos maiores de 65 anos de idade
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ComposiçãoCLORURO DE SODIO (16,4 mg mg), SACAROSA (6 mg mg)
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a AFSTYLA 3.000 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1000 UI - após reconstituição em 2 ml de água para injetáveis, a dose é de 500 UI/mlSubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica





