ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
ADZYNMA 500UI pó e dissolvente para solução injectável
ADZYNMA 1500UI pó e dissolvente para solução injectável
rADAMTS13
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter.
A parte final da secção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que o reler.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- 1. O que é ADZYNMA e para que é utilizado
- O que precisa saber antes de começar a usar ADZYNMA
- Como usar ADZYNMA
- Posíveis efeitos adversos
- Conservação de ADZYNMA
- Conteúdo do envase e informação adicional
- Instruções de uso
1. O que é ADZYNMA e para que é utilizado
ADZYNMA contém o princípio ativo rADAMTS13, uma cópia sintética da enzima (proteína) natural ADAMTS13. As pessoas com púrpura trombocitopénica trombótica congénita (PTTc) carecem desta enzima.
A PTT congénita é um distúrbio hematológico hereditário muito raro que provoca a formação de coágulos de sangue nos vasos sanguíneos pequenos. Estes coágulos podem bloquear o fluxo de sangue e de oxigénio para os órgãos, e isso deriva num número de plaquetas (componentes do sangue que contribuem para a sua coagulação) inferior ao normal no sangue.
A PTT congénita é causada por uma carência da enzima ADAMTS13 no sangue. A ADAMTS13 contribui para evitar a formação de coágulos de sangue descompondo moléculas de grande tamanho chamadas fator von Willebrand (VWF). Quando as moléculas de VWF são demasiado grandes, podem provocar coágulos de sangue perigosos. ADZYNMA é utilizado para repor os níveis de ADAMTS13, o que ajuda com a descomposição destas moléculas de grande tamanho em moléculas mais pequenas. Isso reduz a probabilidade de que se formem coágulos de sangue e pode evitar que os níveis de plaquetas das pessoas com PTTc sejam baixos.
2. O que precisa saber antes de começar a usar ADZYNMA
Não use ADZYNMA
- Se teve reações alérgicas graves ou potencialmente mortais à Radamts13 ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar ADZYNMA.
Reações alérgicas
Existe o risco de experimentar uma reação de hipersensibilidade de tipo alérgico com ADZYNMA. O seu médico deve informá-lo sobre os sinais imediatos das reações alérgicas graves, como:
- frequência cardíaca rápida
- opressão no peito
- sibilancias e/ou aparecimento repentino de dificuldade para respirar
- pressão arterial baixa
- urticária, erupção cutânea e picazão na pele
- coriza ou congestão nasal
- olhos vermelhos
- espirros
- inchaço rápido abaixo da pele em zonas como face, garganta, braços e pernas
- cansaço
- náuseas (sensação de estar doente)
- vómitos
- sensação de formigamento, dormência, cãibras
- inquietude
- anafilaxia (reação alérgica grave que pode provocar dificuldade para engolir e/ou respirar e vermelhidão ou inchaço da face e/ou das mãos).
Se tiver algum desses sintomas, o seu médico decidirá se o tratamento com ADZYNMA deve ser interrompido e lhe oferecerá os medicamentos necessários para tratar a reação alérgica. Os sintomas graves, incluindo dificuldade respiratória e tonturas, requerem tratamento urgente.
Inibidores
Podem desenvolver-se anticorpos neutralizantes (chamados inibidores) em alguns pacientes que recebem ADZYNMA. Estes inibidores poderiam potencialmente provocar que o tratamento deixe de funcionar corretamente. Avise o seu médico se acredita que o medicamento não está a fazer efeito.
Outros medicamentos e ADZYNMA
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Não deve receber ADZYNMA durante a gravidez a menos que o seu médico o recomende especificamente. Si e o seu médico devem decidir se pode utilizar ADZYNMA durante a amamentação.
Condução e uso de máquinas
A influência deste medicamento sobre a capacidade para conduzir e utilizar máquinas pode ser pequena. Após o uso de ADZYNMA podem produzir-se tonturas e sonolência.
Manter um registo
Com o objectivo de melhorar a rastreabilidade dos medicamentos biológicos, o nome e o número do lote do medicamento devem estar claramente registados.
ADZYNMA contém sódio
Este medicamento contém menos de 23 mg de sódio (1 mmol) por frasco; isto é, é essencialmente "isento de sódio".
ADZYNMA contém polissorbato 80
Este medicamento contém 2,7 mg de polissorbato 80 em cada frasco de ADZYNMA 500 UI ou 1.500 UI, equivalente até 0,216 mg/kg. Os polissorbatos podem provocar reações alérgicas. Informe o seu médico se tiver alguma alergia conhecida.
3. Como usar ADZYNMA
O tratamento com ADZYNMA será administrado sob a supervisão de um médico com experiência no tratamento de pacientes com distúrbios do sangue.
ADZYNMA é administrado por injeção intravenosa (numa veia). É fornecido ao seu médico como um pó que se dissolve (reconstitui) com o dissolvente (um líquido no qual pode dissolver o pó) fornecido antes da sua administração.
A dose é calculada com base no seu peso corporal.
Administração do medicamento em casa
O seu médico pode considerar o uso de ADZYNMA em sua casa se tolerar bem as injeções. Quando for capaz de injetar ADZYNMA (ou se o puder administrar um cuidador) após receber a formação pertinente por parte do médico ou enfermeiro responsável pelo tratamento, o seu médico seguirá a supervisionar a sua resposta ao tratamento. Se notar algum efeito adverso ao utilizar o medicamento em sua casa, interrompa imediatamente a injeção e procure atenção de um profissional de saúde.
Dose recomendada
Terapia de substituição enzimática preventiva
A dose habitual é de 40 UI por kg de peso corporal, administrados cada duas semanas.
O seu médico pode alterar a frequência para uma vez por semana, se a administração de ADZYNMA cada duas semanas não fizer efeito.
Terapia de substituição enzimática a pedido para episódios repentinos de PTT
Se desenvolver um episódio repentino (agudo) de púrpura trombocitopénica trombótica (PTT), a dose recomendada de ADZYNMA é a seguinte:
- 40 UI/kg de peso corporal no dia 1.
- 20 UI/kg de peso corporal no dia 2.
- 15 UI/kg de peso corporal uma vez por dia, começando no dia 3 e até dois dias após a resolução do episódio repentino de PTT.
Se usar mais ADZYNMA do que deve
Usar demasiada quantidade deste medicamento pode provocar sangramento.
Se esquecer de usar ADZYNMA
Se omitiu uma injeção de ADZYNMA, informe o seu médico o mais breve possível. Não tome uma dose dupla para compensar as doses omitidas.
Se interromper o tratamento com ADZYNMA
Se desejar interromper o tratamento com ADZYNMA, consulte o seu médico. Se interromper o tratamento, os sintomas da doença podem piorar.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode provocar efeitos adversos, embora nem todas as pessoas os sofram.
Foram notificados os seguintes efeitos adversos com ADZYNMA:
Muito frequentes(podem afetar mais de 1 em cada 10 pessoas)
- infecção nasal e de garganta
- dor de cabeça
- sensação de tontura
- enxaqueca
- diarreia
- náuseas
Frequentes(podem afetar até 1 em cada 10 pessoas)
- número elevado de plaquetas no sangue (trombocitose)
- sonolência
- prisão de ventre
- inchaço (distensão abdominal)
- fraqueza (astenia)
- sensação de calor
- actividade de ADAMTS13 anormal
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de ADZYNMA
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa após CAD. A data de validade é o último dia do mês que se indica.
Frascos sem abrir
Conservar em frigorífico (entre 2 ºC – 8 ºC).
Não congelar.
Conservar no embalagem original para protegê-lo da luz.
Os frascos de pó de ADZYNMA sem abrir podem ser armazenados a temperatura ambiente (até 30 ºC) durante um período de até 6 meses, mas sem ultrapassar a data de validade. Não volte a colocar ADZYNMA no frigorífico após a sua conservação a temperatura ambiente. Registar na caixa a data em que se extraiu ADZYNMA do frigorífico.
Após a reconstituição
Elimine o medicamento reconstituído não utilizado uma vez decorridas 3 horas.
Não utilize este medicamento se observar que não é transparente e incolor.
Os medicamentos não devem ser jogados fora pelas águas residuais ou lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de ADZYNMA
- O princípio ativo, ADAMTS13, é uma “desintegrina A e metaloproteinase com motivos de trombospondina 13” recombinante humana purificada.
O conteúdo nominal de cada frasco de pó é de 500 ou 1 500 UI de atividade rADAMTS13.
- O frasco de diluente contém 5 ml de água para preparações injetáveis.
- Os outros excipientes são cloreto de sódio, cloreto de cálcio dihidratado, L-histidina, manitol, sacarose e polissorbato 80 (E433). Ver seção 2 “ADZYNMA contém sódio” e “ADZYNMA contém polissorbato 80”.
Aspecto do produto e conteúdo do envase
ADZYNMA é fornecido como pó e diluente para solução injetável. O pó é um pó branco liofilizado. O diluente é transparente e incolor.
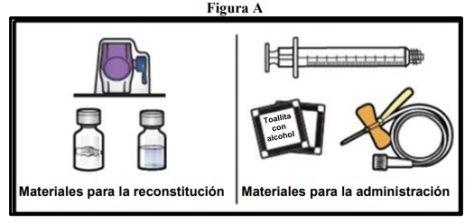
Cada envase contém um frasco de pó, um frasco de diluente, um dispositivo para a reconstituição (BAXJECT II Hi-Flow), uma seringa descartável, um equipamento de perfusão e duas toalhetas com álcool.
Título da autorização de comercialização e responsável pela fabricação
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Áustria
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Takeda Belgium NV Tel: +32 2 464 06 11 | Lituânia Takeda, UAB Tel: +370 521 09 070 |
| Luxemburgo Takeda Belgium NV Tel: +32 2 464 06 11 |
República Checa Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Hungria Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Dinamarca Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Takeda HELLAS S.A. Tel: +30 210 6387800 |
Alemanha Takeda GmbH Tel: +49 (0)800 825 3325 | Países Baixos Takeda Nederland B.V. Tel: +31 20 203 5492 |
Estônia Takeda Pharma OÜ Tel: +372 6177 669 | Noruega Takeda AS Tlf: +47 800 800 30 |
| Áustria Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
Espanha Takeda Farmacéutica España, S.A. Tel: +34 917 90 42 22 | Polônia Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
França Takeda France SAS Tel: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Croácia Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | Romênia Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Irlanda Takeda Products Ireland Ltd Tel: 1800 937 970 | Eslovênia Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca Takeda Pharmaceuticals Slovakia s.r.o. el: +421 (2) 20 602 600 |
Itália Takeda Italia S.p.A. Tel: +39 06 502601 | Finlândia Teva Finland Oy Puh/Tel: +358 20 180 5900 |
| Suécia Takeda Pharma AB Tel: 020 795 079 |
Letônia Takeda Latvia SIA Tel: +371 67840082 |
Data da última revisão deste prospecto: 08/2024.
Este medicamento foi autorizado em “circunstâncias excepcionais”. Esta modalidade de aprovação significa que, devido à rareza desta doença, não foi possível obter informações completas sobre este medicamento.
A Agência Europeia de Medicamentos revisará anualmente as novas informações sobre este medicamento que possam estar disponíveis, e este prospecto será atualizado quando necessário.
Outras fontes de informação
As informações detalhadas sobre este medicamento estão disponíveis no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu. Também existem links para outros sites sobre doenças raras e medicamentos órfãos.
- Instruções de uso
Estas instruções contêm informações sobre como reconstituir e infundir ADZYNMA.
Estas instruções de uso são destinadas a profissionais de saúde e a pacientes/cuidadores que administrem ADZYNMA em casa após receberem a formação adequada por parte de um profissional de saúde.
O tratamento com ADZYNMA deve ser prescrito e supervisionado por um profissional de saúde com experiência no tratamento de pacientes com distúrbios do sangue.
Importante:
- Apenas para injeção intravenosa após a reconstituição.
- Use uma técnica asséptica durante todo o procedimento.
- Verifique a data de validade do produto antes de usá-lo.
- Nãouse ADZYNMA se a data de validade tiver expirado.
- Se o paciente precisar de mais de um frasco de ADZYNMA por injeção, reconstitua cada frasco de acordo com as instruções detalhadas que se indicam em “Reconstituição”.
- Inspeccione a solução reconstituída de ADZYNMA para detectar se há partículas ou mudanças de cor antes da administração. A solução deve ter um aspecto transparente e incolor.
- Nãoa administre se observar partículas ou mudanças na cor.
- Se for armazenado a temperatura ambiente, use ADZYNMA antes de que transcorram 3horasdesde a reconstituição.
- Nãoadministre ADZYNMA no mesmo tubo ou recipiente e de forma simultânea com outros medicamentos para perfusão.
Reconstituição
- Prepare uma superfície limpa e plana e reúna todos os materiais necessários para a reconstituição e a administração (FiguraA).
|
- Deixe que os frascos de ADZYNMA e de diluente atinjam a temperatura ambiente antes de usá-los.
- Lave e seque as mãos cuidadosamente.
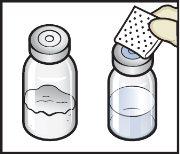
- Retire as tampas de plástico dos frascos de ADZYNMA e de diluente e coloque os frascos em uma superfície plana (FiguraB).
FiguraB
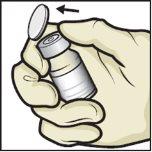
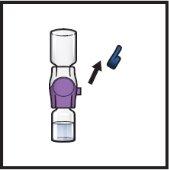
- Limpe os tampões de borracha com uma toalheta com álcool e deixe que sequem antes de usá-los (FiguraC).
FiguraC
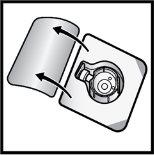
- Abrir o envase do dispositivo BAXJECT II Hi-Flow retirando a tampa, sem tocar o interior (FiguraD).
- Nãoretire o dispositivo BAXJECT II Hi-Flow do envase.
- Nãotoque a ponta de plástico transparente.
FiguraD
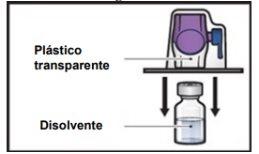
- Gire para baixo o envase com o BAXJECT II Hi-Flow no interior e coloque-o sobre a parte superior do frasco de diluente. Pressione reto para baixo até que a ponta de plástico transparenteperfure o tampão do frasco de diluente(FiguraE).
FiguraE
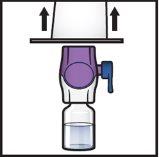
- Segure o envase do dispositivo BAXJECT II Hi-Flow pela borda e retire-o do dispositivo (FiguraF).
- Nãoretire o tampão azuldo dispositivo BAXJECT II Hi-Flow.
- Nãotoque a ponta de plástico roxaque ficou exposta.
FiguraF
- Vire o sistemapara que o frasco de diluentefique em cima. Pressione o dispositivo BAXJECT II Hi-Flow reto para baixo até que a ponta de plástico roxaperfure o tampão do frasco de póde ADZYNMA (FiguraG). O vácuo fará com que o diluente penetre no frasco de póde ADZYNMA.
- É possível que observe bolhas ou espuma; isso é normal e deveriam desaparecer logo.
FiguraG
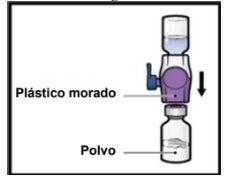
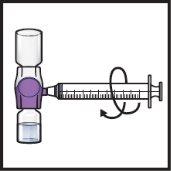
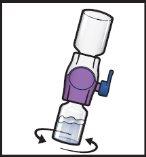
- Gire suavementee continuamente os frascos conectados, fazendo círculos, até que o pó se dissolva completamente (FiguraH).
- Nãoagite o frasco.
FiguraH
- Antes da administração, inspeccione visualmente a solução reconstituída para verificar se há partículas.
- Nãouse o produto se observar partículas ou mudanças na cor.
- Se a dose requer mais de um frasco de ADZYNMA, reconstitua cada frasco seguindo os passos anteriores.
- Use um dispositivo BAXJECTII Hi‑Flow diferente para reconstituir cada frasco de ADZYNMA.
Administração de ADZYNMA
- Retire o tampão azuldo dispositivo BAXJECT II Hi-Flow (FiguraI). Conecte uma seringa com conexão Luer-Lock (FiguraJ).
- Nãoinjete ar no sistema.
|
- Vire o sistema(para que fique em cima o frasco com ADZYNMA). Extraia a solução reconstituídana seringa puxando lentamente o êmbolo (FiguraK).
FiguraK
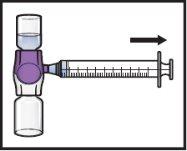
- Se um paciente vai receber mais de um frasco de ADZYNMA, pode extrair o conteúdo de vários frascos na mesma seringa. Repita este processo com todos os frascos reconstituídos de ADZYNMA até alcançar o volume total de administração.
- Desconecte a seringa e conecte uma agulha de injeção adequada ou um equipamento de perfusão.
- Apointe a agulha para cima e elimine as bolhas de ar dando golpes suaves com o dedo na seringa e expulsando lentamente e com cuidado o ar da seringa e da agulha.
- Aplique um torniquete e limpe o local de injeção escolhido com uma toalheta com álcool (FiguraL).
FiguraL
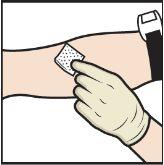
- Insira a agulha na veia e retire o torniquete.
- Infunda ADZYNMA reconstituído lentamente, a uma velocidade de 2a4ml por minuto(FiguraM).
- Para controlar a velocidade de administração, pode ser usada uma bomba de seringa.
FiguraM
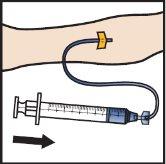
- Retire a agulha da veia e aplique pressão no local de injeção durante vários minutos.
- Nãorecubra a agulha.
Conservação de ADZYNMA
- Conservar ADZYNMA em geladeira (entre 2 °C - 8 °C) ou a temperatura ambiente (até 30 °C) por um período de até 6 meses.
- Nãovolte a introduzir ADZYNMA na geladeira após sua conservação a temperatura ambiente.
- Registrena caixa a data em que ADZYNMA foi retirado da geladeira.
- Nãocongelar.
- Conservar no embalagem original para protegê-lo da luz.
- Nãouse após a data de validade que aparece na etiqueta e na caixa após CAD.
- Use ADZYNMA antes de que transcorram 3horasdesde a reconstituição. Descarte o medicamento reconstituído que não foi usado antes de que transcorram 3 horas desde a reconstituição.
Eliminação de ADZYNMA
- Os frascos são de uso único.
- Descarte a agulha usada, a seringa e os frascos vazios em um recipiente para objetos perfurantes resistente a perfurações.
Os medicamentos não devem ser jogados nos esgotos ou na lixeira. Pergunte ao seu farmacêutico como descartar os embalagens e os medicamentos que não são mais necessários. Dessa forma, você ajudará a proteger o meio ambiente.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: apadamtase alfa and cinaxadamtase alfaFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 10 mgSubstância ativa: alteplaseFabricante: Boehringer Ingelheim International GmbhRequer receita médicaSubstância ativa: protein CFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ADZYNMA 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.