
ADVATE 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como usar ADVATE 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: Informação para o utilizador
ADVATE250UI pó eme dissolvente para solução injectável
ADVATE500UIpó edissolvente para solução injectável
ADVATE1000UIpó edissolvente para solução injectável
ADVATE1500UIpó edissolvente para solução injectável
ADVATE2000UIpó edissolvente para solução injectável
ADVATE3000UIpó edissolvente para solução injectável
Octocog alfa (factor VIII humano de coagulação recombinante)
Leia todo o prospecto detenidamente antes de começar ausar o medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Este medicamento foi-lhe prescrito apenas para si e não deve dá-lo a outras pessoas, ainda que tenham os mesmos sintomas, porque pode prejudicá-las.
- Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é ADVATE e para que é utilizado
- O que necessita saber antes de começar a usar ADVATE
- Como usar ADVATE
- Possíveis efeitos adversos
- Conservação de ADVATE
- Conteúdo do envase e informação adicional
1. O que é ADVATE e para que é utilizado
ADVATE contém o princípio ativo octocog alfa, factor VIII humano de coagulação produzido por tecnologia de ADN recombinante. O factor VIII é necessário para coagular o sangue e parar as hemorragias. Em pacientes com hemofilia A o factor VIII falta ou não funciona corretamente (ausência hereditária de factor VIII).
ADVATE é utilizado para o tratamento e a prevenção de hemorragias em pacientes de todos os grupos etários que sofrem de hemofilia A (um distúrbio hemorrágico hereditário provocado pela ausência de factor VIII).
ADVATE é preparado sem adicionar qualquer proteína derivada humana ou animal em todo o processo de fabricação.
2. O que necessita saber antes de começar a usar ADVATE
Não use ADVATE
- se é alérgico (hipersensível) ao octocog alfa ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
- se é alérgico às proteínas do rato ou do hamster
Se não tiver a certeza se é alérgico, consulte o seu médico.
Advertências e precauções
Consulte o seu médico antes de começar a usar ADVATE. Informe o seu médico se foi tratado previamente com medicamentos que contêm factor VIII, especialmente se desenvolveu inibidores, porque pode existir um risco elevado de que isso volte a suceder. Os inibidores são anticorpos que bloqueiam o factor VIII que reduzem a eficácia de ADVATE para prevenir o controlo do sangramento. O desenvolvimento de inibidores é uma complicação conhecida no tratamento da hemofilia A. Se a sua hemorragia não for controlada com ADVATE, consulte o seu médico imediatamente.
Existe um risco escasso de que possa experimentar uma reação anafiláctica (uma reação alérgica repentina grave) a ADVATE. Deve ser consciente de que os primeiros sintomas de uma reação alérgica são erupção, picar, ronchas, picar generalizado, inchação dos lábios e língua, dificuldade para respirar, jadeios, opressão no peito, sensação de malestar geral e tonturas. Estes sintomas podem ser um aviso de choque anafiláctico, que também pode produzir tonturas graves, perda de consciência e dificuldades graves para respirar.
Se experimentar qualquer um destes sintomas, interrompa imediatamente a administração do medicamento e consulte um médico. Os sintomas graves, incluindo a dificuldade para respirar e (quase) desmaios, requerem um tratamento de emergência rápido.
Pacientes que desenvolvem inibidores do Factor VIII
Se o nível de factor VIII no plasma não atingir os valores esperados com ADVATE, ou se não se controlar adequadamente a hemorragia, pode dever-se ao desenvolvimento de inibidores do factor VIII. Isto será verificado pelo seu médico. Pode necessitar de uma dose maior de ADVATE ou, mesmo, de outro medicamento para controlar as hemorragias. Não aumente a dose total de ADVATE que utiliza para controlar a sua hemorragia sem consultar o seu médico.
Crianças e adolescentes
As advertências e precauções indicadas aplicam-se a adultos e crianças (de 0 a 18 anos de idade).
Uso de ADVATE com outros medicamentos
Informe o seu médico se está a utilizar, já utilizou recentemente ou poderá ter que utilizar qualquer outro medicamento.
Gravidez elactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Condução euso de máquinas
O tratamento com ADVATE não tem influência sobre a capacidade para conduzir e utilizar máquinas.
ADVATE contém sódio
Este medicamento contém 0,45 mmol de sódio (10 mg) por frasco, o que se deve ter em conta em pacientes com dietas pobres em sódio.
3. Como usar ADVATE
O tratamento com ADVATE será iniciado por um médico com experiência no tratamento de pacientes com hemofilia A.
O seu médico calculará a sua dose de ADVATE (em unidades internacionais ou UI) com base no seu estado, no seu peso corporal e no facto de se tratar de prevenção ou tratamento de hemorragias. A frequência de administração dependerá de como actua ADVATE. A terapia substitutiva com ADVATE é normalmente um tratamento de por vida.
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
Prevenção de hemorragias
A dose habitual de octocog alfa é de 20 a 40 UI por kg de peso corporal, administrada cada 2 ou 3 días. No entanto, em alguns casos, especialmente nos pacientes mais jovens, podem ser necessárias a administração mais frequente das injeções ou doses maiores.
Tratamento de hemorragias
A dose de octocog alfa é calculada com base no seu peso corporal e nos níveis de factor VIII que se pretendem alcançar. Os níveis de factor VIII a alcançar dependerão da gravidade e da localização da hemorragia.
Dose (UI) = peso corporal (kg) x aumento de Factor VIII desejado (% do normal) x 0,5
Se tiver a impressão de que o efeito de ADVATE é insuficiente, consulte o seu médico.
O seu médico realizará os análises de laboratório apropriados para se certificar de que tem os níveis adequados de factor VIII. Isto é especialmente importante se se vai submeter a uma operação importante.
Uso em crianças e adolescentes (de0a18anos de idade)
Para o tratamento de hemorragias, a dose em crianças não difere da dos pacientes adultos. Para evitar hemorragias em crianças menores de 6 anos, são recomendadas doses de 20 a 50 UI por kg de peso corporal de 3 a 4 vezes por semana. A administração de ADVATE em crianças (intravenosa) não difere da administração em adultos. Pode ser necessário um dispositivo de acesso venoso central (CVAD) para permitir infusões frequentes de produtos de factor VIII.
Como se administra ADVATE
ADVATE é normalmente injectado numa veia (via intravenosa) pelo seu médico ou enfermeira. O senhor ou qualquer outra pessoa também podem administrar a injeção de ADVATE, mas apenas após receberem a formação adequada. As instruções detalhadas para a sua administração são descritas no final deste prospecto.
Se usar mais ADVATE do que devia
Siga exactamente as instruções de administração de ADVATE indicadas pelo seu médico. Consulte o seu médico se tiver dúvidas. Se injectar uma dose maior de ADVATE do que a recomendada, consulte o seu médico o mais breve possível.
Se esquecer de usar ADVATE
Não se injecte uma dose dupla para compensar as doses esquecidas. Administre a próxima injeção como está estabelecido e continue como o seu médico lhe indicou.
Se interromper o tratamento com ADVATE
Não deixe de usar ADVATE sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Se se produzirem reações alérgicas(anafilácticas) repentinas egraves, deve parar imediatamentea injeção. Contacte o seu médico imediatamente se tiver algum dos seguintes sintomas iniciais de reações alérgicas:
- erupção, sarpullido, ronchas e picar generalizado,
- inchação dos lábios e da língua,
- dificuldade para respirar, jadeios, opressão no peito,
- sensação de malestar geral,
- tonturas e perda de consciência.
Os sintomas graves, como dificuldade para respirar e (quase) síncope, requerem um tratamento temprano de emergência.
Efeitos adversos frequentes(podem afectar até 1 em cada 10 pacientes)
inibidores do factor VIII, dor de cabeça e febre
Efeitos adversos pouco frequentes(podem afectar até 1 em cada 100 pacientes)
tonturas, gripe, desfalecimento, pulsões anormais, manchas vermelhas associadas a picar, molestias no peito, cardenal na zona de injeção, reação na zona de injeção, picar, aumento da sudorese, sabor estranho na boca, sofocos, enxaquecas, perdas de memória, arrepios, diarreia, náusea, vómitos, dificuldade para respirar, dor de garganta, infecção dos vasos linfáticos, palidez, inflamação ocular, sarpullidos, sudorese excessiva, inflamação de pés e pernas, diminuição do número de glóbulos vermelhos, aumento de um tipo de leucócitos (monócitos) e dor na parte superior do abdómen ou parte inferior do peito.
Relacionados com a cirurgia
infecção relacionada com o catéter, diminuição do número de glóbulos vermelhos, inchação das extremidades e das articulações, sangramento prolongado após a retirada do drenagem, diminuição dos níveis de factor VIII e hematoma pós-operatório
Relacionados com os dispositivos de acesso venoso central (CVAD)
Infecção relacionada com catéter, infecção sistémica e coágulo de sangue local no lado do catéter.
Efeitos adversos com frequência desconhecida(não se pode estimar a frequência a partir dos dados disponíveis)
Reações que podem ser mortais (anafilaxia) e outras reações alérgicas (hipersensibilidade), distúrbios gerais (cansaço, falta de energia).
Efeitos adversos adicionais em crianças
Além do desenvolvimento de inibidores em pacientes pediátricos sem tratamento prévio e as complicações associadas ao catéter, nos ensaios clínicos não se observaram diferenças específicas de idade nos efeitos adversos.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de ADVATE
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no invólucro após CAD. A data de validade refere-se ao último dia do mês que se indica.
Conservar em frigorífico (entre 2 °C e 8 °C).
Não congelar.
Até à data de validade, o blister com o medicamento pode ser conservado a temperatura ambiente (até 25 °C) por um período único não superior a 6 meses. Neste caso, este medicamento caduca ao final deste período de 6 meses ou na data de validade impressa no blister, o que ocorrer primeiro. Por favor, anote no invólucro do medicamento a data de fim do período de conservação a temperatura ambiente de 6 meses. O medicamento não pode ser refrigerado novamente após ser conservado a temperatura ambiente.
Conservar o blister com o medicamento no invólucro exterior para protegê-lo da luz.
Este medicamento é para um único uso. Elimine a solução não utilizada de forma apropriada.
Utilize o medicamento imediatamente após a dissolução completa do pó.
Não refrigere o medicamento após a preparação.
Os medicamentos não devem ser deitados fora por meio dos esgotos nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos invólucros e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de ADVATE
- O princípio ativo é octocog alfa (fator VIII humano de coagulação produzido por tecnologia de ADN recombinante). Cada frasco de pó contém nominalmente 250, 500, 1000, 1500, 2000, ou 3000 UI de octocog alfa.
- Os demais componentes são manitol, cloreto de sódio, histidina, trealosa, cloreto de cálcio, trometamol, polissorbato 80 e glutatión (reduzido)
Frasco de dissolvente: 5 ml de água esterilizada para preparações injetáveis
Aspecto do produto econteúdo do envase
ADVATE é um pó desmenuzável de cor branca a esbranquiçada.
Depois da sua reconstituição, a solução é transparente, incolor e livre de partículas estranhas.
Título da autorização de comercialização
Baxter AG
Industriestrasse 67
A‑1221 Viena
Responsáveis pela fabricação
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Bélgica
Baxter SA
Boulevard René Branquart 80
B‑7860 Lessines
Bélgica
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Baxalta Belgium SPRL Tel: +32 2 892 62 00 | Lituânia UAB "Baxter Lithuania" Tel: +370 5 269 16 90 / +370 5 252 71 00 |
Bulgária ??????? ???????? ???? ???.: +359 2 9808482 | Luxemburgo Baxalta Belgium SPRL Tel: +32 2 892 62 00 |
República Tcheca Baxter Czech spol.s.r.o. Tel.: +420 225774111 | Hungria Baxter Hungary Kft. Tel.: +36 1 202 1980 |
Dinamarca Baxalta Denmark A/S Tlf: +45 32 70 12 00 | Malta Baxalta UK Limited Tel.: +44 1 635 798 777 |
Alemanha Baxalta Deutschland GmbH Tel: +49 89 262077-011 | Países Baixos Baxalta Netherlands B.V. Tel: +31 30 799 27 77 |
Estônia OÜ Baxter Estonia Tel.: +372 6 515 120 | Noruega Baxalta Norway AS Tlf: +47 22 585 000 |
Grécia Baxter (Hellas) Ε.Π.Ε. Τηλ.: +30 210 28 80 000 | Áustria Baxalta Österreich GmbH Tel.: +43 1 20100-0 |
Espanha Baxalta Spain S.L. Tel: +34 91 790 42 22 | Polônia Baxter Polska Sp. z o.o. Tel.: +48 22 4883 777 |
França Baxalta France S.A.S. Tél: +33 1 70 96 06 00 | Portugal Baxalta Portugal, Unipessoal, Lda. Tel: +351 21 122 03 00 |
Croácia Baxter d.o.o. Tel: +386 1 420 16 80 | Romênia FARMACEUTICA REMEDIA SA Tel.: +40 21 321 16 40 |
Irlanda Baxalta UK Limited Tel: +44 1 635 798 777 | Eslovênia Baxter d.o.o. Tel.: +386 1 420 16 80 |
Data da última revisão deste prospecto
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instruções para a preparação eadministração
É necessária uma técnica asséptica para a preparação da solução e sua administração.
Utilizar apenas a água esterilizada para preparações injetáveis e o equipamento de reconstituição que se inclui em cada envase de ADVATE. ADVATE não deve ser misturado com outros medicamentos ou dissolventes.
Recomenda-se encarecidamente registrar o nome e o número de lote do produto cada vez que se administre ADVATE.
Instruções para a reconstituição
- Não usar após a data de validade que aparece nas etiquetas e no envase.
- Não utilizar se o equipamento BAXJECT II, o sistema estéril de proteção ou seu envase estiver danificado ou mostrar algum sinal de deterioração, como indica o símbolo: .
- Não refrigerar a preparação após a reconstituição.
- Se o medicamento estiver na geladeira, pegar da geladeira os frascos de pó e de dissolvente de ADVATE e deixá-los à temperatura ambiente (entre 15 °C e 25 °C).
- Lavar as mãos com sabão e água morna.
- Retirar os protetores dos frascos de pó e dissolvente.
- Limpar os tampões com toalhetas impregnadas de álcool. Colocar os frascos em uma superfície plana e limpa.
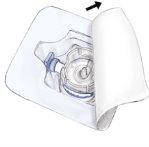
- Abrir o invólucro do equipamento BAXJECT II retirando a tampa de papel sem tocar o interior (Fig. a). Não retirar o equipamento do invólucro. Não utilizar se o equipamento BAXJECT II, seu sistema de barreira estéril ou seu acondicionamento estiverem danificados ou mostrarem algum sinal de deterioração.
- Dar a volta ao invólucro e inserir a ponta de plástico através do tampão do dissolvente. Pegar o invólucro por sua extremidade e retirar o equipamento BAXJECT II de seu invólucro (Fig. b). Não retirar o protetor azul do equipamento BAXJECT II.
- Para a reconstituição, utilizar apenas a água esterilizada para preparações injetáveis e o equipamento para reconstituição incluídos no envase. Com o equipamento BAXJECT II unido ao frasco de dissolvente, inverter o sistema de tal forma que o frasco de dissolvente esteja na parte superior do equipamento. Inserir a ponta de plástico branca dentro do tampão do frasco de pó ADVATE. O vácuo fará com que o dissolvente penetre no frasco de pó ADVATE (Fig. c).
- Agitar suavemente até que todo o material se dissolva. Certificar-se de que o pó ADVATE esteja completamente dissolvido, se não for assim, toda a solução reconstituída não passará através do filtro do equipamento. O medicamento se dissolve rapidamente (normalmente em menos de 1 minuto). Após a reconstituição, a solução deve ser transparente, incolor e não apresentar partículas estranhas.
Fig. aFig. bFig. c



Instruções para a injeção
Para a administração, é necessária o uso de uma seringa luer-lock.
Nota importante:
- Não tente administrar a injeção a menos que tenha recebido uma formação especial de seu médico ou enfermeira.
- Inspeccionar a solução preparada para detectar partículas ou decoloração antes da administração (a solução deve ser transparente, incolor e livre de partículas estranhas).
Não utilize ADVATE se a solução não estiver totalmente transparente ou não estiver dissolvida completamente.
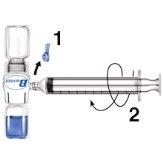
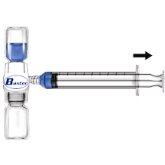
- Retirar o protetor azul do equipamento BAXJECT II. Não introduzir ar na seringa. Conectar a seringa ao equipamento BAXJECT II (Fig. d).
- Inverter o sistema (o frasco com a solução reconstituída na parte superior). Introduzir a solução reconstituída na seringa, puxando o êmbolo para trás lentamente (Fig. e).
- Desconectar a seringa.
- Conectar uma agulha de perfusão com aletas à seringa. Injetar intravenosamente. A solução deve ser administrada lentamente, a uma velocidade determinada de acordo com o nível de confort do paciente, que não exceda 10 ml por minuto. Deve-se tomar o pulso antes e durante a administração de ADVATE. Se observar um aumento significativo do pulso, deve reduzir a velocidade de administração ou interromper temporariamente a injeção, normalmente isso permite que os sintomas desapareçam em seguida (ver seção 4 “Possíveis efeitos adversos”).
- Eliminar a solução não utilizada de forma apropriada.
Fig. dFig. e
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Esta informação está destinada apenas a profissionais do setor sanitário:
Tratamento sob demanda
No caso de episódios hemorrágicos posteriores, a atividade de fator VIII não deve ser inferior ao nível de atividade plasmática dada (em % do normal ou UI/dl) no período correspondente. Pode-se utilizar a seguinte tabela como guia de dosagem em episódios hemorrágicos e cirurgia.
A dose e frequência de administração devem ser adaptadas à resposta clínica em cada caso individual. Em determinadas circunstâncias (por exemplo, presença de um título baixo de inibidor) podem ser necessárias doses maiores do que as calculadas mediante a fórmula.
Grau de hemorragia / tipo de procedimento cirúrgico | Nível de Fator VIII requerido (% ouUI/dl) | Frequência de dose (horas) / duração da terapia (dias) |
Hemorragia Hemartrose incipiente ou hemorragia muscular ou oral. Hemartrose mais extensa, hemorragia muscular ou hematoma. Hemorragia com risco vital. | 20 – 40 30 – 60 60 – 100 | Repetir a injeção a cada 12 a 24 horas (a cada 8 a 24 horas nos pacientes menores de 6 anos) por pelo menos 1 dia até que o episódio hemorrágico, conforme indicado pela dor, se resolva ou se obtenha a cura. Repetir a injeção a cada 12-24 horas (a cada 8 a 24 horas nos pacientes menores de 6 anos) durante 3 a 4 dias ou mais, até que cesse a dor e a incapacidade aguda. Repetir a injeção a cada 8 a 24 horas (a cada 6 a 12 horas nos pacientes menores de 6 anos) até superar o perigo. |
Cirurgia Menor Incluindo extração dental. Maior | 30 – 60 80 – 100 (pré e pós-operatório) | Cada 24 horas (cada 12 a 24 horas nos pacientes menores de 6 anos), por pelo menos 1 dia, até obter a cura. Repetir a injeção a cada 8-24 horas (cada 6 a 24 horas nos pacientes menores de 6 anos) até que se obtenha uma cura adequada da ferida, e luego por pelo menos mais 7 dias de terapia para manter uma atividade de fator VIII de 30% a 60% (UI/dl). |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ComposiçãoCLORURO DE SODIO (0 - mg), MANITOL (E-421) (0 - mg), POLISORBATO 80 (0 - mg)
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ADVATE 500 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médicaForma farmacêutica: INJETÁVEL, 1000 UI - após reconstituição em 2 ml de água para injetáveis, a dose é de 500 UI/mlSubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica




