Pulmicort

Pergunte a um médico sobre a prescrição de Pulmicort

Como usar Pulmicort
Folheto informativo do paciente
Pulmicort, 0,125 mg/ml, suspensão para nebulização
Pulmicort, 0,250 mg/ml, suspensão para nebulização
Pulmicort, 0,500 mg/ml, suspensão para nebulização
Budesonida
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Pulmicort e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Pulmicort
- 3. Como tomar o medicamento Pulmicort
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Pulmicort
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Pulmicort e para que é utilizado
A budesonida, substância ativa do medicamento Pulmicort, pertence a um grupo de medicamentos chamados glicocorticosteroides. Os medicamentos deste grupo têm um efeito anti-inflamatório local. O medicamento Pulmicort é utilizado:
- em pacientes com asma brônquica, nos quais é necessário um tratamento de longo prazo com glicocorticosteroides para controlar o processo inflamatório no sistema respiratório. A causa da asma é a inflamação do sistema respiratório. Os nebulizadores são recomendados quando o uso de inhaladores de pressão (pMDI) ou inhaladores de pó (DPI) é insatisfatório ou não justificado.
- em pacientes com síndrome do crupe - uma inflamação aguda da laringe, traqueia e brônquios - independentemente da etiologia, associada a uma estreitamento significativo das vias aéreas superiores, dificuldade respiratória ou tosse "latente" e levando a distúrbios respiratórios.
- no tratamento de exacerbação da doença pulmonar obstrutiva crônica (DPOC), quando o uso da budesonida na forma de suspensão para nebulização é justificado. A DPOC é uma doença pulmonar crônica que causa dificuldade respiratória e tosse.
2. Informações importantes antes de tomar o medicamento Pulmicort
Quando não tomar o medicamento Pulmicort
- se o paciente tiver alergia (hipersensibilidade) à budesonida ou a qualquer um dos outros componentes do medicamento Pulmicort (listados no ponto 6). Deve informar o médico sobre reações preocupantes que ocorreram após a ingestão de um medicamento que contenha budesonida ou qualquer componente do medicamento.
Precauções e advertências
O medicamento Pulmicort é destinado a tratamento de longo prazo, mas não fornece um alívio rápido dos sintomas de ataques agudos de asma brônquica, nos quais é indicada a administração de medicamentos de ação rápida para dilatar os brônquios. Se não houver uma melhora significativa após o uso de medicamentos de ação rápida para dilatar os brônquios ou se houver necessidade de usá-los com mais frequência do que o usual, deve procurar um médico. Nesses casos, o médico pode considerar a necessidade de um tratamento anti-inflamatório mais eficaz, por exemplo, aumentando a dose de budesonida inalada ou iniciando o tratamento com um glicocorticosteroide oral. Deve ter cuidado especial ao mudar do tratamento com glicocorticosteroides orais para o tratamento com produtos inalados. Durante esse período, pode ocorrer uma insuficiência adrenal transitória. Pacientes que necessitam de tratamento de emergência com grandes doses de glicocorticosteroides orais ou tratamento de longo prazo com as doses mais altas recomendadas de glicocorticosteroides inalados também pertencem a um grupo de risco aumentado para a ocorrência de insuficiência adrenal quando estão expostos a situações de estresse graves. Deve informar o médico sobre situações de estresse previstas (por exemplo, exames) ou procedimentos cirúrgicos planejados. O médico pode considerar o aumento da dose de glicocorticosteroides orais. Atenção. Se ocorrer uma mudança do tratamento com medicamentos orais que contenham glicocorticosteroides para o tratamento com o medicamento Pulmicort na forma de suspensão para nebulização, podem ocorrer os seguintes sintomas: secreção nasal aquosa, erupção cutânea, dor muscular e articular. Em caso de reações alérgicas, como erupção cutânea ou secreção nasal, o médico pode recomendar o tratamento com medicamentos antihistamínicos e (ou) medicamentos de ação local. Se qualquer um dos sintomas for grave ou preocupante ou se ocorrerem sintomas como dor de cabeça, fadiga, náusea ou vômito, deve procurar um médico. O médico pode recomendar um aumento temporário da dose de glicocorticosteroides orais. Recomenda-se um controle regular do crescimento de crianças e adolescentes que tomam glicocorticosteroides, independentemente da via de administração, devido ao risco de retardamento do crescimento. Se o crescimento for retardado, o médico pode reavaliar o tratamento, reduzindo a dose de glicocorticosteroides. Antes de iniciar o tratamento, deve informar o médico sobre outras doenças ou condições além da asma, especialmente sobre:
- infecções ativas ou recentes,
- distúrbios da função hepática. Deve consultar o médico também se as advertências acima se referirem a situações que ocorreram no passado.
Assim como no caso de outros medicamentos inalados, pode ocorrer um espasmo brônquico paradoxal logo após a administração do medicamento Pulmicort. Em caso de ocorrência de uma reação grave, deve interromper imediatamente a administração do medicamento e procurar um médico o mais rápido possível. Durante o uso de glicocorticosteroides inalados, podem ocorrer infecções fúngicas na cavidade oral. Essas infecções podem exigir o uso de uma terapia antifúngica apropriada e, em alguns pacientes, a interrupção do uso de glicocorticosteroides inalados. Deve procurar um médico se os sintomas da doença não melhorarem com o uso das doses recomendadas do medicamento. Se o paciente apresentar visão turva ou outros distúrbios da visão, deve procurar um médico.
Crianças
O medicamento pode ser utilizado no tratamento da asma brônquica em crianças a partir de 6 meses de idade. O médico que acompanha o paciente determina a dose individualmente para cada paciente.
Medicamento Pulmicort e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está tomando atualmente ou recentemente, incluindo os que são vendidos sem receita médica, e também sobre os medicamentos que o paciente planeja tomar. Deve informar o médico sobre reações preocupantes que ocorreram após a ingestão de outros medicamentos. Em particular, deve informar o médico sobre medicamentos antifúngicos que está tomando atualmente, como cetoconazol ou itraconazol (que são inibidores potentes da enzima CYP 3A4) e inibidores da protease do HIV, como ritonavir e atazanavir, que podem causar um aumento na concentração de budesonida no sangue. Se for necessário o uso concomitante desses medicamentos com o medicamento Pulmicort, o intervalo entre as doses dos medicamentos individuais deve ser o mais longo possível, e o médico pode recomendar a redução da dose de budesonida. Não foi observada interação entre a budesonida e outros medicamentos utilizados no tratamento da asma brônquica.
Gravidez e amamentação
Gravidez Se a mulher estiver grávida ou planejar uma gravidez, antes de tomar o medicamento, deve consultar um médico - não deve tomar o medicamento a menos que o médico o recomende. Se a mulher que está tomando o medicamento Pulmicort engravidar, não deve interromper o tratamento por conta própria, mas deve informar o médico o mais rápido possível. Amamentação Se a mulher estiver amamentando, antes de tomar o medicamento, deve consultar um médico.
Condução de veículos e operação de máquinas
O medicamento Pulmicort não afeta a capacidade de conduzir veículos ou operar máquinas.
3. Como tomar o medicamento Pulmicort
Este medicamento deve ser sempre tomado de acordo com as recomendações do médico. A dose do medicamento Pulmicort na forma de suspensão para nebulização é determinada individualmente. Em caso de dúvidas, deve procurar um médico novamente. O medicamento Pulmicort na forma de suspensão para nebulização só pode ser utilizado com um nebulizador (aparelho de inalação). O medicamento é introduzido nos pulmões durante a respiração através do bocal ou da máscara facial. Antes de iniciar o tratamento, deve ler atentamente as "Instruções de uso do medicamento Pulmicort na forma de suspensão para nebulização" no final do folheto e seguir as instruções. Deve lembrar de enxaguar a boca com água após cada inalação. Se uma máscara facial for utilizada, após cada inalação, também deve limpar o rosto. Nem todos os aparelhos de inalação (nebulizadores) são adequados para a administração do medicamento Pulmicort na forma de suspensão para nebulização. Não deve utilizar aparelhos (nebulizadores) de ultrassom.
Asma
Dose inicial
A dose recomendada para crianças a partir de 6 meses de idade: a dose diária total é de 0,25 mg a 0,5 mg. Se a criança estiver tomando um glicocorticosteroide oral, o médico pode aumentar a dose diária para 1 mg, se necessário. A dose recomendada para adultos e idosos: 1 mg a 2 mg por dia. O médico que acompanha o paciente pode alterar a dose após algum tempo.
Dose de manutenção
Recomenda-se o uso da dose mais baixa eficaz. Crianças a partir de 6 meses de idade: a dose diária total é de 0,25 mg a 2 mg. Adultos, incluindo idosos: a dose diária total é de 0,5 mg a 4 mg. Se os sintomas forem muito graves, o médico pode aumentar a dose do medicamento. Se a dose diária for de até 1 mg, o medicamento pode ser administrado uma vez por dia, de manhã ou à noite. Se houver a sensação de que o efeito do medicamento é muito forte ou muito fraco, deve procurar um médico. Se o estado do paciente melhorar, o médico que o acompanha pode decidir reduzir a dose do medicamento. A melhora no estado do paciente após o uso do medicamento Pulmicort pode ocorrer após algumas horas do início do tratamento. O efeito terapêutico completo é alcançado após algumas semanas do início do tratamento. O medicamento Pulmicort deve ser tomado mesmo quando não houver sintomas da doença. Pacientes que tomam glicocorticosteroides orais O medicamento Pulmicort na forma de suspensão para nebulização pode ser prescrito para um paciente que está tomando glicocorticosteroides na forma de comprimidos orais. O medicamento Pulmicort na forma de suspensão para nebulização pode substituir parcial ou totalmente os glicocorticosteroides orais, mantendo ou aumentando a eficácia do tratamento. A redução gradual da dose do medicamento oral deve ser recomendada pelo médico. Durante a mudança do tratamento de glicocorticosteroides orais para o tratamento com medicamentos inalados, o paciente deve estar em um estado estável. Recomenda-se o uso de doses altas do medicamento Pulmicort em combinação com o glicocorticosteroide oral anteriormente utilizado, na mesma dose, por 10 dias. Em seguida, a dose do glicocorticosteroide oral deve ser reduzida gradualmente, aproximadamente 2,5 mg de prednisona ou uma dose equivalente de outro glicocorticosteroide por mês, até a menor dose que mantenha o controle dos sintomas da doença. Muitas vezes, o uso de glicocorticosteroides orais pode ser interrompido completamente. A budesonida administrada ao paciente na forma de suspensão para nebulização é entregue aos pulmões durante a inalação. É muito importante que, durante o uso do medicamento, o paciente faça inalações calmas e uniformes através do bocal do nebulizador ou da máscara facial.
Síndrome do crupe
A dose usualmente utilizada em lactentes e crianças com síndrome do crupe é de 2 mg de budesonida administrados na forma de nebulização. Essa dose pode ser administrada em uma única dose ou dividida em duas doses de 1 mg, com um intervalo de 30 minutos. Esse esquema de dosagem pode ser repetido a cada 12 horas, por um máximo de 36 horas ou até a melhora do estado do paciente.
Exacerbações da DPOC
Com base em dados limitados de estudos clínicos, a dose recomendada do medicamento Pulmicort, suspensão para nebulização, é de 4 a 8 mg por dia, dividida em 2 a 4 doses. O tratamento deve ser realizado até a melhora do estado clínico, mas não por mais de 10 dias. Modo de administração O medicamento Pulmicort pode ser misturado com uma solução de cloreto de sódio a 0,9% e com soluções de terbutalina, salbutamol, fenoterol, acetilcisteína, cromoglicato de sódio ou ipratrópio. A mistura preparada deve ser utilizada dentro de 30 minutos. A dose no recipiente plástico pode ser dividida para obter a dose adequada. Os recipientes plásticos que compõem os pacotes unitários são marcados com uma linha horizontal (Pulmicort 0,25 mg/ml e 0,5 mg/ml). Ao inverter o recipiente plástico, essa linha indica o volume de 1 ml. Se apenas 1 ml for utilizado, o líquido acima da linha de referência deve ser removido. O recipiente plástico aberto deve ser armazenado na embalagem de proteção contra a luz. O conteúdo do recipiente plástico aberto deve ser utilizado dentro de 12 horas.
Dose mais alta do que a recomendada do medicamento Pulmicort
É importante que o paciente tome o medicamento de acordo com as instruções contidas no folheto ou as recomendações do médico. Não deve aumentar ou diminuir a dose do medicamento sem consultar um médico. Em caso de administração de uma dose mais alta do que a recomendada do medicamento, deve procurar um médico ou farmacêutico o mais rápido possível. Se uma dose mais alta do que a recomendada do medicamento Pulmicort for administrada uma única vez, isso não deve ter consequências prejudiciais. Se doses mais altas do que as recomendadas pelo médico forem tomadas por um período prolongado, pode ocorrer um aumento na concentração de hormônios da glândula adrenal no sangue e uma supressão da função adrenal. Nesse caso, o médico deve recomendar a continuação do tratamento com o medicamento Pulmicort nas doses necessárias para manter os sintomas da asma brônquica sob controle.
Omissão da administração do medicamento Pulmicort
Se o paciente esquecer uma dose do medicamento Pulmicort na forma de suspensão para nebulização, não há necessidade de tomar a dose omitida. Deve tomar a próxima dose do medicamento de acordo com as recomendações do médico. Não deve tomar uma dose dupla para compensar a dose omitida. Em caso de dúvidas adicionais sobre o uso deste medicamento, deve procurar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não todos os pacientes os apresentem.
Se ocorrer algum dos seguintes sintomas, deve interromper a administração do medicamento Pulmicort e procurar um médico imediatamente:
Pulmicort e:
- inchaço do rosto, especialmente ao redor da boca, língua, olhos e orelhas, erupção cutânea, coceira, dermatite de contato, urticária e espasmo brônquico (espasmo dos músculos nas vias respiratórias, que causa respiração sibilante). Isso pode indicar uma reação alérgica. Esse efeito não desejado é raro (ocorre em menos de 1 em 1.000 pacientes).
- aparecimento súbito de respiração sibilante após a inalação do medicamento. Esse efeito não desejado é raro (ocorre em menos de 1 em 1.000 pacientes).
Outros efeitos não desejados possíveis:
Comuns (ocorrem em menos de 1 em 10 pacientes)
- infecções fúngicas (candidíase) na cavidade oral. Para reduzir a possibilidade de ocorrência, deve enxaguar a boca com água após o uso do medicamento Pulmicort.
- dor de garganta, tosse e rouquidão, perda de voz.
- infecção pulmonar (pneumonia) em pacientes com DPOC.
Deve informar o médico se ocorrer algum dos seguintes sintomas durante o uso da budesonida; esses podem ser sintomas de infecção pulmonar:
- febre ou calafrios,
- aumento da produção de muco ou mudança na cor do muco,
- aumento da tosse ou dificuldade respiratória.
Menos comuns (ocorrem em menos de 1 em 100 pacientes)
- catarata (opacidade do cristalino do olho).
- visão turva.
- espasmo muscular.
- tremores musculares.
- depressão.
- ansiedade.
Raros (ocorrem em menos de 1 em 1.000 pacientes)
- erupção cutânea no rosto após o uso da máscara facial. Isso pode ser prevenido, lavando o rosto com água após o uso da máscara facial.
- irritabilidade, mudanças de comportamento (principalmente em crianças).
- equimoses fáceis.
- rouquidão e perda de voz (em crianças).
Efeitos não desejados cuja frequência não é conhecida (frequência não pode ser estimada com base nos dados disponíveis):
- distúrbios do sono, ansiedade, excitação excessiva, agressividade.
O uso de glicocorticosteroides inalados pode afetar a produção normal de hormônios esteroides no organismo, especialmente se forem utilizados por um longo período em doses altas. Podem ocorrer efeitos não desejados, como:
- glaucoma (aumento da pressão intraocular), frequência desconhecida.
- retardamento do crescimento em crianças e adolescentes (raro).
- efeitos na glândula adrenal (pequeno órgão perto dos rins) (raro). A ocorrência desses efeitos não desejados após o uso de glicocorticosteroides inalados é menos provável do que após o uso de glicocorticosteroides orais.
Notificação de efeitos não desejados
Se ocorrer algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Medicamentos da Agência Nacional de Vigilância Sanitária. Rua dos Andradas, 481, 20031-054 Rio de Janeiro, RJ, Brasil. Telefone: +55 21 3974 3000. Fax: +55 21 3974 3001. Site: https://www.anvisa.gov.br/. Os efeitos não desejados também podem ser notificados ao detentor da autorização de comercialização. A notificação de efeitos não desejados permite a coleta de mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Pulmicort
O medicamento deve ser armazenado em um local onde as crianças não possam alcançá-lo. Não deve utilizar o medicamento após o prazo de validade impresso na embalagem após "Validade (EXP)". A embalagem deve ser armazenada em temperatura abaixo de 30°C, fechada, protegida da luz. Os recipientes plásticos unitários devem ser armazenados em sacos de folha de alumínio para proteger da luz. Após a abertura do saco de folha de alumínio, o medicamento nos recipientes plásticos unitários, protegido da luz, é estável por 3 meses. O conteúdo do recipiente plástico unitário deve ser utilizado dentro de 12 horas após a abertura. Se apenas 1 ml da suspensão for utilizado do recipiente unitário, o volume restante da suspensão não é estéril. Os medicamentos não devem ser jogados na canalização ou em lixeiras comuns. Deve perguntar ao farmacêutico o que fazer com os medicamentos que não são mais necessários. Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Pulmicort
- A substância ativa do medicamento é a budesonida. 1 ml da suspensão para nebulização contém: 0,125 mg, 0,250 mg ou 0,500 mg de budesonida micronizada. 1 recipiente plástico contém 0,25 mg, 0,5 mg ou 1 mg de budesonida em 2 ml da suspensão para nebulização.
- Os outros componentes são: edetato dissódico, cloreto de sódio, polissorbato 80, ácido cítrico anidro, citrato de sódio, água purificada.
Como é o medicamento Pulmicort e que conteúdo tem o pacote
Líquido de cor branca a quase branca em um recipiente plástico unitário. 0,125 mg/ml, 0,250 mg/ml, 0,500 mg/ml: 20 recipientes plásticos de 2 ml (4 sacos de folha de alumínio com 5 recipientes plásticos cada) em uma caixa de papelão. 0,250 mg/ml, 0,500 mg/ml: 5 recipientes plásticos de 2 ml (1 saco de folha de alumínio com 5 recipientes plásticos) em uma caixa de papelão.
Detentor da autorização de comercialização e fabricante
Detentor da autorização de comercialização: AstraZeneca AB, S-151 85 Södertälje, Suécia. Fabricante: AstraZeneca AB, Forskargatan 18, SE-151 36 Södertälje, Suécia. Para obter mais informações, deve contatar o representante do detentor da autorização de comercialização: AstraZeneca Farmacêutica Brasil Ltda., Rua Henri Dunant, 795, 9º andar, 04009-003 São Paulo, SP, Brasil. Telefone: +55 11 2121 7000. Fax: +55 11 2121 7010. Data da última atualização do folheto: dezembro de 2022
Instruções de uso do medicamento Pulmicort na forma de suspensão para nebulização
- 1. Antes de usar o conteúdo do recipiente plástico, deve agitá-lo suavemente com um movimento circular.
- 2. Segure o recipiente plástico com o medicamento na posição vertical (ver figura), e então abra o recipiente girando a "asinha".
- 3. Conecte a extremidade aberta do recipiente ao reservatório do nebulizador e esprema-o lentamente.
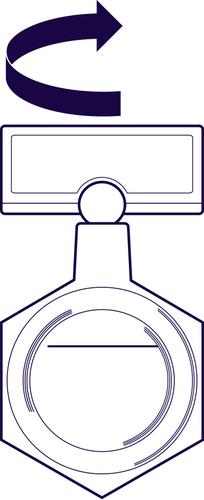
Os recipientes plásticos que contêm 0,25 mg/ml e 0,5 mg/ml são marcados com uma linha que indica o volume de 1 ml quando o recipiente é invertido. Se apenas 1 ml for utilizado, o líquido acima da linha de referência deve ser removido. Antes de usar o restante do medicamento, deve agitar suavemente o conteúdo do recipiente.
- Deve anotar a data de abertura do saco de folha de alumínio. Não deve usar os recipientes plásticos unitários após 3 meses da data de abertura da folha de alumínio.
- O conteúdo do recipiente plástico unitário deve ser utilizado dentro de 12 horas após a abertura.
- O medicamento deve ser armazenado em temperatura abaixo de 30°C.
- Os recipientes plásticos com o medicamento devem ser armazenados em sacos de folha de alumínio para proteger da luz. Se o conteúdo do recipiente plástico não for utilizado por completo, o volume restante deve ser protegido da luz.
- Os recipientes plásticos com o medicamento devem ser armazenados na posição vertical.
ATENÇÃO
- 1. Deve enxaguar a boca após cada uso do medicamento.
- 2. Se o paciente usar uma máscara facial, deve verificar se a máscara está bem ajustada ao rosto durante a inalação. Deve lavar o rosto após o uso do medicamento.
LIMPEZA
A câmara do nebulizador, o bocal ou a máscara facial devem ser lavados após cada uso. Essas partes devem ser lavadas com água corrente morna, utilizando um detergente suave recomendado pelo fabricante do nebulizador. A câmara do nebulizador deve ser então bem enxaguada e seca, conectando o compressor à saída.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorAstraZeneca AB
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PulmicortForma farmacêutica: Suspensão, 0,125 mg/mlSubstância ativa: budesonideRequer receita médicaForma farmacêutica: Suspensão, 0,25 mg/mlSubstância ativa: budesonideRequer receita médicaForma farmacêutica: Suspensão, 0.5 mg/mlSubstância ativa: budesonideRequer receita médica
Alternativas a Pulmicort noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Pulmicort em Ukraine
Alternativa a Pulmicort em Espanha
Médicos online para Pulmicort
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Pulmicort – sujeita a avaliação médica e regras locais.