

Optirai 300

Pergunte a um médico sobre a prescrição de Optirai 300

Como usar Optirai 300
folheto para o doente
Folheto anexado à embalagem: informação para o utilizador
Optiray 300 solução para injeção e infusão, 636 mg/ml
( Ioversol)
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Deve consultar o médico ou farmacêutico se tiver alguma dúvida adicional.
- Se ocorrerem algum efeitos secundários, incluindo possíveis efeitos secundários não listados no folheto, deve informar o médico ou farmacêutico.
Índice do folheto
- 1. O que é o medicamento Optiray e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Optiray
- 3. Como tomar o medicamento Optiray
- 4. Possíveis efeitos secundários
- 5. Como conservar o medicamento Optiray
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Optiray e para que é utilizado
Optiray é utilizado em vários exames radiológicos, incluindo:
- imagem de vasos sanguíneos, tanto arteriais quanto venosos (em adultos e crianças)
- rins(em adultos e crianças)
- tomografia computadorizada(em adultos)
Optiray é um meio de contraste que contém iodo. O iodo bloqueia a radiação de raios-X,
permitindo a visualização dos vasos sanguíneos e órgãos internos pelos quais o sangue flui.
2. Informações importantes antes de tomar o medicamento Optiray
Quando não tomar o medicamento Optiray:
- se o doente tiver alergiaa meios de contrasteque contenham iodo ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
- se o doente tiver hipertireoidismo
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Optiray, deve consultar o médico se o doente tiver:
- asma ou reações alérgicas no passado, como náuseas, vômitos, pressão arterial baixa, sintomas cutâneos
- insuficiência cardíaca, hipertensão, distúrbios circulatórios ou acidente vascular cerebral e se o doente for idoso
- diabetes
- doença renal ou hepática
- distúrbios cerebrais
- doenças da medula óssea, como certos tipos de câncer de sangue, chamados de paraproteinemia, mieloma múltiplo
- certos distúrbios dos glóbulos vermelhos, chamados de anemia falciforme
- tumor da glândula suprarrenal que afeta a pressão arterial, chamado de feocromocitoma
- aumento do nível de aminoácido - homocisteína, devido a um metabolismo anormal
- exame recente da vesícula biliar com uso de meio de contraste
- exame planejado da tireoide com uso de substância que contenha iodo Deve adiar, pois o medicamento Optiray pode afetar os resultados por um período de até 16 dias.
- Nos doentes que receberam Optiray, foram relatadas reações cutâneas graves, como eosinofilia e sintomas sistêmicos (DRESS), síndrome de Stevens-Johnson (SJS), necrólise tóxica epidermal (síndrome de Lyell ou TEN) e pustulose exantemática aguda generalizada (AGEP), que podem ser fatais.
- Durante ou logo após o procedimento de imagem, pode ocorrer uma perturbação temporária do funcionamento do cérebro chamada de encefalopatia. Deve informar imediatamente o médico se notar qualquer um dos sintomas relacionados a este estado descritos no ponto 4.
Foram relatadas reações cutâneas graves nos doentes que receberam Optiray, como
eosinofilia e sintomas sistêmicos (DRESS), síndrome de Stevens-Johnson (SJS), necrólise tóxica epidermal (síndrome de Lyell ou TEN) e pustulose exantemática aguda generalizada (AGEP), que podem ser fatais.
Durante ou logo após o procedimento de imagem, pode ocorrer uma perturbação temporária do funcionamento do cérebro chamada de encefalopatia. Deve informar imediatamente o médico se notar qualquer um dos sintomas relacionados a este estado descritos no ponto 4.
Crianças e adolescentes com menos de 18 anos
Crianças com menos de 18 anos
Optiray 300 é utilizado para imagem de vasos sanguíneos ou rins nesta faixa etária.
No entanto, não é recomendado para uso em crianças submetidas a exame de tomografia computadorizada. No
caso de recém-nascidos, especialmente prematuros, é recomendada a verificação do nível de hormônios da tireoide, chamados de TSH e T4. A verificação é realizada 7-10 dias e 1 mês após a administração do medicamento Optiray.
Em crianças com menos de 3 anos, incluindo recém-nascidos, cujas mães receberam meio de contraste iodado durante a gravidez, é recomendada a verificação do nível de hormônios da tireoide, chamados de TSH e T4. As verificações são realizadas 7-10 dias e 1 mês após a administração do medicamento Optiray.
Optiray e outros medicamentos
Deve informar o médico ou especialista em radiologia sobre todos os medicamentos que está tomando atualmente
ou recentemente, bem como sobre os medicamentos que planeja tomar.
Os seguintes medicamentospodem afetar o medicamento Optirayou o medicamento Optiray pode afetá-los:
- metformina:medicamento utilizado no tratamento da diabetes O médico verificará a função renal antes e após a administração do medicamento Optiray. Dependendo do nível de função renal, o médico pode considerar interromper a metformina por um período de 48 horas antes do exame e 48 horas após o exame. Não deve reiniciar a metformina por pelo menos 48 horas após o exame e apenas se a função renal tiver retornado ao nível anterior.
- interleucinas:medicamentos utilizados no tratamento de certos tumores
- certos medicamentos que aumentam a pressão arterialdevido à vasoconstrição Para evitar o risco de distúrbios do sistema nervoso do medicamento Optiray, nunca deve ser administrado durante o uso desses medicamentos.
- medicamentos para anestesia geralForam relatados mais casos de efeitos secundários.
- diuréticos:medicamentos que aumentam a produção de urina e reduzem a pressão arterial No caso de desidratação causada pelo uso de diuréticos, a administração de meios de contraste iodados pode aumentar o risco de insuficiência renal aguda.
Optiray com alimentos e bebidas
Deve consultar o médico. Em doentes com doença renal preexistente, não deve restringir a ingestão de água,
pois isso pode piorar a função renal.
Gravidez e amamentação
- GravidezDeve informar o médico se está grávida ou suspeita que está grávida. O médico administrará o medicamento Optiray à paciente grávida apenas se for absolutamente necessário, pois o medicamento pode prejudicar o feto.
- Amamentação Deve interromper a amamentação por um diaapós a injeção, pois não há dados suficientes sobre a segurança do uso. Deve consultar o médico ou especialista em radiologia.
Condução de veículos e operação de máquinas
Conduzir veículos ou operar máquinas não é recomendado por 1 hora após
a injeção.
Além disso, foram observados sintomas como tontura, sonolência, fraqueza e distúrbios da visão. Se esses sintomas ocorrerem no doente, não deve tentar realizar qualquer atividade que exija concentração e capacidade de reação.
O medicamento Optiray contém sódio.
O medicamento contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar o medicamento Optiray
Os exames com o medicamento Optiray serão realizados apenas por um médico ou especialista
em radiologia, que também decidirá a dose.
O medicamento Optiray é injetado em um vaso sanguíneoe distribuído no organismo pelo sistema circulatório. Antes do uso, o medicamento é aquecido à temperatura corporal, então injetado uma ou várias vezes durante o exame radiológico.
A dose depende do tipo de exame e de outros fatores, como o estado do doente e a idade.
É utilizada a menor dose possível para obter imagens de qualidade adequada.
Uso de dose maior do que a recomendada do medicamento Optiray
A superdose é potencialmente perigosa e pode afetar a respiração, o coração e o sistema circulatório. Deve informar imediatamente o médico ou especialista em radiologia se o doente notar qualquer um desses sintomas após receber o medicamento Optiray.
Se tiver alguma dúvida adicional sobre o uso deste medicamento, deve consultar o médico ou especialista em radiologia.
4. Possíveis efeitos secundários
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não em todos os doentes.
Os efeitos secundários do medicamento Optiray são geralmente independentes da dose administrada. Na
maioria dos casos, são leves ou moderados e raramente graves ou fatais.
Deve contatar imediatamente o médicose ocorrer qualquer um dos seguintes
sintomas de efeitos secundários graves:
- parada cardíaca ou respiratória
- vasoconstrição cardíaca ou trombose
- acidente vascular cerebral, isquemia, síncope
- perda de memória
- distúrbios da fala
- movimentos involuntários
- cegueira temporária
- insuficiência renal aguda
- erupção cutânea, vermelhidão ou bolhas, que podem se transformar em reações cutâneas fatais, incluindo necrólise tóxica epidermal (síndrome de Lyell ou TEN) ou reação medicamentosa que causa erupção, febre, inflamação de órgãos internos, anormalidades hematológicas e doença sistêmica (DRESS)
- sintomas de reação alérgica, como choque anafilático, vias aéreas obstruídas, edema de glote, faringe, língua, dificuldade para respirar, tosse, espirros, vermelhidão e (ou) edema facial e ocular, coceira, erupção e urticária
Efeitos secundários podem ocorrer com a seguinte frequência:
muito comum, ocorre em mais de 1 em 10 doentes
- sensação de calor
comum, ocorre em 1 a 10 em 100 doentes
- dor
- náusea
menos comum, ocorre em 1 a 10 em 1000 doentes
- urticária
- vermelhidão da pele, coceira,
- tontura
- dor de cabeça
- distúrbio do paladar
- distúrbios da sensação, como formigamento, parestesia
- vômito
- espirros
- hipertensão
raro, ocorre em 1 a 10 em 10.000 doentes
- síncope
- tontura
- visão turva
- pulso irregular
- hipotensão
- vermelhidão facial súbita
- espasmo da glote
- edema e obstrução das vias aéreas, incluindo compressão da glote, respiração sibilante
- dificuldade para respirar
- inflamação do interior do nariz, que causa espirros e congestão nasal
- tosse, irritação da garganta
- secura na boca
- erupção
- urgência para urinar
- edema facial, incluindo olhos
- calafrios,
- tremor involuntário
- sensação de frio
muito raro, ocorre em menos de 1 em 10.000 doentes
- reação alérgica grave
- desorientação, ansiedade, nervosismo
- perda de consciência, entorpecimento
- paralisia
- sonolência
- estupor
- distúrbios da fala
- distúrbios da visão
- redução da sensibilidade ao toque ou percepção
- inflamação alérgica dos olhos, causando vermelhidão, lacrimejamento e coceira nos olhos
- zumbido ou tinido nos ouvidos
- batimento cardíaco irregular, taquicardia
- dor no peito
- alterações da atividade cardíaca medidas pelo eletrocardiograma
- doença que afeta o fluxo sanguíneo para o cérebro
- hipertensão
- inflamação das veias, dilatação dos vasos sanguíneos
- acúmulo de líquido nos pulmões
- dor de garganta
- baixo nível de oxigênio no sangue
- dor abdominal
- inflamação das glândulas salivares, edema da língua
- dificuldade para engolir, aumento da salivação
- inchaço doloroso das camadas profundas da pele, principalmente no rosto
- aumento da transpiração
- espasmo muscular
- insuficiência renal aguda ou disfunção renal
- incontinência urinária, sangue na urina, redução da micção
- edema dos tecidos devido ao excesso de líquido
- reações no local da injeção, incluindo dor, vermelhidão, sangramento ou necrose
- mal-estar ou sensação de doença, fadiga, letargia
desconhecido: frequência não pode ser estimada com base nos dados disponíveis
- reação alérgica grave com choque
- hipotireoidismo transitório
- convulsões
- perturbação temporária do funcionamento do cérebro (encefalopatia), que pode causar desorientação, alucinações, distúrbios da visão, cegueira, convulsões, perda de coordenação, perda de movimento de um lado do corpo, problemas de fala e perda de consciência.
- distúrbio do movimento
- perda de memória
- cegueira temporária
- parada cardíaca, arritmia cardíaca potencialmente fatal
- extrasistolia
- vasoconstrição cardíaca, taquicardia
- coloração azulada da pele (cianose) devido ao baixo nível de oxigênio no sangue
- choque
- trombose ou espasmo em um vaso sanguíneo
- palidez
- parada respiratória, asma, vias aéreas obstruídas
- redução da capacidade de produzir som com os órgãos vocais
- diarreia
- reação grave que afeta a pele, sangue e órgãos internos (reação medicamentosa com eosinofilia e sintomas sistêmicos, também conhecida como DRESS ou síndrome de hipersensibilidade a medicamentos)
- erupção cutânea vermelha, descamativa, generalizada com nódulos sob a pele e bolhas, acompanhada de febre no início do tratamento (pustulose exantemática aguda generalizada)
- erupção cutânea vermelha com nódulos ou bolhas
- reação grave com sintomas semelhantes aos da gripe e erupção cutânea dolorosa / bolhas na pele, boca, olhos e genitais (síndrome de Stevens-Johnson / necrólise tóxica epidermal)
- incontinência urinária, sangue na urina, redução da micção
- hipotireoidismo em recém-nascidos
- febre
Notificação de efeitos secundários
Se ocorrerem qualquer efeito secundário, incluindo possíveis efeitos secundários não listados no folheto, deve informar o médico ou farmacêutico. Efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos do Instituto de Regulação de Medicamentos, Equipamentos Médicos e Produtos Biocidas, Al.
Jerozolimskie 181C, 02-222 Varsóvia, telefone: + 48 22 49 21 301, fax: + 48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Efeitos secundários também podem ser notificados ao responsável pelo medicamento. Ao notificar efeitos secundários, é possível coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Optiray
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não use este medicamento após a data de validade impressa na embalagem. A data de validade é o último dia do mês indicado.
Conservar os recipientes na embalagem externa para proteger da luz.
Proteger contra radiação de raios-X.
Não conservar a uma temperatura superior a 30°C.
Optiray 300 pode ser conservado por um mês a 37°C em um aquecedor destinado a conservar meios de contraste, com circulação de ar.
Não use este medicamento se notar descoloração ou partículas sólidas.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Optiray:
- O princípio ativo é ioversol. Um mililitro de Optiray 300 contém 636 mg de ioversol, o que corresponde a 300 mg de iodo ligado organicamente.
- Os outros componentes são: versenato de sódio e cálcio (estabilizador), trometamol e cloridrato de trometamol (tampão) e água para injeção. Hidróxido de sódio e (ou) ácido clorídrico podem ser usados para ajustar o pH para 6,0 a 7,4.
Como é o medicamento Optiray e o que contém a embalagem
Optiray 300 é embalado em:
- ampolas de vidro incolor de 10 ou 20 ml, com fechaduras de borracha bromobutílica e proteções de alumínio. A caixa contém 10 ampolas.
- frascos de vidro incolor de 50, 75, 100, 150 ou 200 ml, com fechaduras de borracha bromobutílica e proteções de alumínio. A caixa contém as seguintes quantidades de frascos. Capacidade de 50 ml - 10 ou 25 frascos. Capacidade de 100 ml - 10 ou 12 frascos. Capacidade de 75 ml, 150 ml ou 200 ml - 10 frascos.
- frascos de vidro incolor de 500 ml, com fechaduras de borracha bromobutílica e proteções de alumínio. A caixa contém 5 frascos, 6 frascos ou 10 frascos.
Optiray 300 também é fornecido em seringas pré-cheias e seringas com injetor de pressão, feitas de polipropileno. A ponta da seringa e o êmbolo são feitos de borracha natural.
Seringas pré-cheias de 30 ou 50 ml. A caixa contém 10 seringas. Seringas pré-cheias de 50 ml. A caixa contém 20 seringas.
Seringas com injetor de pressão de capacidade: capacidade de 50 ml ou 100 ml. A caixa contém 10 ou 20 seringas.Capacidade de 125 ml. A caixa contém 10 seringas.
Nem todos os tamanhos de embalagem e caixas precisam estar disponíveis em todos os países.
Responsável pelo medicamento e fabricante:
- Endereço do responsável pelo medicamentoGuerbet BP 57400 95943 Roissy CDG Cedex França Para obter informações mais detalhadas sobre este medicamento, deve contatar o representante do responsável pelo medicamento: Guerbet Poland Sp. z o.o., telefone: (22) 6684110.
- Fabricante
Guerbet
BP 57400
95943 Roissy CDG Cedex
França
local de fabricação: 16-24 rue Jean Chaptal, 93600 Aulnay sous Bois, França
Data da última atualização do folheto:
Instruções de uso das seringas pré-cheias
Seringa pré-cheia
Montagem e verificação
Aviso: A superfície externa da seringa não é estéril.
O conteúdo da seringa e a superfície sob a tampa azul e as ranhuras de reforço do êmbolo são
estéreise, portanto, durante a montagem, deve ter cuidado.
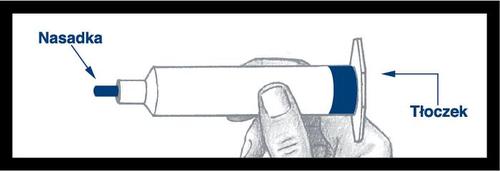
Retire a seringa do suporte e
verifique se não há vazamentos ao redor
da tampa azul e na parte externa do
êmbolo. Não use a seringa se notar
vazamento.
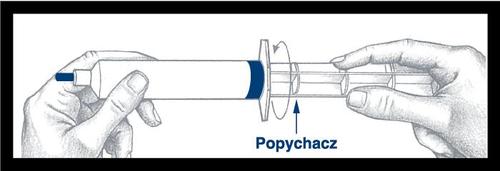
Após enroscar o injetor de pressão no
êmbolo da seringa, é importante girar
o injetor mais ½ volta, para que o
êmbolo azul gire livremente.
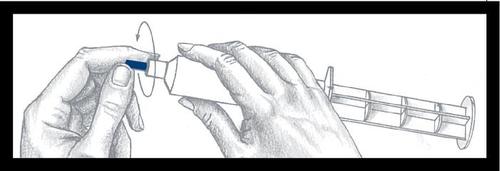
Antes de usar a seringa, a tampa azul
deve ser desenroscada e descartada.
A superfície sob a tampa é estéril,
portanto, deve ter cuidado para não
tocá-la durante as etapas subsequentes.
A seringa agora está pronta para a
instalação da agulha ou do tubo de infusão.
Após o uso, descarte a seringa e a porção não utilizada do medicamento.
Instruções de uso das seringas com injetor de pressão
Seringa pré-cheia
Montagem e verificação
Aviso: A parte externa da seringa não é estéril.
O conteúdo da seringa e a superfície sob a tampa azul e as ranhuras de reforço do êmbolo são
estéreise, portanto, durante a montagem, deve ter cuidado.
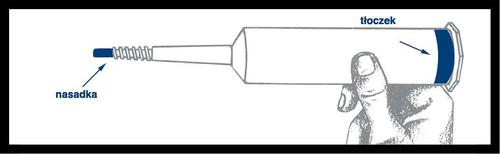
Retire a seringa do suporte e
verifique se não há vazamentos ao redor
da tampa azule na parte externa do
êmbolo. Não use a seringa se notar
vazamento. Coloque a seringa na capa de pressão.
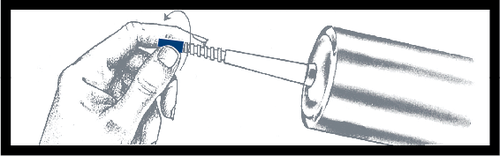
Para remover a tampa azul, deve
pressioná-la e girá-la, e após a remoção,
descartá-la. A superfície sob a tampa é
estéril. Durante as etapas subsequentes,
deve ter cuidado.
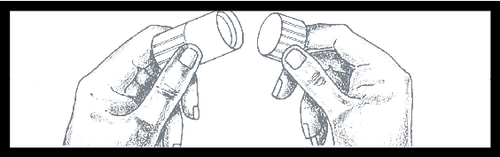
Em seguida, remova a capa da proteção
antipoeira do conector tipo Luer, girando-a
para quebrar a vedação visível.
Descarte a capa.
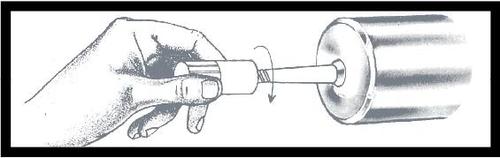
Enrosque o conector tipo Luer na seringa,
segurando a proteção antipoeira e apertando
até o fim. Remova e descarte a proteção
antipoeira imediatamente antes de conectar
o tubo de conexão estéril.
Após o uso, descarte a seringa e a porção não utilizada do medicamento.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGuerbet
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Optirai 300
Alternativas a Optirai 300 noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Optirai 300 em Espanha
Médicos online para Optirai 300
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Optirai 300 – sujeita a avaliação médica e regras locais.














