
Gartior
Zapytaj lekarza o receptę na Gartior

Jak stosować Gartior
Ulotka dołączona do opakowania: informacja dla pacjenta
Gartior, 18 mikrogramów/dawkę odmierzoną, proszek do inhalacji w kapsułce twardej
Tiotropium
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Gartior i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Gartior
- 3. Jak stosować lek Gartior
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Gartior
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Gartior i w jakim celu się go stosuje
Lek Gartior, 18 mikrogramów/dawkę odmierzoną, proszek do inhalacji w kapsułce twardej zawiera
substancję czynną tiotropium i należy do grupy leków stosowanych w leczeniu obturacyjnych chorób
dróg oddechowych, leków wziewnych, leków przeciwcholinergicznych.
Lek Gartior ułatwia oddychanie ludziom chorym na przewlekłą obturacyjną chorobę płuc (POChP).
POChP to przewlekła choroba płuc, która powoduje duszność i kaszel. Nazwa POChP jest związana z
przewlekłym zapaleniem oskrzeli i rozedmą płuc. POChP jest chorobą przewlekłą, dlatego lek Gartior
należy przyjmować codziennie, a nie tylko wtedy, gdy występują problemy z oddychaniem lub inne
objawy POChP.
Gartior to lek rozszerzający oskrzela o długotrwałym działaniu, który pomaga rozszerzyć drogi
oddechowe i ułatwia przedostawanie się powietrza do i z płuc. Regularne stosowanie leku Gartior
może także pomóc w zmniejszeniu utrzymującej się duszności związanej z chorobą i pomoże
zmniejszyć skutki choroby odczuwalne w życiu codziennym. Codzienne stosowanie leku Gartior
pomoże także zapobiec nagłemu, krótkotrwałemu nasileniu objawów POChP, które może trwać przez
kilka dni. Działanie leku utrzymuje się przez 24 godziny, należy więc lek stosować tylko raz na dobę.
Informacje dotyczące prawidłowego dawkowania leku Gartior znajdują się w dalszej części ulotki w
punkcie 3. Jak stosować lek Gartior oraz Instrukcja użycia.
2. Informacje ważne przed zastosowaniem leku Gartior
Kiedy nie stosować leku Gartior
- jeśli pacjent ma uczulenie na tiotropium lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- jeśli pacjent ma uczulenie na atropinę lub jej pochodne, takie jak np. ipratropium lub oksytropium.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Gartior należy omówić to z lekarzem lub farmaceutą.
- Należy skonsultować się z lekarzem, jeśli u pacjenta występuje jaskra z wąskim kątem, problemy z gruczołem krokowym (prostatą) lub trudności w oddawaniu moczu.
- Jeśli u pacjenta występują zaburzenia czynności nerek, należy skonsultować się z lekarzem.
- Lek Gartior jest wskazany do stosowania w terapii podtrzymującej u pacjentów z przewlekłą obturacyjną chorobą płuc. Nie należy go stosować do leczenia nagłych napadów duszności lub świszczącego oddechu.
- Po zastosowaniu leku Gartior mogą wystąpić natychmiastowe reakcje alergiczne, takie jak wysypka, obrzęk, świąd, świszczący oddech i duszność. W takim przypadku należy natychmiast skontaktować się z lekarzem.
- Bezpośrednio po zastosowaniu leków stosowanych wziewnie, takich jak Gartior może wystąpić uczucie ucisku w klatce piersiowej, kaszel, świszczący oddech lub duszność. W takim przypadku należy natychmiast skontaktować się z lekarzem.
- Należy uważać, aby podczas inhalacji proszek nie dostał się do oczu, ponieważ może to spowodować wystąpienie lub zaostrzenie objawów jaskry z wąskim kątem, która jest chorobą oczu. Ból oka lub dyskomfort, niewyraźne widzenie, widzenie tęczowej obwódki wokół źródła światła lub zmienione widzenie kolorów, jednocześnie z zaczerwienieniem oczu, mogą być oznaką wystąpienia ostrej jaskry z wąskim kątem. Zaburzeniom dotyczącym oczu mogą towarzyszyć ból głowy, nudności i wymioty. Jeżeli wystąpią objawy jaskry z wąskim kątem, należy przerwać stosowanie tiotropium i natychmiast skontaktować się z lekarzem, najlepiej okulistą.
- Suchość błony śluzowej jamy ustnej występująca w czasie stosowania leku, związana z jego przeciwcholinergicznym działaniem, może po dłuższym czasie powodować próchnicę zębów, dlatego należy pamiętać o utrzymaniu higieny jamy ustnej.
- Jeśli pacjent przebył w ciągu ostatnich 6 miesięcy zawał mięśnia sercowego, lub w ciągu ostatniego roku wystąpiła u niego niestabilna lub zagrażająca życiu arytmia serca albo ciężka niewydolność serca, należy poinformować o tym lekarza. Ważne jest aby podjąć właściwą decyzję, czy lek Gartior może być stosowany u pacjenta.
- Leku Gartior nie należy stosować częściej niż raz na dobę.
Dzieci i młodzież
Lek Gartior nie jest zalecany dla dzieci i młodzieży w wieku poniżej 18 lat.
Lek Gartior a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować.
Należy poinformować lekarza lub farmaceutę o innych lekach stosowanych w chorobie płuc, takich
jak ipratropium lub oksytropium.
Nie zgłoszono działań niepożądanych podczas przyjmowania leku Gartior z innymi lekami
stosowanymi w leczeniu POChP, takimi jak: leki wziewne stosowane doraźnie, np. salbutamol,
metyloksantyny, np. teofilina i (lub) doustne oraz wziewne steroidy, np. prednizolon.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku. Nie należy
stosować tego leku, chyba, że zalecił to lekarz.
Prowadzenie pojazdów i obsługiwanie maszyn
Jeżeli wystąpią zawroty głowy, niewyraźne widzenie lub ból głowy, to te stany mogą wpływać na
zdolność prowadzenia pojazdów i obsługiwania maszyn.
Lek Gartior zawiera laktozę
Jeśli stwierdzono wcześniej u pacjenta nietolerancję niektórych cukrów lub alergię na białka mleka
(które mogą znajdować się w małych ilościach w składniku laktoza jednowodna) pacjent powinien
skontaktować się z lekarzem przed przyjęciem leku.
3. Jak stosować lek Gartior
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty. W razie wątpliwości
należy zwrócić się do lekarza lub farmaceuty.
Zalecana dawka to inhalacja zawartością jednej kapsułki (18 mikrogramów tiotropium) raz na dobę.
Należy wykonać 2 wdechy z tej samej kapsułki (patrz punkt „Instrukcja użycia” na końcu tej ulotki).
Nie należy stosować dawki większej niż zalecana.
Lek Gartior nie jest zalecany dla dzieci i młodzieży w wieku poniżej 18 lat.
Należy przyjmować kapsułkę o tej samej porze każdego dnia. Jest to ważne, ponieważ lek Gartior
działa przez 24 godziny.
Kapsułki mogą być stosowane tylko wziewnie i nie należy ich stosować doustnie. Kapsułek nie należy
połykać.
Inhalator Vertical-Haler, do którego wkłada się kapsułkę leku Gartior, przekłuwa kapsułkę, co
umożliwia wziewne przyjęcie zawartego w niej proszku.
Pacjent powinien upewnić się, czy posiada inhalator oraz czy prawidłowo go stosuje. Instrukcja użycia
inhalatora znajduje się w dalszej części tej ulotki.
Należy upewnić się, że powietrze nie jest wydychane do inhalatora Vertical-Haler.
W razie jakichkolwiek trudności z użyciem inhalatora Vertical-Haler należy skontaktować się z
lekarzem, pielęgniarką lub farmaceutą aby wskazali właściwy sposób użycia.
Inhalator Vertical-Haler należy myć raz w tygodniu. Instrukcja czyszczenia inhalatora znajduje się w
dalszej części tej ulotki.
Podczas stosowania leku Gartior, należy uważać, aby proszek nie dostał się do oczu. Może to
spowodować niewyraźne widzenie, ból oka i (lub) zaczerwienienie oczu. Należy natychmiast przemyć
oczy ciepłą wodą i niezwłocznie zgłosić się do lekarza.
W przypadku wrażenia, że trudności w oddychaniu nasilają się, należy niezwłocznie skontaktować się
z lekarzem.
Zastosowanie większej niż zalecana dawki leku Gartior
W razie zastosowania więcej niż 1 kapsułki leku Gartior na dobę, należy natychmiast skontaktować
się z lekarzem. U pacjenta może zwiększyć się ryzyko wystąpienia działań niepożądanych, takich jak
suchość błony śluzowej jamy ustnej, zaparcia, trudności w oddawaniu moczu, przyspieszenie
czynności serca lub niewyraźne widzenie.
Pominięcie zastosowania leku Gartior
Jeśli pacjent zapomni przyjąć dawkę leku, powinien ją przyjąć, jak tylko sobie o tym przypomni.
Nigdy nie należy przyjmować dwóch dawek jednocześnie lub w tym samym dniu. Następną dawkę
należy przyjąć o zwykłej porze.
Przerwanie stosowania leku Gartior
Przed przerwaniem przyjmowania leku Gartior, należy poradzić się lekarza lub farmaceuty.
Po przerwaniu stosowania leku Gartior mogą nasilić się objawy POChP.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane opisane poniżej zostały zgłoszone przez pacjentów podczas stosowania tego
leku. Działania niepożądane wymieniono w zależności od częstości ich występowania: często, niezbyt
często, rzadko lub częstość nieznana.
Często (mogą wystąpić nie częściej niż u 1 na 10 osób):
- suchość błony śluzowej jamy ustnej: zazwyczaj o łagodnym nasileniu
Niezbyt często (mogą wystąpić nie częściej niż u 1 na 100 osób):
- zawroty głowy
- ból głowy
- zaburzenia smaku
- niewyraźne widzenie
- nieregularne bicie serca (migotanie przedsionków)
- zapalenie gardła
- chrypka (dysfonia)
- kaszel
- zgaga (choroba refluksowa przełyku)
- zaparcia
- zakażenia grzybicze w obrębie jamy ustnej i gardła (kandydoza jamy ustnej i gardła)
- wysypka
- trudności w oddawaniu moczu (zatrzymanie moczu)
- bolesne oddawanie moczu
Rzadko (mogą wystąpić nie częściej niż u 1 na 1000 osób):
- trudności w zasypianiu (bezsenność)
- widzenie tęczowej obwódki wokół źródła światła lub zmienione widzenie kolorów, wraz z zaczerwienieniem oczu (jaskra)
- zwiększone ciśnienie w oku
- nieregularne bicie serca (częstoskurcz nadkomorowy)
- przyspieszenie czynności serca (tachykardia)
- uczucie szybkiego bicia serca (kołatanie serca)
- ucisk w klatce piersiowej powiązany z kaszlem, świszczącym oddechem lub dusznością występującą natychmiast po inhalacji lekiem (skurcz oskrzeli)
- krwawienie z nosa
- zapalenie krtani
- zapalenie zatok
- zamknięcie światła jelita lub brak ruchów robaczkowych jelit (niedrożność jelit, w tym porażenna niedrożność jelit)
- zapalenie dziąseł
- zapalenie języka
- utrudnione przełykanie (dysfagia)
- zapalenie jamy ustnej
- nudności
- reakcje nadwrażliwości, w tym reakcje natychmiastowe
- ciężka reakcja alergiczna, która może powodować obrzęk w obrębie twarzy lub gardła (obrzęk naczynioruchowy)
- pokrzywka
- swędzenie
- zakażenie dróg moczowych
Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych):
- zmniejszenie ilości wody w organizmie (odwodnienie)
- próchnica zębów
- ciężkie reakcje alergiczne (reakcje anafilaktyczne)
- zakażenia lub owrzodzenie skóry
- suchość skóry
- obrzęk stawów
Ciężkie działania niepożądane, takie jak reakcje alergiczne, które mogą wywołać obrzęk w obrębie
twarzy lub gardła (obrzęk naczynioruchowy), lub inne reakcje nadwrażliwości (takie jak nagłe
obniżenie ciśnienia krwi lub zawroty głowy) mogą wystąpić same lub jako część ciężkiej reakcji
alergicznej (reakcji anafilaktycznej) po zastosowaniu leku Gartior. Dodatkowo, tak jak w przypadku
innych leków stosowanych w postaci inhalacji, u niektórych pacjentów może wystąpić nieoczekiwany
ucisk w klatce piersiowej, kaszel, świszczący oddech lub duszność bezpośrednio po inhalacji (skurcz
oskrzeli). W razie wystąpienia któregokolwiek z tych objawów należy natychmiast skontaktować się z
lekarzem.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek działania niepożądane, w tym wszelkie objawy niepożądane
niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Gartior
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku tektórowym lub na
blistrze po: EXP. Termin ważności oznacza ostatni dzień podanego miesiąca.
Inhalator Vertical-Haler należy wyrzucić po 90 dniach od pierwszego użycia.
Kapsułkę należy zużyć niezwłocznie po otwarciu blistra.
Nie przechowywać w temperaturze powyżej 30°C.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Gartior
Substancją czynną jest tiotropium. Każda kapsułka zawiera 22,5 mikrograma tiotropiowego bromku
jednowodnego, co odpowiada 18 mikrogramom tiotropium.
Dawka dostarczona podczas inhalacji, z ustnika inhalatora Vertical-Haler zawiera 10 mikrogramów
tiotropium.
Pozostałe składniki to laktoza jednowodna (która może zawierać niewielkie ilości białek mleka).
Otoczka kapsułki zawiera żelatynę, wodę oczyszczoną, makrogol 4000, tytanu dwutlenek (E 171) ,
żelaza tlenek żółty (E 172) i błękit brylantowy FCF (E 133).
Jak wygląda lek Gartior i co zawiera opakowanie
Lek Gartior, 18 mikrogramów/dawkę odmierzoną, proszek do inhalacji w kapsułce twardej to
nieprzeźroczyste zielone kapsułki żelatynowe twarde zawierające biały proszek.
Blister z folii PA/Aluminium/PVC/Aluminium zawierający 10 kapsułek.
Vertical-Haler to inhalator jednodawkowy z pomarańczową nasadką i białym korpusem. Wykonany
jest z tworzywa sztucznego polimeru akrylonitrylo-butadieno-styrenowego (ABS) i stali nierdzewnej.
Materiały, które mają bezpośredni kontakt z lekiem w momencie inhalacji to: stal nierdzewna 304
(igły przekłuwające kapsułkę), akrylonitrylo-butadieno-styren-ABS (wchodzi w skład ustnika, przez
który wydostaje się lek oraz komory kapsułki).
Dostępne wielkości opakowań:
- Pudełko tekturowe zawierające 30 kapsułek (3 blistry) i inhalator suchego proszku
- Pudełko tekturowe zawierające 60 kapsułek (6 blistrów) i inhalator suchego proszku
- Pudełko tekturowe zawierające 90 kapsułek (9 blistrów) i inhalator suchego proszku
- Pudełko tekturowe zawierające 30 kapsułek (3 blistry)
- Pudełko tekturowe zawierające 60 kapsułek (6 blistrów)
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny
Glenmark Pharmaceuticals s.r.o.
Hvězdova 1716/2b
140 78 Praga 4
Republika Czeska
Wytwórca/Importer
Pharmadox Healthcare Limited
Kw20a Kordin Industrial Park
Paola, PLA 3000
Malta
Glenmark Pharmaceuticals s.r.o.
Fibichova 143
566 17 Vysoké Mýto
Republika Czeska
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego pod następującymi nazwami:
W celu uzyskania bardziej szczegółowych informacji na temat leku należy zwrócić się do miejscowego przedstawiciela podmiotu odpowiedzialnego:
| Państwo | Nazwa leku |
| Republika Czeska | Gartior |
| Polska | Gartior |
| Słowacja | Tiotropium Glenmark |
Glenmark Pharmaceuticals Sp. z o. o.
ul. Dziekońskiego 3
00-728 Warszawa
Tel: +48 22 35 12 500
Email: [email protected]
Data ostatniej aktualizacji ulotki:
Wyrób medyczny: Inhalator suchego proszku
- (ang. DPI - Dry Powder Inhaler) Nazwa handlowa: Vertical-Haler
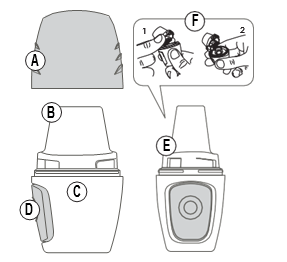
Części inhalatora:
A) Nasadka D) Przycisk boczny
B) Ustnik E) Otwarta przestrzeń
C) Komora F) Komora na kapsukę
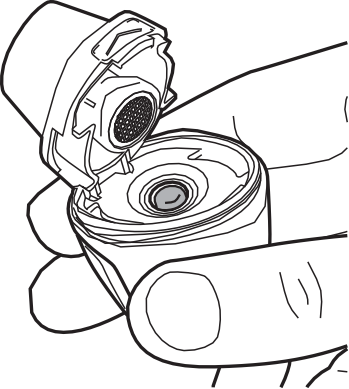
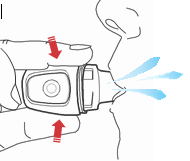
- 1) Zdjęcie nasadkiPodczas używania inhalatora ręce muszą być czyste i suche. Należy przytrzymać mocno podstawę inhalatora i zdjąć nasadkę od boku, jak pokazano poniżej. (ryc. 1).
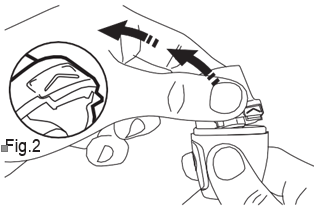
- 2) Otwarcie inhalatora Vertical-HalerAby otworzyć inhalator, należy go mocno chwycić za podstawę. Czubkiem palca należy nacisnąć w górę obszar oznaczony „ ” (ryc. 2).






Przed użyciem:
Inhalator został opracowany w celu
wspomagania inhalacji leków wziewnych w
postaci suchego proszku umieszczonego w
kapsułkach; takie urządzenie jest
aktywowane poprzez wdech (inhalator
suchego proszku aktywowany wdechem -
DPI). Kapsułki zawierające lek przechowuje
się oddzielnie od inhalatora.
Każdą kapsułkę zawierającą pojedynczą dawkę należy umieścić w komorze inhalatora dopiero w momencie użycia.
Po umieszczeniu w komorze inhalatora i
przekłuciu przez przycisk, tuż przed
inhalacją, pacjent może rozpocząć inhalację
leku.
Inhalator powinien być sprzedawany tylko z
lekiem.
Przeciwwskazania:
Pacjenci, którzy nie są w stanie samodzielnie
kontrolować swojego oddechu.
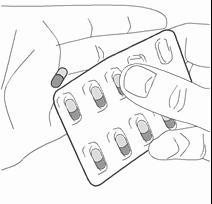
- 3) Wyjęcie kapsułkiNależy zdjąć folię ochronną, aby wyjąć kapsułkę z blistra (ryc. 3).
- 4) Umieszczenie kapsułkiNależy trzymać otwarty inhalator pionowo. Należy włożyć kapsułkę do komory (ryc. 4).
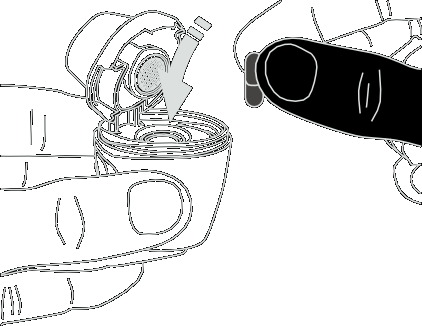
- 5) Kontrola prawidłowego położenia kapsułkiKapsułka powinna znajdować się we wgłębieniu komory (ryc. 5).
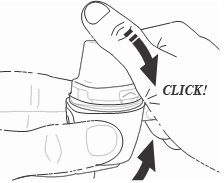
- 6) Zamykanie inhalatora Vertical-HalerNależy trzymać inhalator Vertical-Haler pionowo i zamknąć ustnik. Dźwięk „kliknięcia” potwierdza, że inhalator Vertical-Haler został prawidłowo zamknięty (ryc. 6).
- 8) Wykonanie głębokiego wydechuNależy trzymać inhalator z dala od ust i wykonać spokojny i głęboki wydech (ryc. 9). Wstrzymać oddech.
NIE należy wdmuchiwać powietrza do inhalatora. Nawilżone powietrze wdmuchiwane do wnętrza inhalatora
może zmniejszyć wdychaną dawkę.
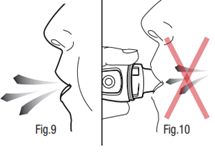
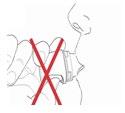
- 9) Wykonanie wdechuUstnik należy umieścić między zębami i mocno zacisnąć wargi wokół niego. Powietrze należy wdychać powoli i tak głęboko, jak to możliwe (ryc. 11). Wibrujący dźwięk potwierdza prawidłowe wykonanie czynności.
NIE należy zasłaniać wlotów powietrza znajdujących się bezpośrednio pod ustnikiem. W przeciwnym razie nie będzie
zapewnione optymalne uwalnianie leku.
Wibrujący dźwięk potwierdza prawidłowo wykonaną inhalację.
NIE należy naciskać bocznego przycisku podczas inhalacji, ponieważ zablokuje to uwalnianie leku. Wibrujący dźwięk
potwierdza prawidłowo wykonaną
inhalację.
- 7) Przebijanie kapsułkiNależy trzymać inhalator pionowo (ryc. 7) i mocno nacisnąć boczny przycisk, aż do uczucia oporu. Lekki opór potwierdza prawidłowe przekłucie kapsułki (ryc. 8)
Jeżeli to konieczne, to należy powtórzyć czynność z punktu 5. Należy otworzyć komorę na kapsułkę (ryc. 2), aby upewnić się, że
kapsułka jest prawidłowo umieszczona we
wgłębieniu (ryc. 5).

- 10) Wstrzymanie oddechuNależy wstrzymać oddech na co najmniej 10 sekund. Należy wyjąć inhalator z ust, następnie oddychać normalnie (ryc. 9). Zapewnia to osadzanie się leku w płucach. Należy powtórzyć kroki od 8 do 10, aby upewnić się, że cały lek został podany.

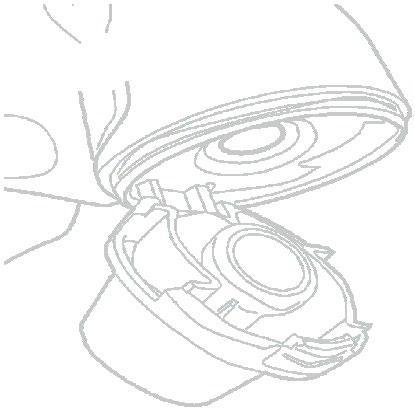
- 11) Kontrola opróżnionej kapsułkiNależy otwórzyć inhalator Vertical-Inhaler i sprawdzić, czy w kapsułce nie pozostał proszek leczniczy. Jeśli proszek nadal znajduje się w kapsułce, należy powtórz kroki 8–11.
- 12) Opróżnianie inhalatora Vertical-HalerNależy wyjąć pustą kapsułkę (ryc. 13). Kapsułka mogła pęknąć na małe fragmenty, które mogły przedostać się do jamy ustnej lub gardła. Nie należy się tym martwić, ponieważ składnik kapsułki jest jadalny i nieszkodliwy.
- 13) Czyszczenie inhalatora Vertical-HalerInhalator Vertical-Haler należy czyścić raz w tygodniu. Ustnik inhalatora i komorę kapsułki należy wyczyść czystą, suchą szmatką. Alternatywnie można użyć miękkiej, czystej szczoteczki do usunięcia pozostałości, które mogły pozostać wewnątrz inhalatora. Należy zamknąć inhalator Vertical-Haler.
Należy nałożyć ponownie nasadkę na ustnik, dzięki temu urządzenie będzie zabezpieczone przed zanieczyszczeniami.
Do czyszczenia urządzenia NIE WOLNO używać wody ani innych agresywnych detergentów.
- 14) Wypłukanie ustNależy przepłukać usta wodą, nie połykać wody.
- 15) Wyrzucenie urządzeniaInhalator Vertical-Inhaler jest przeznaczony do stosowania tylko z dołączonym lekiem i żadnym innym. Jeżeli pacjent otrzyma nowe opakowanie z nowym inhalatorem Vertical- Haler, należy pamiętać o wyrzuceniu starego inhalatora.
Dodatkowe środki ostrożności:
NIE WOLNOwymieniać się inalatorem
Vertical-Haler z innymi osobami. Istnieje
poważne ryzyko zakażenia krzyżowego.
Można wyrzucać z innymi odpadami
domowymi.
Inhalatora należy używać tylko z danym
lekiem, zgodnie ze wskazaniami.
NIE WOLNO otwierać kapsułki i dotykać
proszku.
NIE WOLNO umieszczać w komorze
inhalatora więcej niż jednej kapsułki ani
umieszczać dwóch różnych leków.
Hałas w pomieszczeniu może utrudniać
nasłuchiwanie, czy urządzenie pracuje
właściwie. Zaleca się używanie urządzenia w
cichym pomieszczeniu.
W celu uzyskania dodatkowych informacji
dotyczących stosowania inhalatora należy
skontaktować się z lekarzem lub farmaceutą.
NIE WOLNOdemontować inhalatora.
Jeżeli wystąpią jakiekolwiek problemy z
użytkowaniem wyrobu medycznego, pacjent
powinien odesłać go do podmiotu
odpowiedzialnego lub jego przedstawiciela w
opakowaniu zapewniającym zachowanie
integralności fizycznej.
Wszystkie ciężkie incydenty, które wystąpiły
po zastosowaniu wyrobu medycznego należy
zgłosić podmiotowi odpowiedzialnemu
posiadającemu pozwolenie na dopuszczenie
do obrotu oraz do właściwego krajowego
organu nadzoru.

- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterGlenmark Pharmaceuticals s.r.o. Pharmadox Healthcare Limited
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki GartiorPostać farmaceutyczna: Proszek, 18 mcgSubstancja czynna: tiotropium bromideProducent: Ferrer Internacional, S.A.Wymaga receptyPostać farmaceutyczna: Proszek, 10 mcgSubstancja czynna: tiotropium bromideProducent: Actavis Ltd. Laboratorios Liconsa S.A. Teva Operations Poland Sp. z o.o. Teva Pharma B.V.Wymaga receptyPostać farmaceutyczna: Proszek, 18 mcg/dawkę odmierzonąSubstancja czynna: tiotropium bromideBez recepty
Odpowiedniki Gartior w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Gartior – Ukraina
Odpowiednik Gartior – Hiszpania
Lekarze online w sprawie Gartior
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Gartior – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














