
MVABEA SUSPENSION INYECTABLE

Cómo usar MVABEA SUSPENSION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Mvabea suspensión inyectable
Vacuna contra el virus del Ébola (MVA-BN-Filo [recombinante])
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que usted o su hijo sean vacunados, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Esta vacuna se le ha recetado solamente a usted o a su hijo, y no debe dársela a otras personas.
- Si usted o su hijo experimentan efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Mvabea y para qué se utiliza
- Qué necesita saber antes de que a usted o a su hijo le administren Mvabea
- Cómo se administra Mvabea
- Posibles efectos adversos
- Conservación de Mvabea
- Contenido del envase e información adicional
1. Qué es Mvabea y para qué se utiliza
Qué es Mvabea
Mvabea es una vacuna utilizada en la protección futura frente a la enfermedad del virus del Ébola. Se administra en personas de 1 año de edad o mayores que pueden entrar en contacto con el virus del Ébola.
Mvabea se administra como la segunda dosis de una pauta de vacunación de 2 dosis que ayuda a proteger contra la enfermedad del Ébola causada por el Zaire ebolavirus, que es un tipo de Filovirus. Esta vacuna no le protegerá frente a los otros tipos de Filovirus.
Debido a que Mabvea no contiene el virus entero del Ébola, no puede producirle la enfermedad por el virus del Ébola.
La pauta de vacunación de 2 dosis consta de:
- una primera dosis con la vacuna de Zabdeno,
- seguida alrededor de 8 semanas después de una dosis de la vacuna de Mvabea.
Incluso después de haber recibido el régimen de vacunación de Zabdeno y Mvabea, debe tener mucho cuidadode no entrar en contacto con el virus del Ébola. Como sucede con todas las vacunaciones, es posible que la pauta de vacunación no proteja totalmente a todas las personas frente a la enfermedad por el virus del Ébola.
La pauta de vacunación de 2 dosis de Zabdeno y Mvabea se debe utilizar de acuerdo con las recomendaciones oficiales.
Qué es Ébola
- Ébola es una enfermedad grave causada por un virus. Las personas contraen Ébola a partir de personas o animales que están infectados con Ébola o que han fallecido por Ébola.
- Usted puede contraer Ébola a través de la sangre y fluidos corporales como la orina, las heces, la saliva, el vómito, el sudor, la leche materna, el semen y fluidos vaginales de personas que estén infectadas por el virus del Ébola.
- Usted también puede contraer Ébola a través de objetos que hayan estado en contacto con la sangre o fluidos corporales de una persona o un animal con Ébola (como ropa u objetos en contacto directo).
- Ébola no se transmite por el aire, el agua o los alimentos.
La enfermedad por el virus del Ébola generalmente genera fiebre alta - y esto puede afectar a la coagulación de la sangre, provocando un sangrado grave (“fiebre hemorrágica grave”). Esto puede provocar una enfermedad grave y, en algunos casos, la muerte.
- Los primeros signos y síntomas pueden ser fiebre, cansancio, debilidad o mareo y dolor muscular.
- Más tarde, los signos y síntomas pueden consistir en sangrado bajo la piel o en órganos del cuerpo como el hígado o los riñones y de la boca, los ojos o los oídos. Algunas personas sufren diarrea grave o un descenso repentino de la presión arterial o del flujo sanguíneo a los órganos del cuerpo (shock), lo que puede causar lesiones graves y permanentes en estos órganos, confusión grave (delirio), convulsiones (crisis epilépticas), insuficiencia renal y coma.
Consulte con su médico, farmacéutico o enfermero primero para decidir si le deberían administrar esta vacuna.
Cómo funciona la vacuna
La pauta de vacunación de 2 dosis con Zabdeno y Mvabea estimula las defensas naturales del organismo (sistema inmunitario). La vacuna funciona haciendo que el cuerpo genere su propia protección (anticuerpos) frente al virus que causa la infección del Ébola. Esto le ayudará a protegerse frente a la enfermedad del virus del Ébola en el futuro.
2. Qué necesita saber antes de que a usted o a su hijo le administren Mvabea
Para asegurarse de que la pauta de vacunación es adecuado para usted o su hijo, es importante que informe a su médico, farmacéutico o enfermero si alguna de las circunstancias siguientes es aplicable a usted o a su hijo. Si hay algo que no entiende, pida a su médico, farmacéutico o enfermero que se lo explique.
No reciba esta vacuna si
- usted o su hijo ha sufrido alguna vez una reacción alérgica grave a alguno de los principios activos o a alguno de los demás componentes indicados en la sección 6.
- usted o su hijo ha sufrido alguna vez una reacción alérgica grave al pollo o al huevo o a un antibiótico conocido como “gentamicina”.
Si no está seguro, consulte a su médico, farmacéutico o enfermero antes de que le administren la vacuna.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a recibir Mvabea si usted o su hijo:
- ha tenido alguna vez una reacción alérgica grave después de recibir cualquier otra vacuna inyectable,
- se ha desmayado alguna vez después de una inyección,
- tiene un problema de sangrado o le salen hematomas con facilidad,
- tiene actualmente fiebre o una infección,
- está tomando medicamentos que debilitan el sistema inmunitario, como corticosteroides en dosis altas (por ejemplo, prednisona) o quimioterapia (medicamentos para el cáncer),
- tiene un sistema inmunitario débil - por ejemplo, debido a una infección por el VIH o a una enfermedad que se transmite de forma hereditaria (“trastorno genético”).
Si alguna de las situaciones anteriores le aplica a usted o su hijo (o si tiene dudas), consulte a su médico, farmacéutico o enfermero antes de que les administren Mvabea.
Si tiene un riesgo alto de estar en contacto con el virus del Ébola, puede estar recomendada una vacunación de refuerzo con Zabdeno para usted o su hijo. Consulte a su médico, farmacéutico o enfermero si esto les aplica a usted o a su hijo.
Si usted o su hijo solo recibe una de las vacunas, Zabdeno o Mvabea, esto puede ofrecerle menos protección frente a la enfermedad por el virus del Ébola que si recibe una pauta con ambas vacunas.
Como sucede con todas las vacunas, es posible que la pauta de vacunación de 2 dosis con Zabdeno y Mvabea no proteja totalmente a todas las personas frente a la enfermedad por el virus del Ébola y no se sabe durante cuánto tiempo estará protegido.
- Las personas a las que se les ha administrado las 2 dosis de la pauta de vacunación deben seguir tomando precauciones para evitar entrar en contacto con el virus del Ébola.
Lavar sus manos correctamente es la manera más eficaz de prevenir la transmisión de gérmenes peligrosos, como el virus del Ébola. Esto reduce el número de gérmenes en las manos y su transmisión de persona a persona.
Se describen a continuación los métodos de lavado adecuado de las manos.
- Utilice agua y jabón cuando las manos estén manchadas con suciedad, sangre u otros fluidos corporales. No es necesario utilizar jabones antimicrobianos para el lavado de manos.
- Utilice un desinfectante de manos a base de alcohol cuando las manos no estén sucias. No utilice agentes de lavado a base de alcohol cuando las manos estén manchadas con suciedad, sangre u otros fluidos corporales.
Mientras esté en un área afectada por Ébola, es importante evitar lo siguiente:
- El contacto con la sangre y fluidos corporales (como orina, heces, saliva, sudor, vómito, leche materna, semen y los fluidos vaginales).
- Artículos que hayan estado en contacto con la sangre o los fluidos corporales de una persona infectada (como ropa, ropa de cama, agujas y equipamiento médico).
- Rituales funerarios o de enterramiento que precisen la manipulación del cuerpo de alguien que ha fallecido por Ébola.
- El contacto con murciélagos, simios, monos o con sangre, fluidos y preparados con carne cruda de estos animales (carne de caza) o carne de origen desconocido.
- El contacto con el semen de un hombre que ha tenido Ébola. Usted debe seguir prácticas de sexo seguro hasta que sepa que el virus ha desaparecido del semen. Consulte a su médico, farmacéutico o enfermero sobre cuánto tiempo debe mantener las prácticas sexuales seguras.
Niños menores de 1 año de edad
No se debe administrar Mvabea en niños menores de 1 año de edad.
Otros medicamentos y Mvabea
Informe a su médico o farmacéutico si usted o su hijo están utilizando, han utilizado recientemente o pudieran tener que utilizar cualquier otro medicamento o vacuna.
Embarazo y lactancia
Si usted o su hija está embarazada o en periodo de lactancia, consulte a su médico o farmacéutico para que le aconseje antes de recibir esta vacuna. Hágalo también si cree que usted o su hija podría estar embarazada o tiene intención de quedarse embarazada.
Conducción y uso de máquinas
Mvabea no tiene efectos conocidos sobre la capacidad para conducir y utilizar máquinas.
Mvabea contiene sodio
Mvabea contiene menos de 1 mmol de sodio (23 mg) por 0,5 mL; esto es, esencialmente “exento de sodio”.
3. Cómo se administra Mvabea
Su médico o enfermero le inyectará en un músculo (inyección intramuscular) en el brazo superior o en el muslo.
Mvabea no debe inyectarse en un vaso sanguíneo.
La pauta de vacunación de 2 dosis consta de:
- una dosis de la vacuna de Zabdeno,
- seguida alrededor de 8 semanas después de una dosis de la vacuna de Mvabea.
Su médico le indicará la fecha de la segunda vacuna.
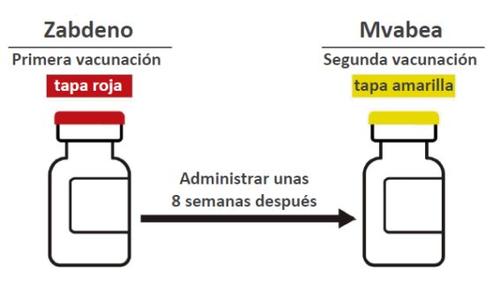
Qué cantidad de vacuna recibirá usted o su hijo Primovacunación
- Primera vacunación con Zabdeno - vial con tapa roja (0,5 mL).
- Segunda vacunación con Mvabea - vial con tapa amarilla (0,5 mL), administrada unas 8 semanas después de la primera vacunación con Zabdeno.
Vacunación de refuerzo con Zabdeno (una dosis adicional de Zabdeno para aumentar o renovar el efecto de la pauta de vacunación de dos dosis recibido previamente con Zabdeno y Mvabea)
- Se recomienda la vacunación de refuerzo para usted o su hijo si tienen un riesgo alto de estar en contacto con el virus del Ébola y has completado el régimen de vacunación de 2 dosis hace más de 4 meses.
- Pregúntele a su médico si usted o su hijo deberían recibir la vacunación de refuerzo.
Durante y después de la inyección de la vacuna, el médico observará a usted o a su hijo durante 15 minutos, o más según sea necesario, en caso de reacción alérgica grave.
Al final de este prospecto, se incluyen instrucciones para preparar la vacuna- para profesionales médicos y sanitarios.
Si recibe una inyección involuntaria o accidental de Zabdeno o Mvabea
- Si a usted o a su hijo se les administra accidentalmente Mvabea como primera vacunación - recibirá Zabdeno como segunda vacunación unas 8 semanas después.
- Si a usted o a su hijo se les administra accidentalmente Zabdeno como primera y segunda vacunación - recibirá Mvabea unas 8 semanas después de la segunda vacunación con Zabdeno.
- Si a usted o a su hijo se les administra accidentalmente Mvabea como primera y segunda vacunación - recibirá Zabdeno unas 8 semanas después de la segunda vacunación con Mvabea.
- Si a usted o a su hijo no se les ha administrado Mvabea unas 8 semanas después de la vacunación con Zabdeno - consulte con su médico, farmacéutico o enfermero sobre la administración de la segunda vacunación con Mvabea.
Si falta a una cita para la vacunación con Zabdeno o Mvabea
- Si falta a una cita, informe a su médico y pida una nueva cita.
- Si olvida una inyección programada, es posible que no esté totalmente protegido frente al virus del Ébola.
- Si tiene cualquier otra duda sobre el uso de esta vacuna, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran. La mayoría de los efectos adversos se produjeron en los 7 días siguientes a la administración de la inyección.
Los siguientes efectos adversos pueden ocurrir en adultos.
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- dolor, calor o hinchazón en el lugar de inyección
- sensación de mucho cansancio
- dolor muscular
- dolor de articulaciones
Frecuentes(pueden afectar hasta a 1 de cada 10 personas)
- vómitos
- picor en el lugar de inyección
Poco frecuentes(pueden afectar hasta a 1 de cada 100 personas)
- enrojecimiento y endurecimiento de la piel en el lugar de inyección
- picor generalizado
Los siguientes efectos adversos pueden ocurrir en niños y adolescentes de 1 a 17 años de edad.
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- dolor en el lugar de inyección
- sensación de mucho cansancio
Frecuentes (pueden afectar hasta a 1 de cada 10 personas)
- hinchazón, picor o enrojecimiento en el lugar de inyección
- fiebre
- escalofríos
- dolor muscular
- dolor de articulaciones
La mayoría de estos efectos adversos son de intensidad leve o moderada y no son de larga duración.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema de notificación nacional incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Mvabea
Mantener esta vacuna fuera de la vista y del alcance de los niños.
La información sobre conservación, caducidad y uso y manipulación se describe en la sección destinada a los profesionales sanitarios al final del prospecto.
Su médico o farmacéutico es responsable de conservar esta vacuna y desechar correctamente el producto no utilizado.
6. Contenido del envase e información adicional
Composición de Mvabea
Una dosis (0,5 mL) contiene:
- El principio activo es el virus vaccinia Ankara Bavarian Nordic* Modificado que codifica:
- la glucoproteína (GP) de la variante Mayinga de Zaire ebolavirus
- la GP de la variante Gulu de Sudan ebolavirus
- la nucleoproteína de Tai Forest ebolavirus
- la GP de la variante Musoke de Marburg marburgvirus
No menos de 0,7 x 108 unidades infecciosas
- Producido en fibroblastos de embrión de pollo y mediante tecnología del ADN recombinante.
Este producto contiene organismos modificados genéticamente (OMG).
Esta vacuna contiene residuos mínimos de gentamicina (ver sección 2).
- Los demás componentes (excipientes) son cloruro de sodio, trometamol, agua para preparaciones inyectables y ácido clorhídrico (para ajuste del pH).
Aspecto de Mvabea y contenido del envase
Mvabea es una suspensión en un vial de vidrio monodosis (0,5 mL) con un tapón de goma y tapa amarilla.
Suspensión de color amarillo claro, entre clara y lechosa.
Mvabea se presenta en un envase que contiene 20 viales monodosis.
Titular de la autorización de comercialización
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Bélgica
Responsable de la fabricación
Janssen Biologics B.V.
Einsteinweg 101
2333 CB Leiden
Países Bajos
Janssen Pharmaceutica NV
Turnhoutseweg 30
B-2340 Beerse
Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Janssen-Cilag NV Tel/Tél: +32 14 64 94 11 | Lietuva UAB "JOHNSON & JOHNSON" Tel: +370 5 278 68 88 |
???????? „??????? & ??????? ????????” ???? ???.: +359 2 489 94 00 | Luxembourg/Luxemburg Janssen-Cilag NV Tél/Tel: +32 14 64 94 11 |
Ceská republika Janssen-Cilag s.r.o. Tel: +420 227 012 227 | Magyarország Janssen-Cilag Kft. Tel.: +36 1 884 2858 |
Danmark Janssen-Cilag A/S Tlf: +45 4594 8282 | Malta AM MANGION LTD Tel: +356 2397 6000 |
Deutschland Janssen-Cilag GmbH Tel: +49 2137 955 955 | Nederland Janssen-Cilag B.V. Tel: +31 76 711 1111 |
Eesti UAB "JOHNSON & JOHNSON" Eesti filiaal Tel: +372 617 7410 | Norge Janssen-Cilag AS Tlf: +47 24 12 65 00 |
Ελλ?δα Janssen-Cilag Φαρμακευτικ? Α.Ε.Β.Ε. Tηλ: +30 210 80 90 000 | Österreich Janssen-Cilag Pharma GmbH Tel: +43 1 610 300 |
España Janssen-Cilag, S.A. Tel: +34 91 722 81 00 | Polska Janssen-Cilag Polska Sp. z o.o. Tel.: +48 22 237 60 00 |
France Janssen-Cilag Tél: 0 800 25 50 75 / +33 1 55 00 40 03 | Portugal Janssen-Cilag Farmacêutica, Lda. Tel: +351 214 368 600 |
Hrvatska Johnson & Johnson S.E. d.o.o. Tel: +385 1 6610 700 | România Johnson & Johnson România SRL Tel: +40 21 207 1800 |
Ireland Janssen Sciences Ireland UC Tel: +353 1 800 709 122 | Slovenija Johnson & Johnson d.o.o. Tel: +386 1 401 18 00 |
Ísland Janssen-Cilag AB c/o Vistor hf. Sími: +354 535 7000 | Slovenská republika Johnson & Johnson, s.r.o. Tel: +421 232 408 400 |
Italia Janssen-Cilag SpA Tel: 800.688.777 / +39 02 2510 1 | Suomi/Finland Janssen-Cilag Oy Puh/Tel: +358 207 531 300 |
Κ?προς Βαρν?βας Χατζηπαναγ?ς Λτδ Τηλ: +357 22 207 700 | Sverige Janssen-Cilag AB Tfn: +46 8 626 50 00 |
Latvija UAB "JOHNSON & JOHNSON" filiale Latvija Tel: +371 678 93561 | United Kingdom(Northern Ireland) Janssen Sciences Ireland UC Tel: +44 1 494 567 444 |
Fecha de la última revisión de este prospecto: <{MM/AAAA}> <{mes AAAA}>.
Esta vacuna se ha autorizado en «circunstancias excepcionales». Esta modalidad de aprobación significa que, por motivos científicos, no ha sido posible obtener información completa de este medicamento. La Agencia Europea de Medicamentos revisará la información nueva de esta vacuna una vez al año y este prospecto se actualizará cuando sea necesario.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
--------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
- Como sucede con todas las vacunas inyectables, siempre debe haber disponible de forma inmediata tratamiento y supervisión médica adecuados por si se produce una reacción anafiláctica tras la administración de Mvabea. Los individuos deben permanecer en observación por un profesional sanitario durante al menos 15 minutos después de la vacunación.
- Mvabea no se debe mezclars con otros medicamentos en la misma jeringa.
- Mvabea no se debe administrar por inyección intravascular en ninguna circunstancia.
- La vacunación se debe realizar por inyección intramuscular (IM), preferiblemente en la región deltoidea del brazo o en el muslo.
- Se puede producir un síncope (desmayo) después, o incluso antes, de cualquier vacunación como respuesta psicógena a la inyección con aguja. Se debe contar con procedimientos para evitar las lesiones por caídas y para tratar las reacciones sincopales.
Instrucciones de administración y manipulación
Mvabea es una suspensión de color amarillo claro, entre clara y lechosa. Antes de la administración se debe realizar una inspección visual de la vacuna para descartar la presencia de partículas y de cambios de color. El vial se debe inspeccionar visualmente antes de la administración en busca de grietas o anomalías tales como indicios de manipulación. Si hay alguno de estos signos, no administre la vacuna.
Una vez retirada del congelador y descongelada, usar inmediatamente o guardar en la nevera a una temperatura de 2°C a 8°C (ver sección 6.4). Una vez retirada de la nevera para su administración se deberá utilizar inmediatamente.
Mezclar con suavidad el contenido del vial girándolo durante 10 segundos. No agitar. Utilizar una aguja estéril y una jeringa estéril para extraer todo el contenido del vial para su administración.
Utilizar una aguja y una jeringa estériles diferentes para cada persona. No es necesario cambiar la aguja utilizada para extraer la vacuna del vial antes de inyectarla al individuo, a menos que la aguja se haya dañado o contaminado. Se debe desechar todo el contenido que haya quedado en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. Los posibles vertidos se deberán desinfectar con agentes con actividad viricida frente al virus vaccinia.
Información sobre conservación
No utilice esta vacuna después de la fecha de caducidad que aparece en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Transportar congelado entre -25°C y -15°C. Una vez recibido, el producto se puede almacenar como se indica a continuación:
Conservar en congelador entre -85°C y -55°C en caso de almacenaje por el distribuidor. La fecha de caducidad cuando se conserva entre -85°C y -55°C está impresa en el vial y en la caja exterior después de CAD. El distribuidor o el usuario final también pueden conservar la vacuna en congelador entre -25°C y -15°C durante un período único de hasta 7 meses. Cuando se retire del congelador a temperatura entre -85°C y -55°C, el distribuidor o el usuario final deberá anotar la nueva fecha de caducidad en la caja exterior y la vacuna deberá usarse o desecharse al final de los 7 meses. Esta nueva fecha de caducidad no debe superar la fecha de caducidad original (CAD). La fecha de caducidad original se deberá hacer ilegible.
El distribuidor o el usuario final también pueden conservar la vacuna en nevera entre 2°C y 8°C durante un período único de hasta 1 mes. Cuando se cambie el producto a una temperatura de conservación entre 2°C y 8°C, el distribuidor o el usuario final deberá anotar la fecha de eliminación en la caja exterior y la vacuna se deberá usar o desechar al final del período de 1 mes. Esta fecha de eliminación no debe superar la fecha de caducidad original (CAD) ni la nueva fecha de caducidad asignada para las condiciones de conservación entre -25°C y -15°C. La fecha de caducidad original y/o la nueva fecha de caducidad asignada para la conservación entre -25°C y -15°C se deberán hacer ilegibles.
Una vez descongelada, la vacuna no se puede volver a congelar.
El vial se debe mantener en el envase original para protegerlo de la luz y para el seguimiento de la fecha de caducidad o de eliminación dependiendo de las diferentes condiciones de conservación.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a MVABEA SUSPENSION INYECTABLEForma farmacéutica: INYECTABLE, 0,50 mlPrincipio activo: ebola vaccinesFabricante: Janssen-Cilag International N.VRequiere recetaForma farmacéutica: INYECTABLE, 60 microgramos/dosis + 60 microgramos/dosisPrincipio activo: respiratory syncytial virus vaccinesFabricante: Pfizer Europe Ma EeigRequiere recetaForma farmacéutica: INYECTABLE, 0,5 MLPrincipio activo: respiratory syncytial virus vaccinesFabricante: Glaxosmithkline BiologicalsRequiere receta
Médicos online para MVABEA SUSPENSION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de MVABEA SUSPENSION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















