
Rivastigmina Aurovitas
Consulta con un médico sobre la receta médica de Rivastigmina Aurovitas

Cómo usar Rivastigmina Aurovitas
Hoja de instrucciones del paquete: información para el paciente
Rivastigmina Aurovitas, 4,6 mg/24 h, sistema transdérmico, parche
Rivastigmina Aurovitas, 9,5 mg/24 h, sistema transdérmico, parche
Rivastigminum
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Rivastigmina Aurovitas y para qué se utiliza
- 2. Información importante antes de usar Rivastigmina Aurovitas
- 3. Cómo usar Rivastigmina Aurovitas
- 4. Posibles efectos adversos
- 5. Cómo conservar Rivastigmina Aurovitas
- 6. Contenido del paquete y otra información
1. Qué es Rivastigmina Aurovitas y para qué se utiliza
El principio activo de Rivastigmina Aurovitas es la rivastigmina.
La rivastigmina pertenece a un grupo de sustancias llamadas inhibidores de la colinesterasa. En pacientes con
demencia de tipo Alzheimer, algunas células nerviosas en el cerebro mueren, lo que provoca una
disminución de la concentración de acetilcolina, un neurotransmisor (sustancia que permite la comunicación
entre las células nerviosas). La rivastigmina actúa bloqueando las enzimas que causan la degradación de la
acetilcolina: la acetilcolinesterasa y la butirilcolinesterasa. Al bloquear la acción de estas enzimas, la
rivastigmina permite aumentar la concentración de acetilcolina en el cerebro, lo que ayuda a aliviar los
síntomas de la enfermedad de Alzheimer.
Rivastigmina Aurovitas se utiliza para tratar a adultos con demencia de tipo Alzheimer leve a moderadamente
grave, una enfermedad cerebral progresiva que causa trastornos graduales de la memoria, la capacidad
intelectual y el comportamiento.
2. Información importante antes de usar Rivastigmina Aurovitas
Cuándo no usar Rivastigmina Aurovitas
- si el paciente es alérgico (hipersensible) a la rivastigmina (principio activo de Rivastigmina Aurovitas) o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
- si el paciente ha experimentado alguna reacción alérgica a medicamentos similares.
- si el paciente experimenta reacciones cutáneas que se extienden más allá del área del parche, si se produce un empeoramiento de las reacciones cutáneas locales (como ampollas, inflamación de la piel, hinchazón) y si los síntomas no desaparecen dentro de las 48 horas después de retirar el sistema transdérmico, el parche de la piel. Si esta situación se aplica al paciente, debe informar a su médico y no usar Rivastigmina Aurovitas, sistema transdérmico, parche.
Advertencias y precauciones
Antes de comenzar a usar Rivastigmina Aurovitas, debe discutirlo con su médico:
- si el paciente tiene o ha tenido un ritmo cardíaco irregular o lento.
- si el paciente tiene o ha tenido un úlcera estomacal activo.
- si el paciente tiene o ha tenido dificultades para orinar.
- si el paciente tiene o ha tenido convulsiones.
- si el paciente tiene o ha tenido asma o enfermedad respiratoria grave.
- si el paciente tiene temblores musculares.
- si el paciente tiene un peso corporal bajo.
- si el paciente experimenta efectos adversos gastrointestinales, como náuseas (vómitos), vómitos y diarrea. El paciente puede deshidratarse (perder demasiado líquido) si los vómitos o la diarrea persisten durante un período prolongado.
- si el paciente tiene trastornos hepáticos.
Si alguna de estas situaciones se aplica al paciente, durante el uso de este medicamento, puede ser necesario un control cuidadoso del estado del paciente por parte del médico.
Si el paciente no ha aplicado el parche durante más de tres días, no debe aplicar otro parche hasta que haya hablado con su médico.
Niños y adolescentes
El uso de Rivastigmina Aurovitas en niños y adolescentes no es adecuado para el tratamiento de la demencia de tipo Alzheimer.
Rivastigmina Aurovitas y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Rivastigmina Aurovitas puede afectar la acción de los medicamentos anticolinérgicos, como los medicamentos utilizados para aliviar los espasmos estomacales (por ejemplo, dicicloverina), para tratar la enfermedad de Parkinson (por ejemplo, amantadina) o para prevenir el mareo (por ejemplo, difenhidramina, escopolamina o meclizina).
No debe usar Rivastigmina Aurovitas, sistema transdérmico, parche, al mismo tiempo que metoclopramida (un medicamento utilizado para aliviar o prevenir las náuseas y los vómitos). La combinación de estos dos medicamentos puede causar trastornos como rigidez de las extremidades y temblores de las manos.
Si el paciente va a someterse a una operación mientras está tomando Rivastigmina Aurovitas, sistema transdérmico, parche, debe informar a su médico sobre su uso, ya que este medicamento puede aumentar la acción de algunos relajantes musculares utilizados durante la anestesia.
Debe tener cuidado cuando Rivastigmina Aurovitas, sistema transdérmico, parche, se usa en combinación con medicamentos beta-adrenolíticos (medicamentos como el atenolol, utilizados para tratar la hipertensión, el dolor en el pecho y otras enfermedades cardíacas). La combinación de estos dos medicamentos puede causar trastornos como una disminución de la frecuencia cardíaca (bradicardia) que puede llevar a desmayos o pérdida de conciencia.
Rivastigmina Aurovitas con alimentos, bebidas y alcohol
Rivastigmina Aurovitas puede usarse con alimentos, bebidas y alcohol.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Si la paciente está embarazada, debe evaluarse la relación beneficio/riesgo del uso de Rivastigmina Aurovitas en relación con los posibles efectos del medicamento en el feto. Rivastigmina Aurovitas no debe usarse durante el embarazo a menos que sea absolutamente necesario.
Durante el uso de Rivastigmina Aurovitas, sistema transdérmico, parche, no debe amamantar.
Conducción de vehículos y uso de máquinas
El médico informará al paciente si su estado de salud le permite conducir vehículos y usar máquinas. Rivastigmina Aurovitas, sistema transdérmico, parche, puede causar mareos o confusión severa. Si el paciente se siente débil o desorientado, no debe conducir vehículos, usar máquinas ni realizar ninguna otra tarea que requiera concentración.
3. Cómo usar Rivastigmina Aurovitas
Rivastigmina Aurovitas, sistema transdérmico, parche, siempre debe usarse según las indicaciones de su médico. Si tiene alguna duda, debe consultar a su médico o farmacéutico.
ATENCIÓN:
- Antes de aplicar UN NUEVO parche, debe retirar el parche anterior.
- Debe aplicar solo UN parche al día.
- No debe cortar el parche en trozos más pequeños.
- Debe presionar firmemente el parche con la palma de la mano y mantenerlo durante al menos
30 segundos.
Cómo iniciar el tratamiento
El médico informará al paciente qué Rivastigmina Aurovitas, sistema transdérmico, parche, es el más adecuado para su caso.
- El tratamiento generalmente comienza con Rivastigmina Aurovitas, 4,6 mg/24 h.
- La dosis diaria recomendada es generalmente un parche de Rivastigmina Aurovitas, 9,5 mg/24 h al día.
- Debe aplicar solo un parche de Rivastigmina Aurovitas a la vez y cambiarlo por uno nuevo después de 24 horas. Durante el tratamiento, el médico puede ajustar la dosis del medicamento según las necesidades del paciente.
Si el paciente no ha aplicado el parche durante más de tres días, no debe aplicar otro parche hasta que haya hablado con su médico. El tratamiento con parches puede reanudarse usando la misma dosis, si la pausa en el tratamiento no ha superado los tres días. De lo contrario, el médico recomendará reanudar el tratamiento con una dosis de 4,6 mg/24 h de Rivastigmina Aurovitas.
Dónde aplicar el parche de Rivastigmina Aurovitas, sistema transdérmico, parche
- Antes de aplicar el parche, debe asegurarse de que la piel en el lugar de aplicación esté:
- limpia, seca y sin vello,
- libre de polvos, aceites, cremas hidratantes o líquidos que puedan impedir la adhesión adecuada del parche,
- libre de cortes, erupciones y (o) irritaciones.
- Debe retirar cualquier parche adherido antes de aplicar uno nuevo.Una mayor cantidad de parches en el cuerpo puede exponer al paciente a una cantidad excesiva de medicamento, lo que puede ser potencialmente peligroso.
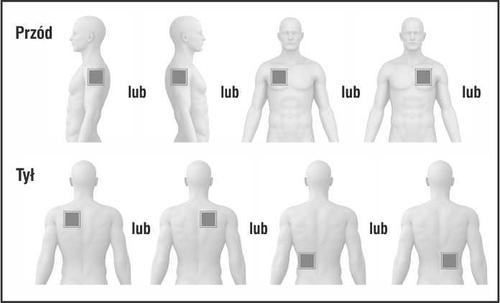
- Debe aplicar UNparche al día en SOLO UNOde los lugares posibles indicados en los dibujos siguientes:
- parte superior del brazo izquierdo oparte superior del brazo derecho
- parte superior del pecho a la izquierda oa la derecha (debe evitar aplicar parches en el pecho)
- parte superior de la espalda a la izquierda oa la derecha
- parte inferior de la espalda a la izquierda oa la derecha
Después de 24 horas, debe retirar el parche antiguo antes de aplicar UN NUEVO parche en SOLO UNO de los lugares posibles indicados a continuación.
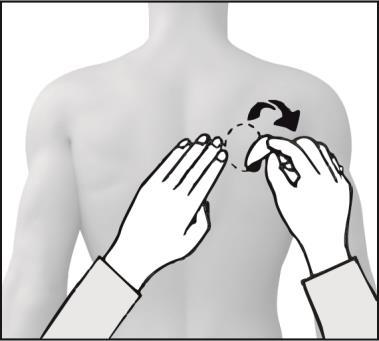
Al cambiar el parche, debe retirar el parche del día anterior antes de aplicar uno nuevo en un lugar diferente (por ejemplo, un día en el lado derecho del cuerpo y al día siguiente en el lado izquierdo, un día en la parte superior del cuerpo y al día siguiente en la parte inferior). No debe aplicar un nuevo parche en el mismo lugar de la piel antes de que hayan pasado 14 días.
Cómo aplicar Rivastigmina Aurovitas, sistema transdérmico, parche
Rivastigmina Aurovitas tiene la forma de parches de plástico delgados y opacos que se adhieren a la piel. Cada parche se encuentra en una bolsa de protección sellada. No debe abrir la bolsa ni retirar el parche hasta el momento de aplicarlo en la piel.
Debe retirar cuidadosamente el parche antes de aplicar uno nuevo.
Los pacientes que comienzan el tratamiento por primera vez y los pacientes que reanudan el tratamiento con Rivastigmina Aurovitas después de una pausa, deben comenzar con las acciones mostradas en el segundo dibujo.
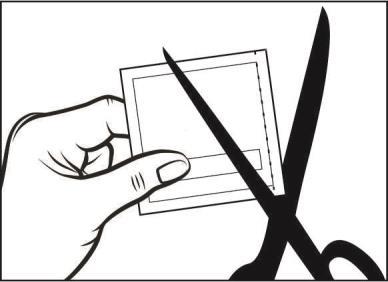
- Cada parche se encuentra en una bolsa de protección sellada. La bolsa debe abrirse justo antes de aplicar el parche en la piel. Debe cortar la bolsa con tijeras a lo largo del borde en el lugar marcado con una línea discontinua, y luego retirar el parche de la bolsa.
- La capa adhesiva del parche está protegida por una capa de protección. Debe retirar una parte de la capa de protección, sin tocar la superficie adhesiva del parche.
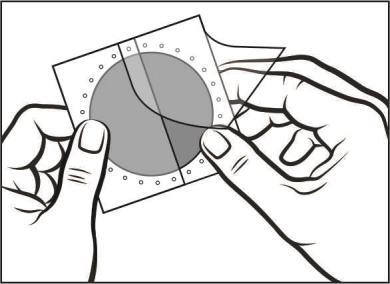
- Debe aplicar la superficie adhesiva del parche a la parte superior o inferior de la espalda, la parte superior del brazo o el pecho, y luego retirar la segunda parte de la capa de protección.
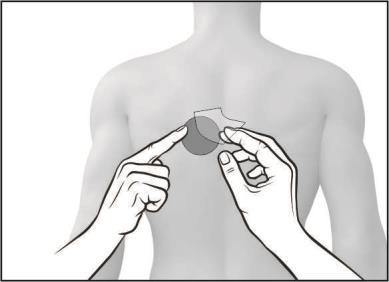
- Debe presionar firmemente el parche con la palma de la mano durante al menos 30 segundos, asegurándose de que los bordes se adhieran bien a la piel.
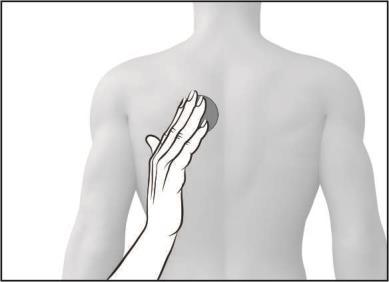
Si es necesario, puede escribir con un bolígrafo en el parche el día de la semana en que se aplica.
Debe usar el parche constantemente hasta el momento de cambiarlo por uno nuevo. El paciente puede probar diferentes lugares de aplicación del nuevo parche para determinar cuál es el más conveniente y no está expuesto a ser arrancado por la ropa.
Cómo retirar Rivastigmina Aurovitas
Debe retirar suavemente el parche por un borde y luego despegarlo de la piel. Si quedan restos de adhesivo en la piel, puede retirarlos lavando el área con agua tibia y jabón suave o aceite para bebés. No debe usar alcohol o otros disolventes (quitaesmaltes y otros productos).
Después de retirar el parche, debe lavar sus manos con agua y jabón. Si el medicamento entra en contacto con los ojos o si experimenta enrojecimiento ocular después del contacto con el parche, debe enjuagar los ojos con grandes cantidades de agua, y si los síntomas no desaparecen, debe consultar a un médico.
Puede el paciente usar Rivastigmina Aurovitas, sistema transdérmico, parche, mientras se baña, nada o está al sol?
- El baño, la natación o la ducha no deben afectar la acción del parche. Debe asegurarse de que el parche no se suelte durante estas actividades.
- No debe exponer el parche a fuentes externas de calor (por ejemplo, calor excesivo del sol, sauna, solárium) durante períodos prolongados.
Qué hacer si el parche se suelta?
Si el parche se suelta, debe aplicar uno nuevo por el resto del día y luego cambiarlo a la hora habitual del día siguiente.
Cuándo y durante cuánto tiempo debe usar el paciente Rivastigmina Aurovitas, sistema transdérmico, parche?
- Para que el tratamiento sea efectivo, debe aplicar un nuevo parche todos los días, preferiblemente a la misma hora cada día.
- Debe aplicar solo un parche de Rivastigmina Aurovitas a la vez y cambiarlo por uno nuevo cada 24 horas.
Uso de una dosis mayor de la recomendada de Rivastigmina Aurovitas
Si el paciente aplica accidentalmente más de un parche, debe retirar todos los parches y luego informar a su médico sobre la aplicación accidental de más de un parche. El paciente puede necesitar atención médica. En algunos pacientes que han tomado accidentalmente demasiado Rivastigmina Aurovitas, han experimentado náuseas (vómitos), vómitos, diarrea, presión arterial alta y alucinaciones. También puede ocurrir una disminución de la frecuencia cardíaca y desmayos.
Olvido de la aplicación de Rivastigmina Aurovitas
Si el paciente olvida aplicar un parche, debe hacerlo lo antes posible. El parche siguiente se puede aplicar a la hora habitual del día siguiente. No debe aplicar dos parches para compensar una dosis olvidada.
Interrupción del tratamiento con Rivastigmina Aurovitas
Si interrumpe el tratamiento con el parche, debe informar a su médico o farmacéutico.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Rivastigmina Aurovitas puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los efectos adversos pueden ocurrir con más frecuencia durante el período inicial de tratamiento o durante el aumento de la dosis. Los efectos adversos generalmente desaparecen gradualmente a medida que el organismo del paciente se adapta al tratamiento.
Si experimenta alguno de los siguientes efectos adversos, debe retirar el parche y consultar inmediatamente a su médico, ya que pueden ser graves:
Frecuentes(pueden afectar a menos de 1 de cada 10 pacientes)
- Pérdida de apetito
- Mareos
- Agitación o somnolencia
- Incontinencia urinaria (incapacidad para retener la orina)
Poco frecuentes(pueden afectar a menos de 1 de cada 100 pacientes)
- Trastornos del ritmo cardíaco, como una frecuencia cardíaca lenta
- Alucinaciones
- Úlcera estomacal
- Deshidratación (pérdida excesiva de líquido)
- Agitación excesiva
- Agresividad
Raros(pueden afectar a menos de 1 de cada 1.000 pacientes)
- Caidas
Muy raros(pueden afectar a menos de 1 de cada 10.000 pacientes)
- Rigidez de brazos o piernas
- Temblores de las manos
Frecuencia desconocida(no puede ser establecida a partir de los datos disponibles)
- Reacción de hipersensibilidad en el lugar de aplicación, como ampollas o inflamación de la piel
- Empeoramiento de los síntomas de la enfermedad de Parkinson, como temblores, rigidez o dificultad para caminar
- Pancreatitis - con síntomas como dolor abdominal superior severo, a menudo con náuseas (vómitos) o vómitos
- Frecuencia cardíaca rápida o irregular
- Presión arterial alta
- Convulsiones
- Trastornos hepáticos (con síntomas como ictericia, orina oscura o fatiga inexplicable)
- Cambios en los resultados de las pruebas hepáticas
- Ansiedad
- Pesadillas
Si experimenta alguno de los efectos adversos mencionados, debe retirar el parche y consultar inmediatamente a su médico.
Otros efectos adversos informados después de la administración de rivastigmina en forma de cápsulas o solución oral, que pueden ocurrir después de la aplicación de rivastigmina, sistema transdérmico, parche:
Frecuentes(pueden afectar a menos de 1 de cada 10 pacientes)
- Salivación excesiva
- Pérdida de apetito
- Ansiedad
- Malestar general
- Temblores o confusión
- Sudoración excesiva
Poco frecuentes(pueden afectar a menos de 1 de cada 100 pacientes)
- Trastornos del ritmo cardíaco (por ejemplo, frecuencia cardíaca rápida)
- Dificultades para dormir
- Caidas accidentales
Raros(pueden afectar a menos de 1 de cada 1.000 pacientes)
- Convulsiones
- Enfermedad ulcerosa intestinal
- Dolor en el pecho - que puede ser causado por un espasmo cardíaco
Muy raros(pueden afectar a menos de 1 de cada 10.000 pacientes)
- Presión arterial alta
- Pancreatitis - con síntomas como dolor abdominal superior severo, a menudo con náuseas (vómitos) o vómitos
- Hemorragias gastrointestinales - con sangre en las heces o vómitos
- Alucinaciones
- Vómitos severos que pueden llevar a una ruptura del esófago.
Información de efectos adversos
Si experimenta alguno de los efectos adversos mencionados, o cualquier otro efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico, o enfermera. Los efectos adversos pueden ser notificados directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
5. Cómo conservar Rivastigmina Aurovitas
- Este medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
- No debe usar Rivastigmina Aurovitas después de la fecha de caducidad impresa en el paquete y la bolsa después de: EXP. “EXP” significa el último día del mes indicado.
- Antes de usar, debe conservar el sistema transdérmico, parche, en la bolsa.
- Debe conservar en el embalaje original para protegerlo de la luz.
- No debe usar un parche que esté dañado o que muestre signos de haber sido abierto.
- Después de retirar el parche, debe doblarlo por la mitad con la superficie adhesiva hacia adentro y presionarlo firmemente. Debe colocar el parche usado en la bolsa y luego desecharlo en un lugar inaccesible para los niños. Después de retirar el parche, no debe tocar los ojos con los dedos antes de lavar las manos con agua y jabón. Si las regulaciones locales de protección del medio ambiente permiten la incineración de residuos domésticos, puede tirar el parche a la basura. De lo contrario, los parches usados deben devolverse a la farmacia, preferiblemente en el embalaje original.
6. Contenido del paquete y otra información
Qué contiene Rivastigmina Aurovitas?
El principio activo es la rivastigmina.
Rivastigmina Aurovitas, 4,6 mg/24 h: cada parche libera 4,6 mg de rivastigmina en un período de 24 horas. Cada parche tiene un área de 5 cm y contiene 9 mg de rivastigmina.
Rivastigmina Aurovitas 9,5 mg/24 h: cada parche libera 9,5 mg de rivastigmina en un período de 24 horas. Cada parche tiene un área de 10 cm y contiene 18 mg de rivastigmina.
Los demás componentes son:
Capa que contiene el principio activo:
Capa adhesiva de acrilato
Copolímero de metacrilato de butilo y metil metacrilato
Capa adhesiva:
Capa adhesiva de silicona
Capas externas:
Poliéster
Poliéster recubierto de fluor
Cómo es Rivastigmina Aurovitas y qué contiene el paquete?
Cada sistema transdérmico, parche, es un parche delgado que consta de tres capas. La capa externa de la capa adhesiva es semitransparente, blanca con la inscripción: “Rivastigmina Aurovitas” y “4,6 mg/24 h” o “Rivastigmina Aurovitas” y “9,5 mg/24 h”.
Cada sistema transdérmico, parche, se encuentra en una bolsa individual sellada. Los parches están disponibles en paquetes que contienen 30 bolsas.
No todos los tamaños de paquete pueden estar disponibles.
Titular de la autorización de comercialización
Aurovitas Pharma Polska Sp. z o.o.
ul. Sokratesa 13D lok. 27
01-909 Warszawa
Polonia
Fabricante
Eurofins PHAST GmbH
Kardinal-Wendel-Strasse 16
66424 Homburg
Alemania
ACC GmbH Analytical Clinical Concepts
Schöntalweg 9
63849 Leidersbach
Alemania
Fecha de la última actualización de la hoja de instrucciones: 09.2020
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorACC GmbH Analytical Clinical Concepts Eurofins PHAST GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Rivastigmina AurovitasForma farmacéutica: Sistema, 4,6 mg/24 hPrincipio activo: RivastigminaFabricante: Luye Pharma AGRequiere recetaForma farmacéutica: Sistema, 9,5 mg/24 hPrincipio activo: RivastigminaFabricante: Luye Pharma AGRequiere recetaForma farmacéutica: Sistema, 4,6 mg/24 hPrincipio activo: RivastigminaRequiere receta
Alternativas a Rivastigmina Aurovitas en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Rivastigmina Aurovitas en España
Alternativa a Rivastigmina Aurovitas en Ucrania
Médicos online para Rivastigmina Aurovitas
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Rivastigmina Aurovitas – sujeta a valoración médica y normativa local.











