

Rivastigmine Milan

Consulta con un médico sobre la receta médica de Rivastigmine Milan

Cómo usar Rivastigmine Milan
Hoja de instrucciones del paquete: información para el usuario
Rivastigmine Mylan, 4,6 mg/24 h, sistema transdérmico, parche
Rivastigmine Mylan, 9,5 mg/24 h, sistema transdérmico, parche
Rivastigmina
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Rivastigmine Mylan y para qué se utiliza
- 2. Información importante antes de usar Rivastigmine Mylan
- 3. Cómo usar Rivastigmine Mylan
- 4. Posibles efectos adversos
- 5. Cómo conservar Rivastigmine Mylan
- 6. Contenido del paquete y otra información
1. Qué es Rivastigmine Mylan y para qué se utiliza
El principio activo de Rivastigmine Mylan es la rivastigmina.
La rivastigmina pertenece a un grupo de sustancias llamadas inhibidores de la colinesterasa. En pacientes
con demencia de tipo Alzheimer, se produce una disminución del número de células nerviosas
en el cerebro, lo que provoca una disminución de la concentración de acetilcolina, un neurotransmisor
(sustancia que permite la comunicación entre las células nerviosas). El efecto de la rivastigmina
consiste en bloquear las enzimas que causan la degradación de la acetilcolina: la acetilcolinesterasa
y la butirilcolinesterasa. Al bloquear el efecto de estas enzimas, la rivastigmina permite aumentar
la concentración de acetilcolina en el cerebro, lo que ayuda a aliviar los síntomas de la enfermedad
de Alzheimer.
Rivastigmine Mylan se utiliza para tratar a adultos con demencia de tipo Alzheimer leve a moderada,
una enfermedad cerebral progresiva que alterna gradualmente la memoria, las capacidades intelectuales
y el comportamiento.
2. Información importante antes de usar Rivastigmine Mylan
Cuándo no usar Rivastigmine Mylan
- si el paciente es alérgico a la rivastigmina (principio activo de Rivastigmine Mylan) o a alguno de los demás componentes de este medicamento (enumerados en el punto 6);
- si el paciente tiene una reacción alérgica a medicamentos similares (derivados de la carbamamina);
- si el paciente tiene una reacción cutánea que se extiende más allá del área de la piel cubierta por el parche, si se ha exacerbado la reacción local (por ejemplo, han aparecido ampollas, se ha agravado la inflamación de la piel, se ha producido hinchazón) o si estos cambios no han desaparecido dentro de las 48 horas después de retirar el parche.
Si se aplica alguna de estas situaciones al paciente, debe informar a su médico y no debe aplicar el parche
de Rivastigmine Mylan.
Precauciones y advertencias
Antes de comenzar a usar Rivastigmine Mylan, debe discutir con su médico o farmacéutico si:
- el paciente tiene o ha tenido enfermedades cardíacas, como un ritmo cardíaco irregular o lento, prolongación del intervalo QT, prolongación del intervalo QT en la familia, torsade de pointes, o niveles bajos de potasio o magnesio en la sangre;
- el paciente tiene insuficiencia cardíaca;
- el paciente ha tenido un infarto de miocardio;
- el paciente tiene o ha tenido niveles bajos de potasio o magnesio en la sangre;
- el paciente ha tenido una úlcera gástrica activa;
- el paciente tiene o ha tenido dificultades para orinar;
- el paciente tiene o ha tenido convulsiones;
- el paciente tiene o ha tenido asma o enfermedad respiratoria grave;
- el paciente tiene temblores musculares;
- el paciente tiene un peso corporal bajo;
- el paciente tiene reacciones gastrointestinales, como náuseas (vómitos), vómitos y diarrea. El paciente puede deshidratarse (perder demasiado líquido) si los vómitos o la diarrea persisten durante un período prolongado;
- el paciente tiene trastornos hepáticos.
Si alguna de estas situaciones se aplica al paciente, puede ser necesaria una observación más cercana
del paciente por parte del médico durante el uso de este medicamento.
Niños y adolescentes
El uso de Rivastigmine Mylan en niños y adolescentes no es adecuado para el tratamiento de la enfermedad
de Alzheimer.
Rivastigmine Mylan y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente
o que planea tomar, incluyendo aquellos que se venden sin receta.
Rivastigmine Mylan puede aumentar el efecto de algunos medicamentos que reducen la presión arterial, como
los "beta-bloqueantes", como el atenolol, los "antagonistas de los canales de calcio", como la amlodipina,
la nifedipina, los "medicamentos antiarrítmicos", como el sotalol, el amiodarona, los glicósidos del digital
y la pilocarpina (utilizada para tratar el glaucoma). Esto puede provocar mareos.
Debe tener cuidado al usar Rivastigmine Mylan con otros medicamentos que puedan afectar el ritmo cardíaco
o el sistema de conducción cardíaca (prolongación del intervalo QT).
Si el paciente está tomando alguno de los siguientes medicamentos, el médico puede realizar exámenes cardíacos
regulares para asegurarse de que el corazón funcione correctamente:
- medicamentos utilizados para tratar trastornos psiquiátricos, conocidos como "medicamentos antipsicóticos", como la clorpromazina, la lepromazina, la sulpirida, la amisulprida, la tiaprida, la veraliprida, la pimozida, la haloperidol, el droperidol,
- el cisaprida (utilizado para tratar la dispepsia),
- el citalopram (utilizado para tratar la depresión),
- el difemanil (utilizado para tratar la úlcera duodenal),
- la halofantrina (utilizada para tratar la malaria),
- la mizolastina (utilizada para tratar la alergia),
- la metadona (medicamento para el dolor, también utilizado para tratar la adicción a la heroína),
- la eritromicina i.v., la pentamidina, la moxifloxacina (antibióticos).
Rivastigmine Mylan puede afectar el efecto de los medicamentos anticolinérgicos, algunos de los cuales
se utilizan para aliviar los espasmos del estómago (por ejemplo, la dicyclomina), para tratar la enfermedad
de Parkinson (por ejemplo, la amantadina), para tratar la sensibilidad de la vejiga (por ejemplo, la oxicodona,
la tolterodina) o para prevenir el mareo (por ejemplo, la difenhidramina, la escopolamina o la meclizina).
No debe usar Rivastigmine Mylan al mismo tiempo que el metoclopramida (medicamento utilizado
para aliviar o prevenir las náuseas y los vómitos). La ingesta simultánea de estos dos medicamentos puede
causar trastornos como la rigidez de las extremidades y el temblor de las manos.
Si el paciente va a someterse a una operación mientras está tomando Rivastigmine Mylan, debe informar
a su médico, ya que puede ser necesario suspender su uso, ya que puede aumentar el efecto de algunos
medicamentos relajantes musculares administrados durante la anestesia.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener
un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Si la paciente está embarazada, debe evaluarse el beneficio del uso de Rivastigmine Mylan en relación
con los posibles efectos del medicamento en el feto. Rivastigmine Mylan no debe usarse durante el embarazo
a menos que sea absolutamente necesario.
Mientras esté tomando Rivastigmine Mylan, no debe amamantar.
Conducción de vehículos y uso de maquinaria
El médico informará al paciente si su condición le permite conducir vehículos y operar maquinaria de manera
segura. Rivastigmine Mylan puede causar mareos o confusión intensa. Si el paciente se siente débil o desorientado,
no debe conducir vehículos, operar maquinaria ni realizar otras tareas que requieran concentración.
3. Cómo usar Rivastigmine Mylan
Este medicamento debe usarse siempre exactamente como lo indicó su médico o farmacéutico. En caso
de dudas, debe consultar a su médico o farmacéutico.
ADVERTENCIA:
- Antes de aplicar UN NUEVO parche, debe retirar el parche anterior.
- Debe usar solo UN parche de Rivastigmine Mylan al día.
- No debe cortar el parche en trozos más pequeños.
- Debe presionar firmemente el parche con la palma de la mano y mantenerlo durante al menos
30 segundos.
- Debe evitar tocar los ojos después de aplicar el parche.
Cómo iniciar el tratamiento
El médico informará al paciente qué parches de Rivastigmine Mylan son los mejores para su caso.
- El tratamiento generalmente comienza con Rivastigmine Mylan 4,6 mg/24 h.
- La dosis diaria recomendada de Rivastigmine Mylan es de 9,5 mg/24 h. Si el estado del paciente no mejora después de al menos 6 meses, el médico puede considerar aumentar la dosis a 13,3 mg/24 h (no se puede obtener una dosis de 13,3 mg/24 h con este producto). En caso de enfermedades que requieran una dosis tan alta, debe consultar a un farmacéutico.
- Debe aplicar solo un parche a la vez y cambiarlo por uno nuevo cada 24 horas.
Durante el tratamiento, el médico puede ajustar la dosis del medicamento según las necesidades del paciente.
Si el paciente no ha aplicado un parche durante tres días o más, no debe aplicar el siguiente parche hasta
que haya hablado con su médico, ya que puede estar más expuesto a efectos adversos. El tratamiento puede
reanudarse con la misma dosis si la pausa en el tratamiento no supera los tres días. De lo contrario, el médico
puede recomendar continuar el tratamiento con una dosis de 4,6 mg/24 h de Rivastigmine Mylan.
Dónde aplicar el parche de Rivastigmine Mylan
- Antes de aplicar el parche, debe asegurarse de que la piel en el lugar de la aplicación esté limpia, seca y sin vello, libre de polvo, aceites, cremas hidratantes o líquidos que puedan impedir la adhesión adecuada del parche, sin cortes, erupciones o irritaciones,
- Debe retirar cualquier parche adherido antes de aplicar uno nuevo.La aplicación de varios parches en la piel puede exponer al paciente a una cantidad excesiva de medicamento, lo que puede ser peligroso.
- Debe aplicar UN parche al día en SOLAMENTE UNO de los siguientes lugares, como se muestra en las ilustraciones:
- parte superior del brazo izquierdo oparte superior del brazo derecho
- parte superior del pecho a la izquierda oa la derecha (debe evitar aplicar parches en el pecho)
- parte superior de la espalda a la izquierda oa la derecha
- parte inferior de la espalda a la izquierda oa la derecha
Después de 24 horas, debe retirar el parche antiguo antes de aplicar UN NUEVO parche en SOLAMENTE UNO de los lugares mostrados.
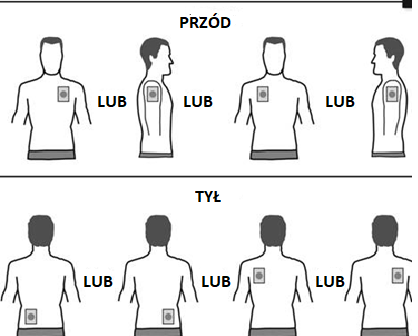
Al cambiar el parche, debe retirar el parche del día anterior antes de aplicar un nuevo parche en un lugar diferente (por ejemplo, un día en el lado derecho del cuerpo y al día siguiente en el lado izquierdo, un día en el pecho o en la parte superior del cuerpo y al día siguiente en la parte inferior de la espalda). No debe aplicar un parche en el mismo lugar antes de que hayan pasado 14 días.
Cómo aplicar los parches de Rivastigmine Mylan
Rivastigmine Mylan es un parche transdérmico delgado y de color marrón claro hecho de material plástico
que se adhiere a la piel. Cada parche se encuentra en una bolsa de protección sellada. No debe abrir la bolsa
ni retirar el parche de la bolsa hasta el momento de aplicarlo en la piel.
Debe retirar cuidadosamente el parche antes de aplicar uno nuevo.
Los pacientes que comienzan el tratamiento (por primera vez) y los pacientes que reanudan el tratamiento
con rivastigmina después de una pausa, deben comenzar con las acciones mostradas en la segunda
ilustración.
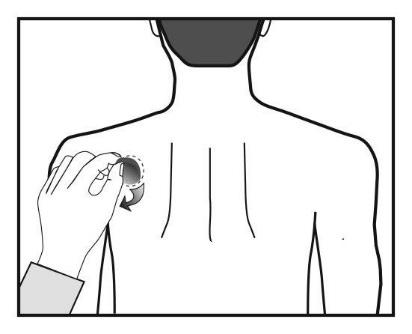
Cada parche se encuentra en una bolsa de protección sellada. La bolsa debe abrirse justo antes de usar el parche.
Debe cortar la bolsa en los dos lugares marcados con tijeras, pero no más allá de la línea indicada. Debe perforar
la bolsa para abrirla. No debe cortar la bolsa a lo largo de toda su longitud para evitar dañar el parche.
Debe retirar el parche de la bolsa.
Debe retirar la cubierta (de color carne) de la parte superior del parche y desecharla.
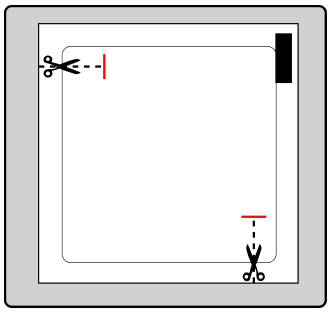
La parte adhesiva del parche está protegida por una capa de protección.
Debe retirar una parte de la capa de protección sin tocar la parte adhesiva del parche.
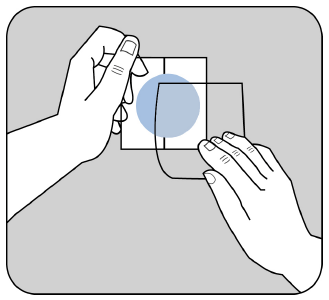
Debe aplicar la parte adhesiva del parche en la parte superior o inferior de la espalda, en la parte superior
del brazo o en el pecho, y luego retirar la segunda parte de la capa de protección.
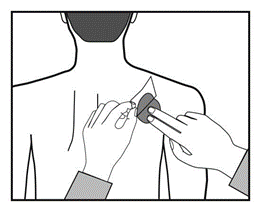
Debe presionar el parche firmemente con la palma de la mano durante al menos 30 segundos, asegurándose
de que los bordes se adhieran bien a la piel.
Puede firmar el parche con un bolígrafo, por ejemplo, con el nombre del día de la semana.
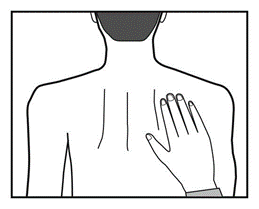
Debe usar el parche constantemente hasta el momento de cambiarlo por uno nuevo. El paciente puede probar
diferentes lugares para aplicar el nuevo parche (seleccionando de los indicados anteriormente) para elegir
el más conveniente y menos propenso a ser arrancado por la ropa.
Cómo retirar el parche de Rivastigmine Mylan
Debe tirar suavemente de un borde del parche y retirarlo lentamente de la piel. Si quedan restos de adhesivo
en la piel, puede retirarlos lavando el área con agua tibia y jabón suave o aceite para bebés. No debe usar
alcohol ni otros disolventes (quitaesmalte de uñas y otros productos).
Lavado de manos
Después de retirar o aplicar el parche, debe lavar sus manos con agua y jabón. En caso de contacto con los ojos
o enrojecimiento de los ojos después del contacto con el parche, debe enjuagar los ojos con abundante agua,
y si los síntomas no desaparecen, debe consultar a un médico.
Puede el paciente usar los parches de Rivastigmine Mylan mientras se baña, nada o está al sol?
- El baño, la natación o la ducha no deben afectar el funcionamiento del parche. Debe asegurarse de que durante
estas actividades no se suelte el parche. - No debe exponer el parche a fuentes externas de calor durante períodos prolongados (por ejemplo, calor excesivo del sol, sauna, solárium).
Qué hacer si el parche se suelta?
Si el parche se suelta, debe aplicar uno nuevo por el resto del día y cambiarlo a la hora habitual del día siguiente.
Cuándo y durante cuánto tiempo debe el paciente usar los parches de Rivastigmine Mylan?
- Para que el tratamiento sea efectivo, debe aplicar un nuevo parche cada día, preferiblemente a la misma hora cada día.
- Debe aplicar solo un parche de Rivastigmine Mylan a la vez y cambiarlo por uno nuevo cada 24 horas.
Uso de una dosis mayor de la recomendada de Rivastigmine Mylan
Si el paciente por error aplica más de un parche, debe retirar todos los parches y luego informar a su médico
sobre la aplicación accidental de más de un parche. El paciente puede necesitar atención médica.
En algunas personas que han aplicado accidentalmente demasiada rivastigmina, se han producido efectos adversos
como la reducción del tamaño de las pupilas (miopía), enrojecimiento de la piel y sensación de calor (olas de calor),
dolor abdominal, náuseas, vómitos, diarrea, ritmo cardíaco lento, dificultades respiratorias repentinas (broncoespasmo),
producción excesiva de moco, sudoración excesiva, pérdida del control de las funciones corporales, llanto, presión arterial baja,
aumento de la salivación, mareos, temblores, dolor de cabeza, somnolencia, confusión, presión arterial alta, alucinaciones
y falta de energía. En casos graves, se han observado debilidad muscular, espasmos musculares, convulsiones y ralentización
o detención de la respiración.
Olvido de la aplicación de Rivastigmine Mylan
Si el paciente descubre que ha olvidado aplicar un parche, debe inmediatamentehacerlo. El parche siguiente
puede aplicarse a la hora habitual del día siguiente. No debe aplicar dos parches para compensar la dosis olvidada.
Suspensión del tratamiento con Rivastigmine Mylan
En caso de suspensión del tratamiento, debe informar a su médico o farmacéutico.
Si el paciente no ha aplicado un parche durante tres días o más, no debe aplicar uno nuevo antes de consultar
a su médico, ya que es más probable que se produzcan efectos adversos.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como todos los medicamentos, este medicamento puede causar efectos adversos, aunque no todos los pacientes
los experimentarán.
Los efectos adversos se producen con más frecuencia en el período inicial de tratamiento o durante el aumento
de la dosis. Los efectos adversos generalmente desaparecen lentamente a medida que el organismo se adapta
al tratamiento.
En caso de que se produzca alguno de los siguientes efectos adversos, debe retirar el parche y informar inmediatamente a su médico, ya que estos efectos pueden ser graves:
- convulsiones
- cambios en el ritmo cardíaco, que pueden observarse como un latido cardíaco muy rápido o una sensación de latidos cardíacos perdidos
- úlceras gástricas (el paciente puede experimentar dolor abdominal y los vómitos pueden contener sangre fresca o parecer tener un aspecto similar al de los posos de café)
- pancreatitis - los síntomas incluyen un dolor abdominal superior intenso, a menudo con náuseas o vómitos
- una sensación de confusión intensa, que puede estar acompañada de alucinaciones (ver, oír o sentir cosas que no existen), pérdida de contacto con la realidad (delirio) y aumento o disminución de la actividad (delirium)
- trastornos hepáticos (el paciente puede experimentar un cambio en el color de la piel, un cambio en el color de los ojos, un oscurecimiento anormal de la orina o náuseas sin causa aparente, vómitos, fatiga y pérdida de apetito)
Otros efectos adversos:
Frecuentes(pueden afectar a 1 de cada 10 pacientes):
- dolor de cabeza
- falta de apetito o pérdida de apetito, pérdida de peso
- sensación de ansiedad, depresión, mareos
- mareos
- náuseas, vómitos, diarrea, dispepsia/acidez, dolor abdominal
- agitación, fatiga, debilidad general, fiebre
- erupciones cutáneas y reacciones alérgicas cutáneas, como reacciones similares al eczema, enrojecimiento, picazón, hinchazón y irritación
- infección del tracto urinario (puede producirse dolor al orinar o una frecuencia urinaria más alta de lo normal)
- incontinencia urinaria (incapacidad para retener la orina)
No muy frecuentes(pueden afectar a 1 de cada 100 pacientes):
- problemas cardíacos, como un ritmo cardíaco lento
- deshidratación (pérdida excesiva de líquidos)
- agitación (un nivel alto de actividad, ansiedad)
- agresividad
Raros(pueden afectar a 1 de cada 1000 pacientes):
- mareos
Muy raros(pueden afectar a 1 de cada 10 000 pacientes):
- rigidez de brazos o piernas, ansiedad, espasmos musculares, temblores, como temblores de las manos
Frecuencia no conocida(la frecuencia no puede determinarse a partir de los datos disponibles):
- reacción alérgica, como ampollas o inflamación de la piel, picazón, urticaria o enrojecimiento
- exacerbación de los síntomas de la enfermedad de Parkinson - como temblores, rigidez, somnolencia y arrastre de los pies
- ritmo cardíaco rápido
- presión arterial alta
- cambios en los resultados de las pruebas de función hepática
- sensación de ansiedad
- alucinaciones (ver o escuchar cosas que no existen)
- pesadillas
Otros efectos adversos observados con la rivastigmina en forma de cápsulas o solución oral, que pueden ocurrir con los parches:
Frecuentes(pueden afectar a 1 de cada 10 pacientes):
- malestar general
- confusión
- sudoración excesiva
Raros(pueden afectar a 1 de cada 1000 pacientes):
- enfermedad ulcerosa intestinal
- dolor en el pecho - puede ser causado por espasmo de los vasos coronarios
Muy raros(pueden afectar a 1 de cada 10 000 pacientes):
- sangrado gastrointestinal - que se manifiesta como sangre en las heces o en los vómitos
Frecuencia no conocida(la frecuencia no puede determinarse a partir de los datos disponibles):
- vómitos intensos que pueden provocar una ruptura del esófago
Notificación de efectos adversos
Si se producen efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones,
debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento
de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 34 00
Fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
5. Cómo conservar Rivastigmine Mylan
Debe conservar este medicamento en un lugar fuera del alcance de los niños.
No debe usar este medicamento después de la fecha de caducidad que se indica en el paquete y la bolsa
después de "Caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
No hay instrucciones especiales para el almacenamiento del producto.
Antes de usar el parche, debe conservarlo en la bolsa.
No debe usar un parche que esté dañado o que muestre signos de haber sido abierto.
Después de retirar el parche, debe doblarlo por la mitad con la superficie adhesiva hacia adentro y presionarlo firmemente. Debe colocar el parche usado en la bolsa y luego desecharlo en un lugar inaccesible para los niños. Después de retirar el parche, no debe tocar los ojos con los dedos antes de lavarlos con agua y jabón.
No debe tirar los medicamentos por el desagüe ni a los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Rivastigmine Mylan?
- El principio activo es la rivastigmina.
- Rivastigmine Mylan 4,6 mg/24 h sistemas transdérmicos: cada parche libera 4,6 mg de rivastigmina durante 24 horas. El parche tiene un área de 4,6 cm y contiene 6,9 mg de rivastigmina.
- Rivastigmine Mylan 9,5 mg/24 h sistemas transdérmicos: cada parche libera 9,5 mg de rivastigmina durante 24 horas. El parche tiene un área de 9,2 cm y contiene 13,8 mg de rivastigmina.
- Los demás componentes son: copolímero de acrilato de 2-etilhexilo y acetato de vinilo poliisobutileno de masa molar media poliisobutileno de masa molar alta dióxido de silicio sin agua parafina líquida ligera
Capa exterior:
Poliéster/poliéster termoplástico/aluminio recubierto de poliéster
Capa de protección (retirable):
Poliéster recubierto de polímero fluorado
Tinta naranja
Cómo es Rivastigmine Mylan y qué contiene el paquete?
Cada sistema transdérmico es un parche delgado y de color marrón claro. En la capa exterior, de color marrón claro,
se encuentra impreso con tinta naranja:
- “RIV-TDS 4.6 mg/24 h”
- “RIV-TDS 9.5 mg/24 h”
Cada parche se encuentra en una bolsa de protección sellada individual. Los parches están disponibles en paquetes
que contienen 7 o 30 bolsas, así como en paquetes colectivos que contienen 60 o 90 bolsas. No todas las tallas
de paquetes deben estar disponibles en el mercado.
Título del responsable
Viatris Limited
Parque Industrial Damastown
Mulhuddart, Dublín 15
DUBlín
Irlanda
Fabricante
McDermott Laboratories Ltd. T/A Gerard Laboratories T/A Mylan Dublín
35/36 Baldoyle Industrial Estate
Grange Road, Dublín 13
Irlanda
Mylan Hungary Kft
H-2900 Komárom
Calle Mylan 1
Hungría
Luye Pharma AG
Am Windfeld 35, 83714 Miesbach,
Alemania
Para obtener información más detallada sobre el medicamento y sus nombres en los países del Espacio Económico Europeo,
debe consultar al representante del titular de la autorización de comercialización:
Viatris Healthcare S.A.
Tel: +34 91 456 56 00
Fecha de la última actualización de la hoja de instrucciones: mayo 2024
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorLuye Pharma AG McDermott Laboratories Limited t/a Gerard Laboratories t/a Mylan Dublin Mylan Hungary Kft.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Rivastigmine MilanForma farmacéutica: Sistema, 4,6 mg/24 hPrincipio activo: RivastigminaFabricante: Luye Pharma AGRequiere recetaForma farmacéutica: Sistema, 9,5 mg/24 hPrincipio activo: RivastigminaFabricante: Luye Pharma AGRequiere recetaForma farmacéutica: Sistema, 4,6 mg/24 hPrincipio activo: RivastigminaRequiere receta
Alternativas a Rivastigmine Milan en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Rivastigmine Milan en Испания
Alternativa a Rivastigmine Milan en Украина
Médicos online para Rivastigmine Milan
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Rivastigmine Milan – sujeta a valoración médica y normativa local.











