Pulmicort

Consulta con un médico sobre la receta médica de Pulmicort

Cómo usar Pulmicort
Hoja de instrucciones del paquete: información para el paciente
Pulmicort, 0,125 mg/ml, suspensión para nebulización
Pulmicort, 0,250 mg/ml, suspensión para nebulización
Pulmicort, 0,500 mg/ml, suspensión para nebulización
Budesonida
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Pulmicort y para qué se utiliza
- 2. Información importante antes de usar Pulmicort
- 3. Cómo usar Pulmicort
- 4. Posibles efectos adversos
- 5. Cómo conservar Pulmicort
- 6. Contenido del paquete y otra información
1. Qué es Pulmicort y para qué se utiliza
La budesonida, principio activo de Pulmicort, pertenece a un grupo de medicamentos llamados glucocorticoides. Los medicamentos de este grupo tienen un efecto antiinflamatorio local. Pulmicort se utiliza:
- en pacientes con asma bronquial que requieren un tratamiento a largo plazo con glucocorticoides para controlar el proceso inflamatorio en el sistema respiratorio. La causa del asma es la inflamación del sistema respiratorio. Los nebulizadores se recomiendan cuando el uso de inhaladores de dosis medida (pMDI) o inhaladores de polvo (DPI) no es satisfactorio o no está justificado.
- en pacientes con síndrome del crupe - inflamación aguda de la laringe, tráquea y bronquios - independientemente de la etiología, asociada con un estrechamiento significativo de las vías respiratorias superiores, disnea o tos "ladridora" y que conduce a trastornos respiratorios.
- en el tratamiento de exacerbaciones de la enfermedad pulmonar obstructiva crónica (EPOC), cuando el uso de budesonida en forma de suspensión para nebulización esté justificado. La EPOC es una enfermedad pulmonar crónica que causa disnea y tos.
2. Información importante antes de usar Pulmicort
Cuándo no usar Pulmicort
- si el paciente es alérgico (hipersensible) a la budesonida o a cualquier otro componente de Pulmicort (enumerados en el punto 6). Debe informar a su médico sobre cualquier reacción preocupante que haya experimentado después de tomar un medicamento que contenga budesonida o cualquier componente de Pulmicort.
Precauciones y advertencias
Pulmicort está indicado para el tratamiento a largo plazo, pero no proporciona un alivio rápido de los síntomas agudos de los ataques de asma, en los que se recomienda el uso de medicamentos broncodilatadores de acción corta. Si no se produce una mejora notable después de usar medicamentos broncodilatadores de acción corta o si se necesita usarlos con más frecuencia de lo habitual, debe consultar a su médico. En estos casos, el médico puede considerar el uso de un tratamiento antiinflamatorio más efectivo, por ejemplo, aumentando la dosis de budesonida inhalada o iniciando el tratamiento con un glucocorticosteroide oral. Debe tener especial cuidado al cambiar el tratamiento de glucocorticosteroides orales a medicamentos inhalados. Durante este período, puede ocurrir una insuficiencia transitoria de la corteza suprarrenal. Los pacientes que han requerido un tratamiento de emergencia con dosis altas de glucocorticosteroides orales o un tratamiento a largo plazo con las dosis más altas recomendadas de glucocorticosteroides inhalados también están en riesgo de sufrir una insuficiencia de la corteza suprarrenal cuando se exponen a situaciones estresantes. Debe informar a su médico sobre cualquier situación estresante prevista (por ejemplo, exámenes) o procedimientos quirúrgicos programados. El médico puede considerar aumentar la dosis de glucocorticosteroides orales. Advertencia. Si se produce un cambio de tratamiento con glucocorticosteroides orales a Pulmicort en forma de suspensión para nebulización, pueden ocurrir los siguientes síntomas: secreción nasal acuosa, erupción, dolor muscular y articular. En caso de reacciones alérgicas, como erupción o secreción nasal, el médico puede recomendar el tratamiento con medicamentos antihistamínicos y (o) medicamentos de acción local. Si alguno de los síntomas que ocurren es grave o preocupante, o si ocurren síntomas como dolor de cabeza, fatiga, náuseas o vómitos, debe consultar a su médico. El médico puede recomendar un aumento temporal de la dosis de glucocorticosteroides orales. Se recomienda un control regular del crecimiento de los niños y adolescentes que toman glucocorticosteroides, independientemente de la ruta de administración, debido al riesgo de retraso en el crecimiento. Si el crecimiento se retrasa, el médico puede reconsiderar el tratamiento reduciendo la dosis de glucocorticosteroides. Antes de iniciar el tratamiento, debe informar a su médico sobre cualquier otra enfermedad o dolencia, especialmente sobre:
- infecciones activas o recientes,
- trastornos de la función hepática. Debe consultar a su médico incluso si las advertencias anteriores se refieren a situaciones que ocurrieron en el pasado.
Al igual que con otros medicamentos inhalados, después de usar Pulmicort puede ocurrir un espasmo bronquial paradójico. En caso de una reacción grave, debe dejar de usar el medicamento de inmediato y consultar a su médico lo antes posible. Durante el uso de glucocorticosteroides inhalados, pueden ocurrir infecciones fúngicas en la boca. Estas infecciones pueden requerir un tratamiento antifúngico adecuado y, en algunos pacientes, la interrupción del uso de glucocorticosteroides inhalados. También debe consultar a su médico si los síntomas de la enfermedad no mejoran a pesar de usar las dosis recomendadas del medicamento. Si el paciente experimenta visión borrosa u otros trastornos de la visión, debe consultar a su médico.
Niños
El medicamento puede usarse en el tratamiento de la asma bronquial en niños a partir de los 6 meses de edad. El médico determina la dosis individual para cada paciente.
Pulmicort y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté usando actualmente o que haya usado recientemente, incluyendo aquellos que se venden sin receta, así como sobre cualquier medicamento que planea usar. Debe informar a su médico sobre cualquier reacción preocupante que haya experimentado después de tomar otros medicamentos. Especialmente, debe informar a su médico sobre cualquier medicamento antifúngico que esté usando, como ketokonazol o itraconazol (que son inhibidores potentes del isofermento CYP 3A4) y inhibidores de la proteasa del VIH, como ritonavir y atazanavir, que pueden aumentar la concentración de budesonida en la sangre. Si es necesario usar estos medicamentos con Pulmicort, el intervalo entre las dosis de los medicamentos individuales debe ser lo más largo posible, y el médico puede recomendar reducir la dosis de budesonida. No se ha observado interacción entre la budesonida y otros medicamentos utilizados en el tratamiento de la asma bronquial.
Embarazo y lactancia
Embarazo Si una mujer está embarazada o planea quedarse embarazada, debe consultar a su médico antes de usar el medicamento - no debe usar el medicamento a menos que el médico lo recomiende. Si una mujer que está tomando Pulmicort queda embarazada, no debe dejar de tomar el medicamento por su cuenta, sino que debe informar a su médico lo antes posible. Lactancia Si una mujer está amamantando, debe consultar a su médico antes de usar este medicamento.
Conducción de vehículos y uso de maquinaria
Pulmicort no afecta la capacidad de conducir vehículos o usar maquinaria.
3. Cómo usar Pulmicort
Este medicamento siempre debe usarse según las indicaciones de su médico. La dosis de Pulmicort en forma de suspensión para nebulización se determina individualmente. Si tiene alguna duda, debe consultar a su médico. Pulmicort en forma de suspensión para nebulización solo se puede usar con un nebulizador (aparato de inhalación). El medicamento se introduce en los pulmones mientras se respira a través de una boquilla o máscara facial. Antes de usar el medicamento, debe leer atentamente las "Instrucciones para el uso de Pulmicort en forma de suspensión para nebulización" al final de la hoja de instrucciones y seguir las indicaciones. Debe recordar que después de cada inhalación debe enjuagar la boca con agua. Si se ha usado una máscara facial, después de cada inhalación también debe lavar la cara. No todos los aparatos de inhalación (nebulizadores) son adecuados para administrar Pulmicort en forma de suspensión para nebulización. No debe usar nebulizadores ultrasónicos.
Asma
Dosis inicial
La dosis recomendada para niños a partir de los 6 meses de edad es de 0,25 mg a 0,5 mg por día. Si el niño está tomando un glucocorticosteroide oral, el médico puede aumentar la dosis diaria hasta 1 mg si es necesario. La dosis recomendada para adultos y personas mayores es de 1 mg a 2 mg por día. El médico puede cambiar la dosis después de un tiempo.
Dosis de mantenimiento
Se recomienda usar la dosis más baja efectiva. Niños a partir de los 6 meses de edad: la dosis diaria es de 0,25 mg a 2 mg. Adultos, incluyendo personas mayores: la dosis diaria es de 0,5 mg a 4 mg. Si los síntomas son muy graves, el médico puede aumentar la dosis del medicamento. Si la dosis diaria es de hasta 1 mg, el medicamento se puede administrar una vez al día por la mañana o por la noche. Si siente que el efecto del medicamento es demasiado fuerte o demasiado débil, debe consultar a su médico. Si el estado del paciente mejora, el médico puede decidir reducir la dosis del medicamento. La mejora del estado del paciente después de usar Pulmicort puede ocurrir después de varias horas de iniciar el tratamiento. El efecto completo del medicamento se logra después de varias semanas de iniciar el tratamiento. Debe usar Pulmicort incluso cuando no tenga síntomas de la enfermedad. Pacientes que toman glucocorticosteroides orales Pulmicort en forma de suspensión para nebulización puede ser recetado a un paciente que esté tomando glucocorticosteroides en forma de tabletas orales. El medicamento Pulmicort en forma de suspensión para nebulización puede reemplazar parcial o completamente los glucocorticosteroides orales, manteniendo la misma eficacia o aumentándola. El médico debe recomendar una reducción gradual de la dosis del medicamento oral. Durante el cambio de tratamiento de glucocorticosteroides orales a medicamentos inhalados, el paciente debe estar en un estado estable. Se recomienda usar dosis altas de Pulmicort en combinación con el glucocorticosteroide oral que se ha estado tomando durante 10 días. Luego, la dosis del glucocorticosteroide oral debe reducirse gradualmente, aproximadamente 2,5 mg de prednisona o una dosis equivalente de otro glucocorticosteroide por mes, hasta la dosis más baja que controle los síntomas de la enfermedad. A menudo, se puede dejar de usar completamente los glucocorticosteroides orales. La budesonida administrada al paciente en forma de suspensión para nebulización se entrega a los pulmones durante la inhalación. Es muy importante que el paciente realice inhalaciones tranquilas y regulares a través de la boquilla del nebulizador o la máscara facial.
Síndrome del crupe
La dosis habitual para lactantes y niños con síndrome del crupe es de 2 mg de budesonida administrados en forma de nebulización. Se puede administrar esta dosis de una vez o dividirla en dos dosis de 1 mg cada una, con un intervalo de 30 minutos. Esta pauta de dosificación se puede repetir cada 12 horas, como máximo durante 36 horas o hasta que se logre una mejora en el estado del paciente.
Exacerbaciones de la EPOC
Según los datos limitados de los estudios clínicos, la dosis recomendada de Pulmicort, suspensión para nebulización, es de 4 a 8 mg por día, dividida en 2 a 4 dosis. El tratamiento debe continuar hasta que se logre una mejora en el estado clínico, pero no se recomienda un tratamiento más largo de 10 días. Forma de administración Pulmicort se puede mezclar con una solución al 0,9% de cloruro de sodio y con soluciones de terbutalina, salbutamol, fenoterol, acetilcisteína, cromoglicato de sodio o ipratropio. La mezcla preparada debe usarse dentro de los 30 minutos. La dosis en el contenedor de plástico se puede dividir para obtener la dosis adecuada. Los contenedores de plástico que son envases unitarios están marcados con una línea horizontal (Pulmicort 0,25 mg/ml y 0,5 mg/ml). Después de invertir el contenedor de plástico, esta línea indica el volumen de 1 ml. Si solo se va a usar 1 ml, debe eliminar el líquido que está por encima de la línea de referencia. El contenedor de plástico abierto debe almacenarse en la bolsa de protección sin exposición a la luz. El contenido del contenedor abierto debe usarse dentro de las 12 horas. Dosis (mg) Volumen de Pulmicort, suspensión para nebulización 0,125 mg/ml 0,25 mg/ml 0,5 mg/ml 0,25 2 ml 1 ml* 0,5 4 ml 2 ml 0,75 3 ml 1,0 4 ml 2 ml 1,5 3 ml 2,0 4 ml *Debe diluir hasta 2 ml con una solución al 0,9% de cloruro de sodio o con otro líquido adecuado.
Uso de una dosis mayor de la recomendada de Pulmicort
Es importante que el paciente use el medicamento según las indicaciones de la hoja de instrucciones o las recomendaciones del médico. No debe aumentar o disminuir la dosis del medicamento sin consultar a su médico. Si se ha tomado una dosis mayor de la recomendada, debe consultar a su médico o farmacéutico de inmediato. Si se ha tomado una dosis mayor de la recomendada de una sola vez, no debe tener efectos perjudiciales. Si se han tomado dosis mayores de las recomendadas por el médico durante un período prolongado, puede ocurrir un aumento en la concentración de hormonas de la corteza suprarrenal en la sangre y una supresión de la función de la corteza suprarrenal. En este caso, el médico debe recomendar continuar el tratamiento con Pulmicort en dosis que mantengan los síntomas de la asma bajo control.
Omision de una dosis de Pulmicort
Si no se ha tomado una de las dosis recomendadas por el médico de Pulmicort en forma de suspensión para nebulización, no hay necesidad de tomar la dosis que se perdió. Debe tomar la siguiente dosis del medicamento según las indicaciones del médico. No debe tomar una dosis doble para compensar la dosis que se perdió. Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Pulmicort puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Si ocurre alguno de los siguientes síntomas, debe dejar de usar Pulmicort y consultar a su médico de inmediato:
Pulmicort:
- hinchazón de la cara, especialmente alrededor de los ojos, la boca y las orejas, erupción, picazón, dermatitis de contacto, urticaria y espasmo bronquial (contracción de los músculos en las vías respiratorias que causa una respiración silbante). Esto puede indicar una reacción alérgica. Este efecto adverso es raro (ocurre en menos de 1 de cada 1.000 personas).
- aparición repentina de una respiración silbante después de inhalar el medicamento. Este efecto adverso es raro (ocurre en menos de 1 de cada 1.000 personas).
Otros posibles efectos adversos:
Frecuentes (ocurren en menos de 1 de cada 10 personas)
- infecciones fúngicas (candidiasis) en la boca. Para reducir la posibilidad de que ocurran, debe enjuagar la boca con agua después de usar Pulmicort.
- dolor de garganta, tos y ronquera, afonía.
- infección pulmonar (neumonía) en pacientes con EPOC.
Debe informar a su médico si experimenta alguno de los siguientes síntomas, que pueden ser signos de una infección pulmonar:
- fiebre o escalofríos,
- aumento de la producción de esputo o cambio en su color,
- empeoramiento de la tos o dificultad para respirar.
Poco frecuentes (ocurren en menos de 1 de cada 100 personas)
- cataratas (opacidad del cristalino del ojo).
- visión borrosa.
- calambres musculares.
- temblores musculares.
- depresión.
- ansiedad.
Raros (ocurren en menos de 1 de cada 1.000 personas)
- erupción en la cara después de usar la máscara facial. Se puede prevenir lavando la cara con agua después de usar la máscara facial.
- nerviosismo, cambios de comportamiento (especialmente en niños).
- moretones fáciles.
- ronquera y afonía (en niños).
Los efectos adversos cuya frecuencia no se conoce (no se puede estimar a partir de los datos disponibles):
- trastornos del sueño, ansiedad, excitación excesiva, agresividad.
El uso de glucocorticosteroides inhalados puede afectar la producción normal de hormonas esteroides en el cuerpo, especialmente si se usan durante un período prolongado en dosis altas. Pueden ocurrir efectos como:
- glaucoma (aumento de la presión en el ojo), frecuencia de ocurrencia desconocida.
- retardo del crecimiento en niños y adolescentes (raro).
- efecto en las glándulas suprarrenales (raro). La ocurrencia de estos efectos después del uso de glucocorticosteroides inhalados es menos probable que después del uso de glucocorticosteroides orales.
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos se pueden notificar directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad. Calle de Alcalá, 56 28071 Madrid Teléfono: +34 91 596 34 00 Fax: +34 91 596 34 01 Correo electrónico: [[email protected]](mailto:[email protected]) Los efectos adversos también se pueden notificar al titular de la autorización de comercialización. Al notificar los efectos adversos, se puede recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Pulmicort
Debe conservar el medicamento en un lugar donde no pueda ser visto o alcanzado por los niños. No debe usar este medicamento después de la fecha de caducidad que se indica en el paquete después de "Caducidad (EXP)". El paquete debe conservarse a una temperatura por debajo de 30 °C, cerrado, protegido de la luz. Los contenedores de plástico unitarios deben conservarse en las bolsas de folio de aluminio para protegerlos de la luz. Después de abrir la bolsa de folio de aluminio, el medicamento en los contenedores de plástico unitarios, protegido de la luz, es estable durante 3 meses. El contenido del contenedor de plástico unitario debe usarse dentro de las 12 horas después de abrirlo. Si solo se ha usado 1 ml de la suspensión del contenedor unitario, el resto de la suspensión no es estéril. No debe tirar los medicamentos por el desagüe ni por los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Pulmicort
- El principio activo de Pulmicort es la budesonida. 1 ml de la suspensión para nebulización contiene: 0,125 mg, 0,250 mg o 0,500 mg de budesonida micronizada. 1 contenedor de plástico contiene 0,25 mg, 0,5 mg o 1 mg de budesonida en 2 ml de suspensión para nebulización.
- Los demás componentes son: edetato disódico, cloruro de sodio, polisorbato 80, ácido cítrico anhidro, citrato de sodio, agua purificada.
Cómo se presenta Pulmicort y qué contiene el paquete
Líquido de color blanco a casi blanco en un contenedor de plástico unitario. 0,125 mg/ml, 0,250 mg/ml, 0,500 mg/ml: 20 contenedores de plástico de 2 ml (4 bolsas de folio de aluminio con 5 contenedores de plástico cada una) en una caja de cartón. 0,250 mg/ml, 0,500 mg/ml: 5 contenedores de plástico de 2 ml (1 bolsa de folio de aluminio con 5 contenedores de plástico) en una caja de cartón.
Título del titular de la autorización de comercialización y fabricante
Título del titular de la autorización de comercialización: AstraZeneca AB SE-151 85 Södertälje Suecia Fabricante: AstraZeneca AB Forskargatan 18 SE-151 36 Södertälje Suecia Para obtener más información, debe consultar a un representante del titular de la autorización de comercialización: AstraZeneca Pharma Poland Sp. z o.o. ul. Postępu 14 02-676 Varsovia Teléfono: +48 22 245 73 00 Fax: +48 22 485 30 07 Fecha de la última actualización de la hoja de instrucciones:diciembre de 2022
Instrucciones para el uso de Pulmicort en forma de suspensión para nebulización
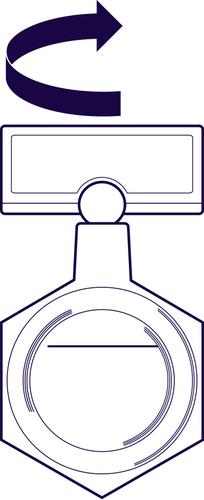
- 1. Antes de usar el contenido del contenedor de plástico, debe agitar suavemente el contenedor en un movimiento circular.
- 2. Debe sostener el contenedor de plástico con el medicamento en posición vertical (ver figura), y luego abrir el contenedor girando la "ala".
- 3. El extremo abierto del contenedor debe conectarse cuidadosamente al depósito del nebulizador y presionarlo lentamente.
Los contenedores de plástico que contienen 0,25 mg/ml y 0,5 mg/ml están marcados con una línea que indica el volumen de 1 ml cuando se invierte el contenedor. Si solo se va a usar 1 ml, debe eliminar el líquido que está por encima de la línea de referencia. Antes de usar el resto del medicamento, debe agitar suavemente el contenedor.
- Debe anotar la fecha de apertura de la bolsa de folio de aluminio. No debe usar los contenedores de plástico unitarios después de 3 meses desde la fecha de apertura de la bolsa de folio de aluminio.
- El contenido del contenedor de plástico unitario debe usarse dentro de las 12 horas después de abrirlo.
- El medicamento debe conservarse a una temperatura por debajo de 30 °C.
- Los contenedores de plástico con el medicamento deben conservarse en las bolsas de folio de aluminio para protegerlos de la luz. Si no se ha usado todo el contenido del contenedor de plástico, el resto debe protegerse de la luz.
- Los contenedores de plástico con el medicamento deben conservarse en posición vertical.
ADVERTENCIA
- 1. Debe enjuagar la boca después de cada uso del medicamento.
- 2. Si el paciente usa una máscara facial, debe asegurarse de que la máscara se ajuste bien a la cara durante la inhalación. Debe lavar la cara después de usar el medicamento.
LIMPIEZA
La cámara del nebulizador, la boquilla o la máscara facial deben lavarse después de cada uso. Estas partes deben lavarse con agua corriente tibia y un detergente suave recomendado por el fabricante del nebulizador. La cámara del nebulizador debe enjuagarse bien y secarse conectando el compresor a la salida.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorAstraZeneca AB
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PulmicortForma farmacéutica: Suspensión, 0.125 mg/mlPrincipio activo: BudesonidaRequiere recetaForma farmacéutica: Suspensión, 0.25 mg/mlPrincipio activo: BudesonidaRequiere recetaForma farmacéutica: Suspensión, 0.5 mg/mlPrincipio activo: BudesonidaRequiere receta
Alternativas a Pulmicort en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Pulmicort en Ucrania
Alternativa a Pulmicort en España
Médicos online para Pulmicort
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Pulmicort – sujeta a valoración médica y normativa local.