
Primovist

Consulta con un médico sobre la receta médica de Primovist

Cómo usar Primovist
Hoja de instrucciones del paquete: información para el usuario
Primovist, 0,25 mmol/ml, solución para inyección, jeringa precargada
Gadolinio de disodio
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el producto, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, quien le recetó Primovist.
- Si el paciente experimenta algún efecto adverso, incluidos aquellos no mencionados en esta hoja de instrucciones, debe informar a su médico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Primovist y para qué se utiliza
- 2. Información importante antes de usar Primovist
- 3. Cómo se usa Primovist
- 4. Posibles efectos adversos
- 5. Cómo conservar Primovist
- 6. Contenido del paquete y otra información
1. Qué es Primovist y para qué se utiliza
Primovist es un medio de contraste utilizado en la exploración de la resonancia magnética (MRI) del hígado. Se utiliza para permitir el diagnóstico y mejorar la detección de lesiones que pueden ocurrir en el hígado. Gracias a él, se puede evaluar mejor las lesiones anormales en el hígado, su número, tamaño y distribución. Primovist también puede ayudar al médico a determinar el tipo de lesión, aumentando la confiabilidad del diagnóstico.
Primovist está destinado a la inyección intravenosa. Este producto está destinado exclusivamente a la diagnosis.
La MRI es un tipo de exploración diagnóstica que utiliza las diferencias en la distribución y cantidad de moléculas de agua en los tejidos normales y anormales para crear imágenes. El principio de esta técnica es el uso de un sistema complejo de imanes y ondas de radio.
2. Información importante antes de usar Primovist
Cuándo no usar Primovist
- si el paciente ha presentado hipersensibilidad al gadolinio de disodio o a alguno de los demás componentes de este producto (enumerados en el punto 6).
Precauciones y advertencias
Antes de comenzar a usar Primovist, debe discutir con su médico si el paciente:
- ha presentado asma o alergia (como rinitis alérgica, urticaria);
- ha presentado una reacción alérgica después de la administración de un medio de contraste;
- ha presentado una disminución de la función renal. La administración de algunos medios de contraste que contienen gadolinio a pacientes con esta condición ha estado asociada con la aparición de fibrosis sistémica nefrogénica (NSF). La NSF es una enfermedad que causa el engrosamiento de la piel y el tejido conectivo. La NSF puede provocar discapacidad debido a la rigidez de las articulaciones, la debilidad muscular o la disfunción de los órganos internos, y por lo tanto puede ser mortal;
- ha presentado una enfermedad cardíaca grave y vascular;
- ha presentado una concentración baja de potasio;
- o si hay antecedentes familiares de trastornos del ritmo cardíaco (ECG) conocidos como síndrome de QT largo;
- ha presentado una arritmia cardíaca después de la administración de medicamentos;
- se ha implantado un marcapasos o algún otro implante o stent que contenga hierro.
Después de la administración de Primovist, pueden ocurrir reacciones retrasadas que se asemejan a una alergia. Estas reacciones pueden ocurrir después de varias horas o días. Véase el punto 4.
Debe informar a su médico si:
- el paciente tiene una disfunción renal;
- el paciente se ha sometido recientemente o se someterá pronto a un trasplante de hígado. El médico puede decidir realizar una prueba de sangre para controlar la función renal antes de decidir sobre la administración de Primovist, especialmente en personas mayores de 65 años.
Acumulación en el organismo
Primovist actúa porque contiene un metal llamado gadolinio. Los estudios han demostrado que pequeñas cantidades de gadolinio pueden acumularse en el organismo, incluido el cerebro. No se han observado efectos adversos asociados con la acumulación de gadolinio en el cerebro.
Niños y adolescentes
No se ha determinado la seguridad y eficacia de Primovist en niños menores de 18 años debido a la experiencia limitada en su uso en esta población. Para obtener más información, véase el final de esta hoja de instrucciones.
Primovist y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que el paciente está tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar. En particular:
- sobre los beta-bloqueantes, medicamentos utilizados para tratar la hipertensión o enfermedades cardíacas;
- sobre los medicamentos que afectan el ritmo o la frecuencia cardíaca, como la amiodarona, el sotalol;
- sobre la rifampicina, un medicamento utilizado para tratar la tuberculosis o algunas otras infecciones.
Embarazo y lactancia Embarazo
El gadolinio de disodio puede pasar a través de la placenta. No se sabe si esto tiene algún efecto en el feto. Las mujeres que creen que están embarazadas o pueden estarlo deben informar a su médico, ya que no se debe usar Primovist durante el embarazo, a menos que sea absolutamente necesario.
Lactancia
Las mujeres que están amamantando o planean amamantar deben informar a su médico. El médico discutirá con la paciente si debe continuar amamantando o si debe interrumpir la lactancia durante 24 horas después de la administración de Primovist.
Conducción de vehículos y uso de máquinas
Primovist no afecta la capacidad de conducir vehículos o usar máquinas.
Primovist contiene sodio
El medicamento contiene 82 mg de sodio (principal componente de la sal común) en cada dosis, basada en la cantidad administrada a una persona de 70 kg de peso corporal. Esto corresponde al 4,1% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo se usa Primovist
Primovist se administra mediante una pequeña aguja en una vena, justo antes de comenzar la exploración de resonancia magnética.
Después de la inyección del medio de contraste, el paciente permanecerá bajo observación durante al menos 30 minutos.
Dosis recomendada
0,1 ml de Primovist por kilogramo de peso corporal.
Dosificación en grupos de pacientes especiales
No se recomienda el uso de Primovist en pacientes con enfermedades renales graves, así como en pacientes que se han sometido recientemente o se someterán pronto a un trasplante de hígado. Si la administración del producto es necesaria, el paciente debe recibir solo una dosis de Primovist durante la exploración y no debe recibir una segunda inyección durante al menos 7 días.
Pacientes de edad avanzada
No es necesario ajustar la dosis en pacientes mayores de 65 años, pero se debe realizar una prueba de sangre para controlar la función renal.
Uso de una dosis mayor que la recomendada de Primovist
El riesgo de sobredosis es muy bajo. En caso de que ocurran síntomas de sobredosis, su médico los observará y tomará las medidas adecuadas.
4. Posibles efectos adversos
Como cualquier medicamento, Primovist puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
La mayoría de estos efectos adversos son leves o moderados.
Si ocurren algún efecto adverso, debe informar a su médico.
Al igual que con otros medios de contraste, pueden ocurrir reacciones que se asemejan a una alergia. Después de la administración de Primovist, pueden ocurrir reacciones retrasadas después de varias horas o días.
El efecto adverso más grave en pacientes que reciben Primovist es el choque anafilactoide (una reacción alérgica grave).
Si ocurre alguno de los siguientes síntomas o se presentan dificultades para respirar, debe informar inmediatamente a su médico:
- presión arterial baja
- hinchazón de la lengua, la garganta o la cara
- resfriado, estornudos, tos
- dolor abdominal
- urticaria
- sensación de entumecimiento o sensibilidad reducida en la piel, picazón, piel pálida
Pueden ocurrir los siguientes efectos adversos adicionales:
Frecuentes:pueden ocurrir en 1 de cada 10 personas
- dolor de cabeza
- náuseas
Poco frecuentes:pueden ocurrir en 1 de cada 100 personas
- mareos
- entumecimiento y hormigueo
- trastornos del gusto o del olfato
- enrojecimiento
- aumento de la presión arterial
- trastornos respiratorios
- vómitos
- sequedad en la boca
- erupción cutánea
- picazón intensa en todo el cuerpo o en los ojos
- dolor de espalda, dolor en el pecho
- reacciones en el lugar de la inyección, como
- sensación de ardor, frío, irritación o dolor
- sensación de calor
- escalofríos
- fatiga
- malestar general
Raros:pueden ocurrir en 1 de cada 1000 personas
- incapacidad para sentarse o estar de pie durante mucho tiempo
- temblor incontrolable
- sensación de latido cardíaco fuerte
- latido cardíaco irregular (síntomas de bloqueo cardíaco)
- malestar en la boca, aumento de la saliva
- erupción cutánea roja con nódulos o manchas en la piel
- sudoración excesiva
- sensación de malestar, malestar general
No conocidos:la frecuencia no puede determinarse a partir de los datos disponibles
- latido cardíaco rápido
- ansiedad
Después de la administración de Primovist, se han observado cambios en los resultados de las pruebas de laboratorio. Debe informar al personal médico que realiza las pruebas de sangre o orina si se ha administrado Primovist recientemente.
Se han notificado casos de fibrosis sistémica nefrogénica (una enfermedad asociada con el endurecimiento de la piel, que también puede afectar los tejidos blandos y los órganos internos) en relación con el uso de otros productos que contienen gadolinio.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos aquellos no mencionados en esta hoja de instrucciones, debe informar a su médico o al personal de la sala de resonancia magnética. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos, Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsovia, Tel.: + 48 22 49 21 301, Fax: + 48 22 49 21 309,
Página web: https://smz.ezdrowie.gov.pl.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Primovist
El producto debe conservarse en un lugar fuera del alcance de los niños.
No use este medio de contraste después de la fecha de caducidad que figura en la etiqueta de la jeringa y en la caja. La fecha de caducidad es el último día del mes indicado.
No hay medidas de precaución especiales para el almacenamiento del medicamento.
El producto debe usarse inmediatamente después de abrirlo.
Antes de usar, debe evaluar visualmente el aspecto del producto. No debe usar el producto si nota un cambio significativo de color, la presencia de partículas en la solución o daños en el envase.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico qué hacer con los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Primovist
- El principio activo es gadolinio de disodio. 1 ml de solución para inyección contiene 0,25 mmol de gadolinio de disodio (lo que equivale a 181,43 mg de gadolinio de disodio).
- Los demás componentes del producto son: caloxetina de trisodio, trometamol, hidróxido de sodio y ácido clorhídrico diluido (ambos para ajustar el pH), agua para inyección.
1 jeringa precargada de 5,0 ml contiene 907 mg de gadolinio de disodio,
1 jeringa precargada de 7,5 ml contiene 1361 mg de gadolinio de disodio (solo jeringa de vidrio) ,
1 jeringa precargada de 10,0 ml contiene 1814 mg de gadolinio de disodio.
Cómo se presenta Primovist y qué contiene el paquete
Primovist es una solución clara, incolora o ligeramente amarilla, sin partículas sólidas. El tamaño de los paquetes es de 1, 5 o 10 jeringas precargadas que contienen:
- 5 ml de solución para inyección (en una jeringa de vidrio o plástico de 10 ml)
- 7,5 ml de solución para inyección (en una jeringa de vidrio de 10 ml) (solo jeringa de vidrio)
- 10 ml de solución para inyección (en una jeringa de vidrio o plástico de 10 ml)
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen
Alemania
Fabricante
Bayer AG
Mullerstrasse 178
13353 Berlín
Alemania
Para obtener información más detallada, debe ponerse en contacto con el representante del titular de la autorización de comercialización:
Bayer Sp. z o.o.
Al. Jerozolimskie 158
02-326 Varsovia
tel. (0-22) 572 35 00
Fecha de la última actualización de la hoja de instrucciones:Diciembre 2024
--------------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado.
Trastornos de la función renal
Antes de administrar Primovist, se recomienda realizar una prueba de laboratorio para evaluar la función renal en todos los pacientes.
Se han notificado casos de fibrosis sistémica nefrogénica (FSN) asociados con el uso de algunos productos que contienen gadolinio en pacientes con trastornos graves de la función renal (TFG <30 ml min 1,73 m).
Los pacientes sometidos a un trasplante de hígado están particularmente expuestos, ya que el riesgo de insuficiencia renal aguda en este grupo de pacientes es alto. Debido a la posibilidad de que se produzca FSN con el uso de Primovist, se debe evitar el uso de este medicamento en pacientes con trastornos graves de la función renal y en pacientes en el período perioperatorio de trasplante de hígado, a menos que la información diagnóstica sea necesaria y no esté disponible para la exploración de MRI sin contraste. Si no se puede evitar el uso de Primovist, la dosis no debe ser mayor que 0,025 mmol/kg de peso corporal. No se debe administrar más de una dosis durante la exploración de MRI. Debido a la falta de datos sobre la administración repetida, no se debe repetir la inyección de Primovist, a menos que haya un intervalo de al menos 7 días entre las inyecciones.
Como la depuración renal del gadolinio de disodio puede disminuir en pacientes de edad avanzada, es especialmente importante vigilar a los pacientes mayores de 65 años en cuanto a trastornos de la función renal.
La hemodiálisis inmediatamente después de la administración de Primovist puede facilitar la eliminación del medicamento del organismo. No hay evidencia que justifique el inicio de la hemodiálisis para prevenir o tratar la FSN en pacientes que no han sido sometidos a diálisis previamente.
Embarazo y lactancia
No se debe usar Primovist durante el embarazo, a menos que la condición clínica de la mujer lo requiera.
El médico y la madre lactante deben decidir si debe continuar amamantando o si debe interrumpir la lactancia durante 24 horas después de la administración de Primovist.
Niños y adolescentes
Se realizó un estudio de observación en 52 pacientes pediátricos (de más de 2 meses y menos de 18 años). Los pacientes se sometieron a una exploración de MRI del hígado con la administración de Primovist para evaluar lesiones hepáticas focales sospechosas o conocidas.
Se obtuvieron información diagnóstica adicional comparando las imágenes de MRI del hígado con y sin contraste, en comparación con las imágenes de MRI sin contraste. No se notificaron efectos adversos graves relacionados con el uso de Primovist. Debido al carácter retrospectivo y al pequeño tamaño de la muestra en este estudio, no se puede sacar una conclusión definitiva sobre la eficacia y la seguridad en esta población.
Antes de la administración
Primovist es una solución clara, incolora o ligeramente amarilla, sin partículas sólidas. Debe evaluar siempre el aspecto del medicamento antes de usarlo. No debe usar el medicamento si nota un cambio significativo de color, la presencia de partículas en la solución o daños en el envase.
Administración
Primovist debe administrarse sin diluir por inyección intravenosa a una velocidad de flujo de aproximadamente 2 ml/s. Después de la inyección, la cánula/debe lavarse con solución salina (9 mg/ml).
- después de la inyección, el paciente debe ser observado durante al menos 30 minutos.
- no se debe administrar Primovist junto con otros medicamentos.
- no se debe administrar Primovist por vía intramuscular.
Preparación
Primovist es una solución lista para usar.
La jeringa precargada debe prepararse para la inyección justo antes de la exploración.
La cubierta debe retirarse de la jeringa precargada justo antes de usarla.
Todo el resto del medio de contraste que no se ha utilizado durante una exploración debe desecharse de acuerdo con las regulaciones vigentes en el país.
La etiqueta arrancada de la jeringa precargada debe pegarse en la historia clínica del paciente para permitir el registro adecuado del medicamento que contiene gadolinio utilizado. También debe documentarse la dosis administrada. Si se utilizan historias clínicas electrónicas, debe registrarse el nombre del medicamento, el número de lote y la dosis en la historia clínica del paciente.
Jeringas precargadas de vidrio:
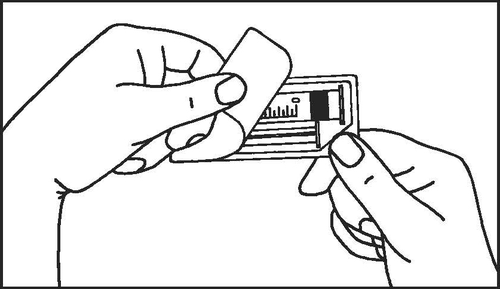
- 1. Abrir el paquete
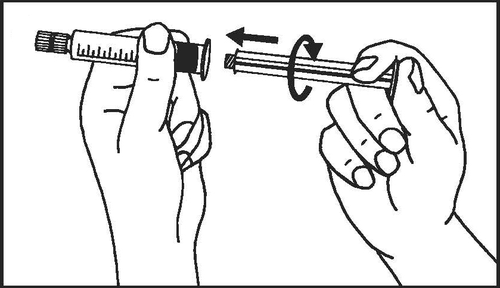
- 2. Enroscar el émbolo de la jeringa
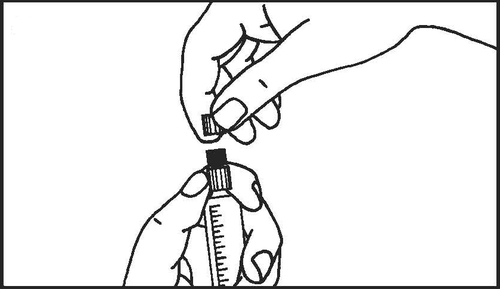
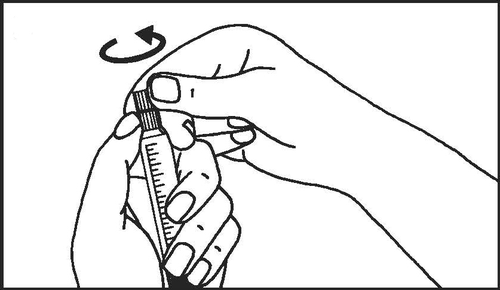
- 3. Romper la protección de la punta de la jeringa
- 4. Quitar la tapa de la punta
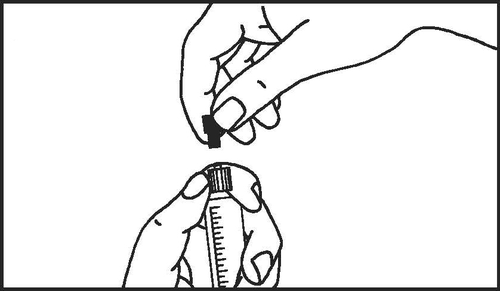
- 5. Quitar el tapón de goma
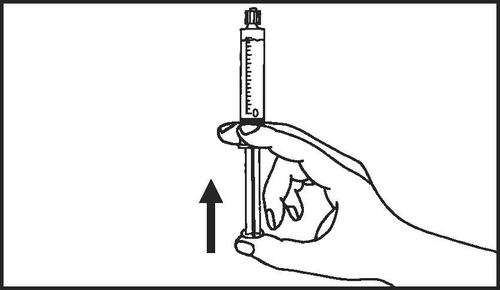
- 6. Quitar el aire de la jeringa
Jeringas precargadas de plástico
Inyección manual
Inyección con un inyector
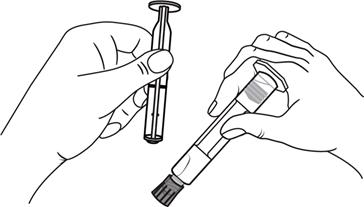
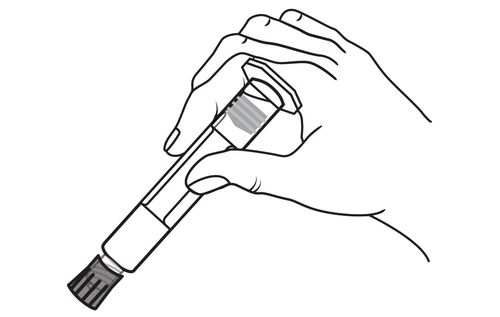
- 1. Sacar la jeringa
- 1. Sacar la jeringa y el émbolo
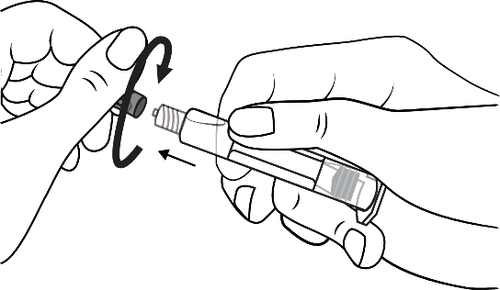
- 2. Abrir la tapa de la punta girándola en el sentido de las agujas del reloj
- 2. Enroscar el émbolo en la jeringa en el sentido de las agujas del reloj
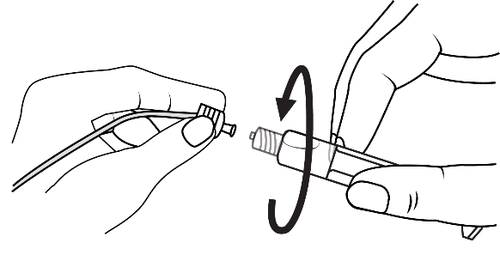
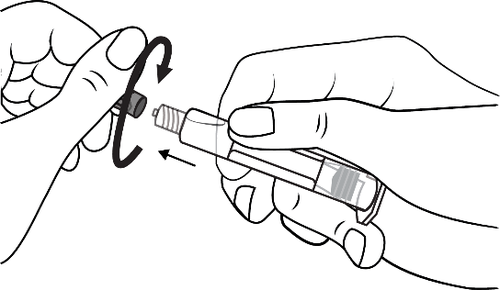
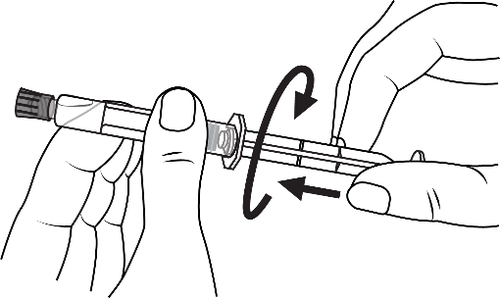
- 3. Conectar la punta de la jeringa con el drenaje girándola en el sentido de las agujas del reloj y seguir las instrucciones
- 3. Abrir la tapa de la punta girándola en el sentido de las agujas del reloj y seguir las instrucciones
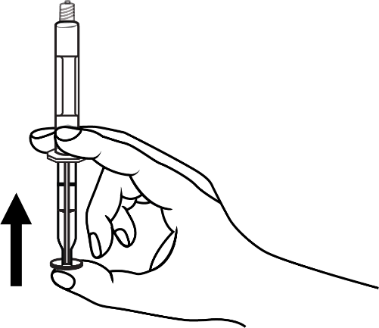
- 4. Quitar el aire de la jeringa
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBayer Pharma AG
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PrimovistForma farmacéutica: Solución, 0.5 mmol/mlPrincipio activo: Gadoterico acidoFabricante: GE Healthcare AS GE Healthcare IrelandRequiere recetaForma farmacéutica: Solución, 0.5 mmol/mlPrincipio activo: Gadoterico acidoFabricante: GE Healthcare ASRequiere recetaForma farmacéutica: Solución, 0.5 mmol/mlPrincipio activo: Gadoterico acidoFabricante: Sanochemia Pharmazeutika GmbHRequiere receta
Alternativas a Primovist en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Primovist en Ucrania
Alternativa a Primovist en España
Médicos online para Primovist
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Primovist – sujeta a valoración médica y normativa local.














