
Optirai 320

Consulta con un médico sobre la receta médica de Optirai 320

Cómo usar Optirai 320
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones incluida en el embalaje: información para el usuario
Optiray 320 solución para inyección y perfusión, 678 mg/ml
(Ioversol)
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Debe consultar a un médico o farmacéutico si tiene alguna duda adicional.
- Si aparecen efectos adversos, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico.
Índice de la hoja de instrucciones
- 1. Qué es Optiray y para qué se utiliza
- 2. Información importante antes de usar Optiray
- 3. Cómo usar Optiray
- 4. Posibles efectos adversos
- 5. Cómo conservar Optiray
- 6. Contenido del embalaje y otra información
1. Qué es Optiray y para qué se utiliza
Optiray se utiliza en adultos para varios exámenes radiológicos, incluyendo:
- imagen de vasos sanguíneos, tanto arterias como venas
- riñones
- tomografía computarizada
Optiray es un medio de contraste que contiene yodo. El yodo bloquea la radiación de rayos X, lo que permite visualizar los vasos sanguíneos y órganos internos por los que fluye la sangre.
2. Información importante antes de usar Optiray
Cuándo no usar Optiray:
- si el paciente es alérgicoa los medios de contrasteque contienen yodo o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
- si el paciente tiene hipertiroidismo
Advertencias y precauciones
Antes de comenzar a usar Optiray, debe consultar a un médico si el paciente tiene:
- asma o reacciones alérgicas en el pasado, como náuseas, vómitos, baja presión arterial, síntomas cutáneos
- insuficiencia cardíaca, hipertensión, trastornos de la circulación o accidente cerebrovascular y si el paciente es de edad avanzada
- diabetes
- enfermedad renal o hepática
- trastornos cerebrales
- trastornos de la médula ósea, como ciertos tipos de cáncer de la sangre, llamados paraproteinemia, mieloma múltiple
- ciertos trastornos de los glóbulos rojos, llamados anemia falciforme
- tumor suprarrenal que afecta la presión arterial, llamado feocromocitoma
- aumento de la concentración de homocisteína, causado por un trastorno metabólico
- examen reciente de la vesícula biliar con un medio de contraste
- examen planificado de la tiroides con un medicamento que contiene yodo. Debe retrasarse, ya que Optiray puede afectar los resultados durante un período de hasta 16 días.
Se han notificado reacciones adversas graves en la piel en pacientes a quienes se les administró Optiray, como eosinofilia y síntomas sistémicos (síndrome de reacción a medicamentos con eosinofilia y síntomas sistémicos, DRESS), síndrome de Stevens-Johnson (SJS), necrolisis tóxica epidermal (TEN) y pustulosis exantemática aguda generalizada (AGEP), que pueden ser mortales. Durante el procedimiento o poco después del procedimiento de imagen, puede ocurrir un trastorno temporal del funcionamiento del cerebro llamado encefalopatía. Debe informar inmediatamente a un médico si nota alguno de los síntomas relacionados con este estado descritos en el punto 4.
Niños y adolescentes menores de 18 años
Optiray 320 no se recomienda para su uso en este grupo de edad. En caso de exposición a Optiray (exposición directa o recién nacidos cuyas madres recibieron un medio de contraste yodado durante el embarazo), debe evaluarse la función tiroidea después del nacimiento del niño y en todos los niños menores de 3 años, dentro de un mes después de la exposición.
Optiray y otros medicamentos
Debe informar a su médico o especialista en radiología sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar. Los siguientes medicamentospueden interactuar con Optirayo Optiray puede interactuar con ellos:
- metformina:medicamento utilizado para tratar la diabetes. El médico examinará la función renal antes y después de la administración de Optiray. Dependiendo del nivel de función renal, el médico puede considerar suspender la metformina durante un período de 48 horas antes del examen y hasta 48 horas después del examen. No debe reanudar su uso hasta que la función renal haya vuelto a los niveles anteriores.
- interleucinas:medicamentos utilizados para tratar ciertos tipos de cáncer
- algunos medicamentos que aumentan la presión arterialdebido a la constricción de los vasos sanguíneos. Con el fin de prevenir el riesgo de trastornos del sistema nervioso de Optiray, nunca debe administrarse durante el uso de estos medicamentos.
- medicamentos para anestesia generalSe han notificado efectos adversos más frecuentes.
- diuréticos:medicamentos que aumentan la producción de orina y reducen la presión arterial. En caso de deshidratación causada por el uso de diuréticos, la administración de medios de contraste yodados puede aumentar el riesgo de insuficiencia renal aguda.
Optiray con alimentos y bebidas
Debe consultar a un médico. En pacientes con enfermedad renal preexistente, no debe restringir la ingesta de agua, ya que esto puede empeorar la función renal.
Embarazo y lactancia
- EmbarazoDebe informar a su médico si está embarazada o sospecha que está embarazada. El médico solo administrará Optiray a una paciente embarazada si es absolutamente necesario, ya que el medicamento puede dañar al feto.
- LactanciaDebe suspender la lactancia durante un díadespués de la inyección, ya que no hay datos suficientes sobre la seguridad de su uso. Debe consultar a un médico o especialista en radiología.
Conducción de vehículos y uso de maquinaria
No se recomienda conducir vehículos o operar maquinaria durante 1 hora despuésde la inyección. Además, se han observado síntomas como mareos, somnolencia, debilidad y trastornos de la visión. Si el paciente experimenta estos síntomas, no debe intentar realizar ninguna actividad que requiera concentración y capacidad de reacción adecuada.
Optiray contiene sodio.
El medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, lo que significa que se considera "exento de sodio".
3. Cómo usar Optiray
Los exámenes con Optiray solo se realizarán por un médico o especialista en radiologíaque también decidirá la dosis. Optiray se inyecta en un vaso sanguíneoy se distribuye en el cuerpo a través de la circulación sanguínea. Antes de usar, el medicamento se calienta a la temperatura del cuerpo, luego se inyecta una o varias veces durante el examen radiológico. La dosis depende del tipo de examen y otros factores, como el estado del paciente y la edad. Se utiliza la dosis más pequeña que permita obtener imágenes de calidad adecuada.
Uso de una dosis mayor que la recomendada de Optiray
La sobredosis es potencialmente peligrosa y puede afectar la respiración, el corazón y la circulación. Debe informar inmediatamente a un médico o especialista en radiología si el paciente nota alguno de estos síntomas después de recibir Optiray. En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a un médico o especialista en radiología.
4. Posibles efectos adversos
Como cualquier medicamento, Optiray puede causar efectos adversos, aunque no todos los pacientes los experimentarán. Los efectos adversos relacionados con Optiray son generalmente independientes de la dosis administrada. En la mayoría de los casos, son leves o moderados y muy raramente graves o mortales. Debe contactar inmediatamente a un médicosi aparecen alguno de los siguientes efectos adversos graves:
- paro cardíaco o respiratorio
- espasmo de los vasos sanguíneos del corazón o coágulos sanguíneos
- accidente cerebrovascular, síncope
- pérdida de memoria
- trastornos del habla
- movimientos involuntarios
- ceguera temporal
- insuficiencia renal aguda
- erupción cutánea, enrojecimiento o ampollas que pueden convertirse en reacciones cutáneas mortales, incluyendo necrolisis tóxica epidermal (TEN) o síndrome de reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS)
- síntomas de reacción alérgica, como anafilaxia, vías respiratorias obstructivas, edema de la glotis, faringe, lengua, dificultad para respirar, tos, estornudos, enrojecimiento y (o) edema de la cara y los ojos, picazón, erupción cutánea y urticaria
Los efectos adversos pueden ocurrir con la siguiente frecuencia:
Muy frecuentes, ocurren en más de 1 de cada 10 usuarios
- sensación de calor
Frecuentes, ocurren en 1 de cada 10 a 1 de cada 100 usuarios
- dolor
- náuseas
Poco frecuentes, ocurren en 1 de cada 100 a 1 de cada 1000 usuarios
- urticaria
- enrojecimiento de la piel, picazón
- mareos
- dolor de cabeza
- trastornos del gusto
- trastornos de la sensación, como hormigueo o entumecimiento
- vómitos
- estornudos
- hipertensión
Raros, ocurren en 1 de cada 1000 a 1 de cada 10 000 usuarios
- síncope
- mareos
- visión borrosa
- pulso acelerado
- hipotensión
- enrojecimiento facial súbito
- espasmo de la glotis
- edema y constricción de las vías respiratorias, incluyendo opresión de la glotis, sibilancia
- dificultad para respirar
- inflamación de la nariz, que causa estornudos y congestión nasal
- tos, irritación de la garganta
- sequedad de boca
- erupción cutánea
- urgencia urinaria
- edema facial, incluyendo los ojos
- escalofríos
- temblor involuntario
- sensación de frío
Muy raros, ocurren en menos de 1 de cada 10 000 usuarios
- reacción alérgica grave
- desorientación, ansiedad, nerviosismo
- pérdida de conciencia, entumecimiento
- parálisis
- somnolencia
- estupor
- trastornos del habla
- trastornos de la visión
- disminución de la sensibilidad al tacto o la percepción
- inflamación alérgica de los ojos, que causa enrojecimiento, lagrimeo y picazón en los ojos
- zumbido o tinnitus
- ritmo cardíaco irregular, bradicardia
- dolor en el pecho
- cambios en la actividad cardíaca medidos con un ECG
- enfermedad que afecta el flujo sanguíneo al cerebro
- hipertensión
- inflamación de las venas, dilatación de los vasos sanguíneos
- acumulación de líquido en los pulmones
- dolor de garganta
- baja saturación de oxígeno en la sangre
- dolor abdominal
- inflamación de las glándulas salivales, edema de la lengua
- dificultad para tragar, aumento de la saliva
- edema doloroso y severo de las capas profundas de la piel, principalmente en la cara
- aumento de la sudoración
- calambres musculares
- insuficiencia renal aguda o disfunción renal
- incontinencia urinaria, sangre en la orina, disminución de la micción
- edema de los tejidos debido al exceso de líquido
- reacciones en el lugar de la inyección, incluyendo dolor, enrojecimiento, hemorragia o necrosis de los tejidos
- malestar general, fatiga, letargo
Desconocido: la frecuencia no puede determinarse a partir de los datos disponibles
- reacción alérgica grave con anafilaxia
- hipotiroidismo transitorio
- convulsiones
- trastorno temporal del funcionamiento del cerebro (encefalopatía), que puede causar desorientación, alucinaciones, trastornos de la visión, ceguera, convulsiones, pérdida de coordinación, pérdida de movimiento en un lado del cuerpo, problemas del habla y pérdida de conciencia
- trastorno del movimiento
- pérdida de memoria
- ceguera temporal
- paro cardíaco, arritmia cardíaca mortal
- latidos cardíacos adicionales
- espasmo de las arterias coronarias, taquicardia
- coloración azulada de la piel (cianosis) debido a la baja saturación de oxígeno en la sangre
- choque
- coágulo sanguíneo o espasmo en un vaso sanguíneo
- palidez
- paro respiratorio, asma, vías respiratorias obstructivas
- disminución de la capacidad para producir sonidos con los órganos vocales
- diarrea
- reacción grave que afecta la piel, la sangre y los órganos internos (reacción a medicamentos con eosinofilia y síntomas sistémicos, también conocida como DRESS o síndrome de hipersensibilidad a medicamentos)
- erupción cutánea roja, descamativa y generalizada con nódulos bajo la piel y ampollas, acompañada de fiebre al comienzo del tratamiento (pustulosis exantemática aguda generalizada)
- erupción cutánea roja con nódulos o granos
- reacción mortal que incluye síntomas similares a los de la gripe y erupción cutánea/ampollas dolorosas en la piel, boca, ojos y genitales (síndrome de Stevens-Johnson/toxicidad epidermal necrolizante)
- incontinencia urinaria, sangre en la orina, disminución de la micción
- hipotiroidismo en recién nacidos
- fiebre
Notificación de efectos adversos
Si aparecen efectos adversos, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, o a la autoridad sanitaria correspondiente en su país. La notificación de efectos adversos ayuda a recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Optiray
Debe conservar el medicamento en un lugar fuera del alcance de los niños. No use este medicamento después de la fecha de caducidad indicada en el embalaje. La fecha de caducidad es el último día del mes indicado. Debe conservar los contenedores en el embalaje exterior para protegerlos de la luz. Proteja del rayo X. No conserve a una temperatura superior a 30°C. Optiray 320 puede conservarse durante un mes a 37°C en una incubadora diseñada para conservar medios de contraste, con circulación de aire. No use este medicamento si nota decoloración o partículas sólidas.
6. Contenido del embalaje y otra información
Qué contiene Optiray?
- El principio activo es ioversol. Un mililitro de Optiray 320 contiene 678 mg de ioversol, lo que equivale a 320 mg de yodo unido orgánicamente.
- Los demás componentes son: versenato sódico-cálcico (estabilizador), trometamol y clorhidrato de trometamol (tampón) y agua para inyección. El hidróxido sódico y (o) el ácido clorhídrico pueden usarse para ajustar el pH a un nivel de 6,0 a 7,4.
Cómo se presenta Optiray y qué contiene el embalaje?
Optiray 320 se presenta en:
- ampollas de vidrio incoloras de 20 ml, con tapones de goma de bromobutilo y protectores de las tapas de aluminio. La caja contiene 10 ampollas.
- botellas de vidrio incoloras de 50, 75, 100 o 200 ml, con tapones de goma de bromobutilo y protectores de las tapas de aluminio. La caja contiene las siguientes cantidades de botellas. Capacidad de 50 ml: 10 o 25 botellas. Capacidad de 100 ml: 10 o 12 botellas. Capacidad de 75 ml o 200 ml: 10 botellas.
- botellas de vidrio incoloras de 500 ml, con tapones de goma de bromobutilo y protectores de las tapas de aluminio. La caja contiene 5, 6 o 10 botellas.
Optiray 320 también se suministra en jeringas precargadas y jeringas con inyector de presión, fabricadas con polipropileno. La punta de la jeringa y el émbolo están fabricados con caucho natural. Jeringas precargadas: 50 ml. La caja contiene 10 jeringas. Jeringas con inyector de presión: 50, 100 o 125 ml. La caja contiene 10 jeringas. No todas las tallas de embalaje y cajas deben estar disponibles en todos los países.
Titular de la autorización de comercialización y fabricante:
- Dirección del titular de la autorización de comercialización
Guerbet BP 57400
95943 Roissy CDG Cedex
Francia
Para obtener más información sobre este medicamento, debe consultar a un representante del titular de la autorización de comercialización: Guerbet Poland Sp. z o.o., tel. (22) 6684110.
- Fabricante
Guerbet
BP 57400
95943 Roissy CDG Cedex
Francia
Lugar de fabricación: 16-24 rue Jean Chaptal, 93600 Aulnay sous Bois, Francia
Fecha de la última revisión de la hoja de instrucciones:
Instrucciones de uso de las jeringas precargadas
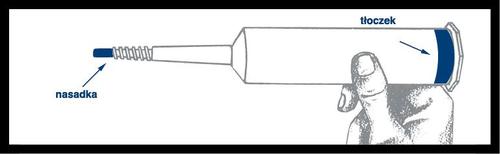
Jeringa precargada
Montaje y verificación
Precaución: La superficie exterior de la jeringa no es estéril.
El contenido de la jeringa y la superficie debajo de la punta azul y las costillas que refuerzan el émbolo sonestérilesy, por lo tanto, debe tener cuidado durante el montaje.
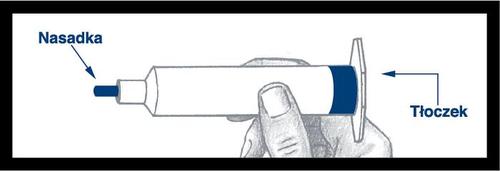
Saque la jeringa del soporte y
verifique que no haya fugas alrededor de
la punta azul y en el exterior del
émbolo. No use la jeringa si nota
alguna fuga. Después de enroscar el
empuje en el émbolo de la jeringa,
es importante girar el empuje
además de ½ vuelta, para que el
émbolo azul gire libremente.
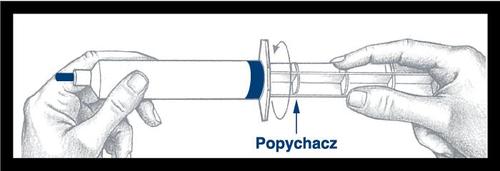
Antes de usar la jeringa, debe
retirar la punta azul y desecharla.
La superficie debajo de la punta
es estéril, debe tener cuidado
al realizar las acciones
posteriores. La jeringa ahora
está lista para colocar la aguja o
la cánula de infusión. Después
de usar, deseche la jeringa y
la porción no utilizada del medicamento.
Instrucciones de uso de las jeringas con inyector de presión
Jeringa precargada
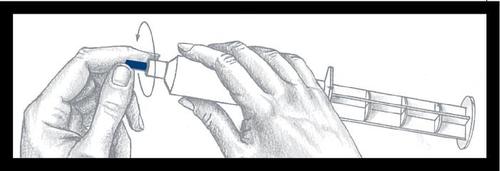
Montaje y verificación
Precaución: La superficie exterior de la jeringa no es estéril.
El contenido de la jeringa y la superficie debajo de la punta azul y las costillas que refuerzan el émbolo sonestérilesy, por lo tanto, debe tener cuidado durante el montaje.
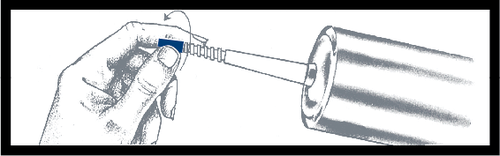
Saque la jeringa del soporte y
verifique que no haya fugas alrededor de
la punta azul y en el exterior del
émbolo. No use la jeringa si nota
alguna fuga. Coloque la jeringa
en la cubierta de presión.
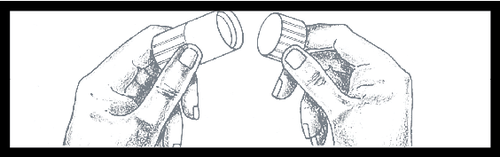
Para quitar la punta azul, debe
presionarla y girarla, y después
de quitarla, desecharla. La
superficie debajo de la punta
es estéril. Debe tener cuidado
al realizar las acciones
posteriores.
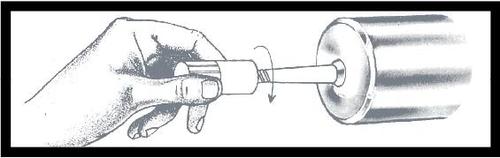
Luego, retire la cubierta del
protector antipolvo del conector
Luer, girándolo para romper
la protección visible. Deseche
la cubierta.
Enrosque el conector Luer en la
jeringa, sosteniendo la cubierta
antipolvo y ajustándolo hasta
que esté seguro. Retire y
deseche la cubierta antipolvo
inmediatamente antes de
conectar la cánula estéril.
Después de usar, deseche la
jeringa y la porción no
utilizada del medicamento.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGuerbet
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Optirai 320
Alternativas a Optirai 320 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Optirai 320 en España
Médicos online para Optirai 320
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Optirai 320 – sujeta a valoración médica y normativa local.














