
Midrane

Consulta con un médico sobre la receta médica de Midrane

Cómo usar Midrane
Hoja de instrucciones del paquete: información para el paciente
Mydrane, (0,2 mg + 3,1 mg + 10 mg)/ml, solución para inyección
Tropicamida + Clorhidrato de fenilefrina + Clorhidrato de lidocaína monohidratado
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Mydrane y para qué se utiliza
- 2. Información importante antes de usar Mydrane
- 3. Cómo usar Mydrane
- 4. Posibles efectos adversos
- 5. Cómo conservar Mydrane
- 6. Contenido del paquete y otra información
1. Qué es Mydrane y para qué se utiliza
Qué es Mydrane
Contiene tres principios activos:
- tropicamida, que pertenece a un grupo de medicamentos que bloquean el flujo de impulsos a través de ciertos nervios, conocidos como agentes anticolinérgicos,
- fenilefrina (en forma de clorhidrato de fenilefrina), que pertenece a un grupo de medicamentos que imitan el efecto de los impulsos transmitidos por ciertos nervios (agentes alfa-simpaticomiméticos),
- lidocaína (en forma de clorhidrato de lidocaína monohidratado), que pertenece a una clase de medicamentos llamados anestésicos locales del tipo amidado.
Para qué se utiliza este medicamento
Este medicamento solo se utiliza en adultos.
Se administra por un cirujano oftálmico a través de una inyección en el ojo al comienzo de la operación de cataratas
(opacidad del cristalino) con el fin de dilatar la pupila del ojo (midriasis) y para obtener
anestesia del ojo durante la operación.
2. Información importante antes de usar Mydrane
Cuándo no usar Mydrane:
- si el paciente es alérgico a la tropicamida, clorhidrato de fenilefrina y (o) clorhidrato de lidocaína monohidratado o a cualquier otro componente de este medicamento (enumerado en el punto 6),
- si el paciente es alérgico a los anestésicos locales del tipo amidado,
- si el paciente es alérgico a los derivados de la atropina.
Precauciones y advertencias
Mydrane no se recomienda:
- en la operación de cataratas combinada con ciertos tipos de operaciones oculares (vitreectomía),
- si se ha determinado que la parte delantera (cámara anterior) del ojo es poco profunda,
- si el paciente ha experimentado un aumento agudo de la presión intraocular (glaucoma agudo con ángulo de filtración estrecho) en el pasado.
Debe consultar a su médico, especialmente si el paciente tiene:
- hipertensión arterial (presión arterial alta),
- endurecimiento de las paredes de las arterias (arteriosclerosis),
- enfermedades cardíacas, especialmente si afectan la frecuencia cardíaca,
- contraindicaciones para los medicamentos que aumentan la presión arterial (aminas presoras) y se administran por vía sistémica,
- hipertiroidismo,
- trastornos de la próstata,
- epilepsia,
- enfermedades hepáticas o renales,
- problemas respiratorios,
- pérdida de la función muscular y debilidad muscular (miastenia).
Mydrane y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que el paciente está tomando
actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
Embarazo, lactancia y fertilidad
No debe usar este medicamento:
- durante el embarazo,
- durante la lactancia. Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Conducción de vehículos y uso de máquinas
Mydrane tiene un efecto moderado en la capacidad para conducir vehículos y usar máquinas.
No debe conducir vehículos ni usar máquinas hasta que la visión sea normal.
Mydrane contiene sodio
El medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, el medicamento se considera "exento de sodio".
3. Cómo usar Mydrane
El paciente solo debe recibir este medicamento si, durante el examen preoperatorio, se ha logrado una dilatación
de la pupila suficiente después de la administración de gotas oculares estándar para dilatar la pupila.
Dosis y vía de administración
- La inyección de Mydrane será realizada por un cirujano oftálmico, en anestesia local, al comienzo de la operación de cataratas.
- La dosis recomendada es de 0,2 ml de solución en una sola inyección. No debe administrarse una dosis adicional, ya que no se ha demostrado un efecto adicional significativo y se ha observado una mayor pérdida de células endoteliales.
- La misma dosis se aplica a adultos y personas de edad avanzada.
Uso de una dosis mayor que la recomendada o demasiado pequeña de Mydrane
El medicamento será administrado por un cirujano oftálmico. Es poco probable que el paciente reciba una sobredosis.
La sobredosis puede causar una mayor pérdida de células endoteliales de la córnea (células de la capa posterior de la córnea).
En caso de dudas sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Las complicaciones más graves y bien conocidas que ocurren durante o después de la operación de cataratas:
No muy frecuentes: pueden afectar hasta 1 de cada 100 personas
- daño a la lente (rotura de la cápsula posterior),
- edema de la retina (edema cistoides de la mácula). En este caso, debe buscar atención médica de inmediato.
Otros efectos adversos:
No muy frecuentes: pueden afectar hasta 1 de cada 100 personas
- dolor de cabeza,
- edema de la córnea (queratitis), aumento de la presión intraocular, enrojecimiento del ojo (hiperemia del ojo),
- hipertensión arterial (presión arterial alta).
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad,
Plaza de la Constitución, 5, 28071 Madrid,
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Mydrane
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe usar este medicamento después de la fecha de caducidad que figura en el paquete, blister y ampolla.
La fecha de caducidad es el último día del mes indicado.
No hay instrucciones especiales para la conservación del medicamento.
Solo para uso único. El medicamento debe usarse inmediatamente después de abrir la ampolla.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Mydrane
- En cada dosis de 0,2 ml, los principios activos son: tropicamida 0,04 mg, clorhidrato de fenilefrina 0,62 mg y clorhidrato de lidocaína monohidratado 2 mg, lo que equivale a 0,2 mg de tropicamida, 3,1 mg de clorhidrato de fenilefrina y 10 mg de clorhidrato de lidocaína monohidratado en 1 ml.
- Los demás componentes son: cloruro de sodio, fosfato disódico dodecahidratado, fosfato disódico dihidratado, edetato disódico y agua para inyección.
Cómo se presenta Mydrane y qué contiene el paquete
Mydrane es una solución para inyección transparente, ligeramente amarillenta
y prácticamente libre de partículas visibles, suministrada en una ampolla de vidrio marrón de 1 ml. Cada ampolla estéril contiene 0,6 ml de solución para inyección y se presenta sola o con una aguja estéril con filtro de 5 micrómetros en un blister de papel/PVC sellado.
Cada caja contiene 20 o 100 ampolletas estériles con agujas con filtro de 5 micrómetros, por separado o en el mismo blister. Las agujas con filtro de 5 micrómetros solo deben usarse para extraer el contenido de la ampolla. Todos los componentes están diseñados para un solo uso.
No todas las tallas de paquete pueden estar en circulación.
Título de la autorización de comercialización y fabricante
Título de la autorización de comercialización:
FRANCIA
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Austria, Bélgica, Bulgaria, Chipre, República Checa, Alemania, Dinamarca, Grecia, Finlandia, Francia, Croacia,
Islandia, Italia, Luxemburgo, Países Bajos, Polonia, Portugal, Rumania, Suecia, Eslovenia, Eslovaquia,
Reino Unido ........................................................................................................................... Mydrane
Irlanda, España.........................................................................................................................Fydrane
Noruega .......................................................................................................................................Mydane
Fecha de la última revisión de la hoja de instrucciones: 06-09-2023
Información detallada sobre este medicamento está disponible en el sitio web del Ministerio de Sanidad:
www.mscbs.gob.es
---------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Incompatibilidades farmacéuticas
No se han descrito incompatibilidades con productos comúnmente utilizados durante la operación de cataratas en la literatura o en los estudios clínicos. Esto también se ha confirmado para los materiales viscoelásticos comúnmente utilizados mediante un estudio de interacciones farmacéuticas.
Advertencia
No usar si el blister está dañado o roto. Abrir solo en condiciones estériles.
Se garantiza que el contenido del blister no abierto es estéril.
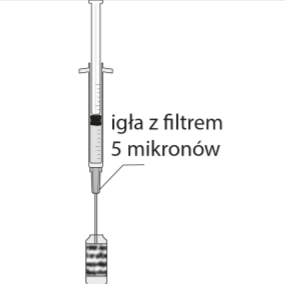
Cómo preparar y administrar Mydrane
La solución para inyección se utiliza una sola vez para un solo ojo, solo para administración en la cámara anterior del ojo.
Mydrane debe administrarse a través de una inyección en la cámara anterior del ojo (inyección intracamerular) por un cirujano oftálmico en condiciones asepticas recomendadas para la operación de cataratas.
Antes de realizar la inyección intracamerular, la solución debe ser inspeccionada visualmente y solo debe usarse si es una solución clara, ligeramente amarillenta
y prácticamente libre de partículas visibles.
La dosis recomendada es de 0,2 ml de Mydrane; no debe administrarse una dosis adicional, ya que no se ha demostrado un efecto adicional significativo y se ha observado una mayor pérdida de células endoteliales.
Este producto debe usarse inmediatamente después de abrir la ampolla y no debe reutilizarse para el segundo ojo o otro paciente.
Solo en caso de que se proporcione un conjunto (es decir, un blister que contiene una ampolla y una aguja): pegar la etiqueta del blister en la documentación del paciente.
Para preparar Mydrane para la administración en la cámara anterior del ojo, debe seguir las siguientes instrucciones: 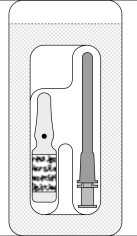  | |
 |
|
Después de usar, debe desechar el resto de la solución preparada. No debe conservar el resto de la solución para usarla más tarde. 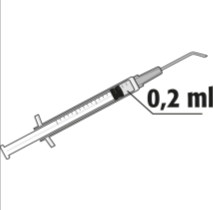 | |
Debe eliminar cualquier residuo del medicamento o sus desechos de acuerdo con las regulaciones locales. Las agujas usadas deben desecharse en un contenedor para residuos médicos punzocortantes.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorDelpharm Tours Laboratoires Thea
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a MidraneForma farmacéutica: Gotas, 10 mg/mlPrincipio activo: atropineFabricante: Warszawskie Zakłady Farmaceutyczne POLFA S.A.Requiere recetaForma farmacéutica: Gotas, 10 mg/mlPrincipio activo: cyclopentolateForma farmacéutica: Gotas, 100 mcg/mlPrincipio activo: atropineFabricante: Jadran-Galenski laboratorij d.d.Requiere receta
Alternativas a Midrane en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Midrane en Ucrania
Alternativa a Midrane en España
Médicos online para Midrane
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Midrane – sujeta a valoración médica y normativa local.














