
Iaemate P 250 i.m. Fviii/600 i.m. Vvf
Consulta con un médico sobre la receta médica de Iaemate P 250 i.m. Fviii/600 i.m. Vvf

Cómo usar Iaemate P 250 i.m. Fviii/600 i.m. Vvf
HOJA DE INSTRUCCIONES - INFORMACIÓN PARA EL USUARIO
HaemateP 250 UI FVIII/600 UI VWF
HaemateP 500 UI FVIII/1200 UI VWF
HaemateP 1000 UI FVIII/2400 UI VWF
Pólvora y disolvente para la preparación de una solución para inyección o infusión
Factor de coagulación sanguínea humano VIII (FVIII) / Factor de von Willebrand humano (VWF)
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Haemate P y para qué se utiliza
- 2. Información importante antes de usar Haemate P
- 3. Cómo usar Haemate P
- 4. Posibles efectos adversos
- 5. Cómo conservar Haemate P
- 6. Contenido del envase y otra información
1. QUÉ ES HAEMATE P Y PARA QUÉ SE UTILIZA
Qué es Haemate P
Haemate P se suministra en forma de polvo y disolvente. La solución preparada se administra por vía intravenosa en inyección o infusión.
Haemate P se produce a partir de plasma humano (la parte líquida de la sangre) y contiene factor de von Willebrand humano y factor de coagulación sanguínea humano VIII.
Para qué se utiliza Haemate P
Haemate P contiene tanto factor de coagulación sanguínea humano VIII (FVIII) como factor de von Willebrand (VWF), lo que es muy importante para determinar qué factor necesita más el paciente. Si el paciente tiene hemofilia A, el médico recetará Haemate P con la cantidad especificada de unidades de factor VIII. Si el paciente tiene enfermedad de von Willebrand, el médico recetará Haemate P con la cantidad especificada de unidades de factor VWF.
Enfermedad de von Willebrand (VWD)
Haemate P se utiliza en la profilaxis y el tratamiento de hemorragias, incluidas las hemorragias quirúrgicas, causadas por la falta de factor de von Willebrand, cuando la terapia con desmopresina (DDAVP) es ineficaz o contraindicada.
Hemofilia A (deficiencia congénita de factor VIII)
Haemate P se utiliza en la profilaxis o el tratamiento de hemorragias causadas por la falta de factor VIII en la sangre.
También se puede utilizar en el tratamiento de la deficiencia adquirida de factor VIII y en el tratamiento de pacientes con anticuerpos contra el factor VIII.
2. INFORMACIÓN IMPORTANTE ANTES DE USAR HAEMATE P
Las siguientes secciones contienen información que debe considerar antes de usar Haemate P
Cuándo NO usar Haemate P:
- en caso de hipersensibilidad (alergia) al factor de von Willebrand humano o al factor de coagulación sanguínea humano VIII o a cualquier otro componente de este medicamento (enumerado en el punto 6).
Si tiene alergia a algún medicamento o alimento, debe informar a su médico.
Advertencias y precauciones
Identificabilidad
Se recomienda encarecidamente que, en cada administración de Haemate P al paciente, se registre el nombre y el número de lote para llevar un registro de los lotes administrados.
Antes de comenzar a usar Haemate P, debe discutirlo con su médico o farmacéutico:
- en caso de reacciones alérgicas o anafilácticas(reacción alérgica grave que causa problemas respiratorios graves o mareos). Como con cualquier inyección de proteína, es posible que ocurran reacciones de hipersensibilidad alérgica. El médico debe informar al paciente sobre los síntomas tempranos de hipersensibilidad, como urticaria, erupción cutánea generalizada, opresión en el pecho, respiración silbante, hipotensión y anafilaxia (reacción alérgica grave que causa problemas respiratorios graves o mareos). Si ocurren estos síntomas, debe dejar de administrar el medicamento y comunicarse con su médico de inmediato.
- La formación de inhibidores(anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a altas concentraciones, interrumpen el tratamiento efectivo y el paciente debe ser monitoreado cuidadosamente para detectar la formación de estos inhibidores. Si la hemorragia del paciente no se controla adecuadamente con Haemate P, debe informar a su médico de inmediato.
- en caso de enfermedad cardíaca preexistente o riesgo de padecerla, debe informar a su médico o farmacéutico.
- si se requiere un dispositivo de acceso venoso central (ang. central venous access device, CVAD) para la administración de Haemate P, el médico debe considerar el riesgo de complicaciones asociadas con el CVAD, incluyendo infecciones locales, bacteriemia y trombosis en el lugar de inserción del catéter.
Enfermedad de von Willebrand
- En caso de riesgo conocido de trombosis (episodios de trombosis, incluyendo trombosis pulmonar), especialmente en pacientes con factores de riesgo clínico o morfológico (por ejemplo, períodos postoperatorios sin profilaxis antitrombótica, inmovilización prolongada, obesidad, sobredosis, cáncer). En este caso, el paciente debe ser monitoreado para detectar signos tempranos de trombosis. Debe implementarse una profilaxis antitrombótica, de acuerdo con las directrices actuales.
Seguridad de uso en cuanto a la posibilidad de transmisión de virus
- se toman medidas de precaución para evitar la infección de los pacientes, incluyendo:
- selección cuidadosa de los donantes de sangre y plasma para asegurarse de que los donantes con riesgo de transmisión de infecciones sean excluidos.
- análisis de cada donación y pool de plasma para detectar la presencia de virus/infecciones, y
- inclusión en el proceso de procesamiento de la sangre o el plasma de procedimientos que puedan inactivar o eliminar los virus.
A pesar de estas medidas, no se puede excluir completamente la posibilidad de transmisión de infecciones con medicamentos preparados a partir de sangre o plasma humano. Esto incluye virus desconocidos o recién descubiertos y otros tipos de infecciones.
Los procedimientos utilizados se consideran efectivos contra los virus envueltos, como el virus de la inmunodeficiencia humana (VIH, el virus que causa el SIDA), el virus de la hepatitis B y el virus de la hepatitis C (inflamación del hígado), así como contra el virus de la hepatitis A (inflamación del hígado) sin envoltura.
Contra los virus sin envoltura, como el parvovirus B19, los procedimientos utilizados pueden tener una eficacia limitada.
Las infecciones por parvovirus B19 pueden ser graves:
- para las mujeres embarazadas (infección del feto no nacido) y
- para personas con sistema inmunológico debilitado o con producción aumentada de glóbulos rojos debido a ciertos tipos de anemia (por ejemplo, anemia falciforme o hemolítica).
Al usar regularmente productos elaborados a partir de plasma humano que contienen factor de von Willebrand y factor VIII, el médico puede recomendar considerar la vacunación contra la hepatitis A y B.
Haemate P y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluyendo los medicamentos sin receta.
- Haemate P no debe mezclarse con otros medicamentos, disolventes o diluyentes.
Embarazo, lactancia y fertilidad
- Si está embarazada o en período de lactancia, cree que pueda estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
- Dado que la hemofilia A es rara en mujeres, no hay datos disponibles sobre el uso de factor VIII durante el embarazo y la lactancia.
- En el caso de la enfermedad de von Willebrand, las mujeres están más expuestas que los hombres debido al riesgo adicional de hemorragias asociadas con la menstruación, el embarazo, el parto, el nacimiento y las complicaciones ginecológicas. Basándose en la experiencia obtenida a partir de estudios posteriores a la comercialización, se recomienda la sustitución de factor de von Willebrand (VWF) para la prevención y el tratamiento de hemorragias agudas. No hay datos clínicos disponibles sobre la terapia de sustitución de VWF en mujeres embarazadas y en período de lactancia.
- Durante el embarazo y la lactancia, Haemate P solo debe administrarse si hay una indicación médica clara.
Conducción de vehículos y uso de máquinas
No hay informes de que Haemate P afecte la capacidad de conducir vehículos o usar máquinas.
Haemate P contiene sodio
Haemate 250 UI FVIII/600 UI VWF contiene menos de 1 mmol de sodio (23 mg) por vial, por lo que se considera "libre de sodio".
Haemate 500 UI FVIII/1200 UI VWF contiene 26 mg de sodio (principal componente de la sal común) por vial, lo que equivale al 1,3% de la ingesta diaria máxima recomendada de sodio para un adulto.
Haemate 1000 UI FVIII / 2400 UI VWF contiene 52,5 mg de sodio (principal componente de la sal común) por vial, lo que equivale al 2,6% de la ingesta diaria máxima recomendada de sodio para un adulto.
3. CÓMO USAR HAEMATE P
El tratamiento debe iniciarse y llevarse a cabo bajo la supervisión de un médico con experiencia en el tratamiento de este tipo de trastornos.
Dosis
La cantidad necesaria de factor de von Willebrand y factor VIII, así como la duración del tratamiento, dependen de varios factores, como el peso corporal, la gravedad de la enfermedad, el lugar y la intensidad de la hemorragia o la necesidad de prevenir la hemorragia durante una operación o procedimiento (véase la sección "Información destinada exclusivamente al personal médico").
Si Haemate P se ha recetado para su uso en el hogar, el paciente debe ser informado por su médico sobre cómo administrar la inyección y la dosis.
Debe seguir las instrucciones proporcionadas por su médico o enfermera del centro de tratamiento de hemofilia.
Uso de una dosis mayor que la recomendada de Haemate P
Los síntomas de sobredosis de VWF o FVIII no son conocidos actualmente. Sin embargo, no se puede excluir el riesgo de trombosis (trombosis) en caso de administración de dosis excepcionalmente altas, especialmente con productos VWF con alto contenido de FVIII.
Reconstitución y administración Información general
- El polvo debe ser mezclado (reconstituido) con el disolvente (parte líquida) y extraído de la ampolla en condiciones asépticas.
- La solución debe ser transparente o ligeramente opalescente. Después de la filtración/extracción (véase a continuación), el producto reconstituido debe ser inspeccionado visualmente para detectar la presencia de partículas y decoloración. Incluso si se siguen las instrucciones de procedimiento de reconstitución, no es raro que queden algunos grumos o partículas. El filtro suministrado con el dispositivo Mix2Vial elimina estas partículas por completo. La filtración no afecta los cálculos de dosificación.
- No usar soluciones que sean visiblemente turbias o contengan grumos o partículas después de la filtración.
- Todo el producto no utilizado después de la administración o los desechos deben ser eliminados de acuerdo con las regulaciones nacionales y las recomendaciones de su médico.
Reconstitución
No abra ninguna de las ampollas, calienta el polvo y el disolvente de Haemate P a temperatura ambiente, dejándolas en esta temperatura durante aproximadamente una hora o sosteniéndolas en la mano durante unos minutos. NO exponga las ampollas a una fuente de calor directa. No calienta las ampollas por encima de la temperatura corporal (37°C).
Retire con cuidado las cubiertas protectoras de la ampolla del disolvente y el medicamento Haemate P. Limpie los tapones de goma expuestos de ambas ampollas con un hisopo empapado en alcohol y déjelos secar. Luego, el disolvente puede ser transferido a la ampolla del polvo utilizando el conjunto suministrado (Mix2Vial). Siga las instrucciones proporcionadas a continuación.
1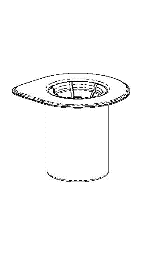 |
|
2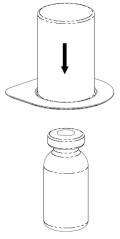 |
|
3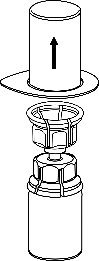 |
|
4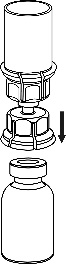 |
|
5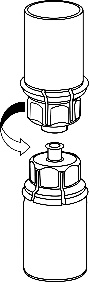 |
|
6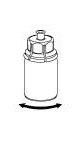 |
|
7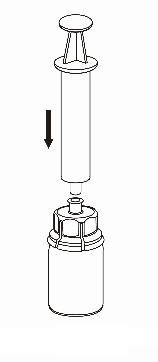 |
|
Extracción y administración
8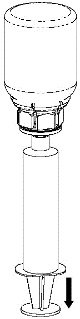 |
|
9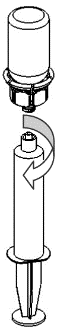 |
|
Método de administración
Se recomienda el uso de jeringas de plástico de un solo uso para la inyección de Haemate P, ya que las soluciones de este tipo tienden a adherirse a la superficie de todas las jeringas de vidrio.
La solución debe administrarse lentamente por vía intravenosa a un ritmo no mayor de 4 ml por minuto. Debe tener cuidado para que la sangre no entre en la jeringa llena de producto. Después de aspirar el producto en la jeringa, debe usarlo de inmediato.
Cuando sea necesario administrar una cantidad mayor de factor, también se puede hacer mediante infusión. Para ello, debe transferir el producto reconstituido a un sistema de infusión aprobado. La infusión debe realizarse de acuerdo con las instrucciones de su médico. Debe prestar atención a la aparición de cualquier reacción inmediata. En caso de cualquier reacción que pueda estar relacionada con la administración de Haemate P, la inyección/infusión debe suspenderse (véase también la sección 2).
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. POSIBLES EFECTOS ADVERSOS
Como cualquier medicamento, Haemate P puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Las siguientes reacciones adversas han ocurrido muy raramente (en menos de 1 de cada 10,000 pacientes):
- Reacción alérgica aguda (como edema angioneurótico, sensación de ardor y picazón en el lugar de la infusión, escalofríos, enrojecimiento facial, urticaria generalizada, dolor de cabeza, reacción alérgica cutánea, hipotensión, letargia, náuseas, ansiedad, taquicardia, opresión en el pecho, hormigueo, vómitos, respiración silbante), que ha ocurrido muy raramente y en algunos casos puede provocar anafilaxia aguda (reacción alérgica grave que causa problemas respiratorios graves o mareos).
- Aumento de la temperatura corporal (fiebre).
Enfermedad de von Willebrand
- Muy raramente, existe un riesgo de aparición de síntomas trombóticos/tromboembólicos, incluyendo trombosis pulmonar (riesgo de formación y migración de trombos sanguíneos al sistema vascular (venas/arterias) con posible impacto en los órganos),
- En pacientes que reciben productos VWF que mantienen niveles elevados de FVIII:C en el suero, pueden aumentar el riesgo de formación de trombos (véase también el punto 2)
- En pacientes con enfermedad de von Willebrand, pueden aparecer muy raramente inhibidores (anticuerpos neutralizantes) contra VWF. Si aparecen estos inhibidores, se manifestarán como una respuesta clínica insuficiente que conduce a una hemorragia prolongada. Esto ocurre especialmente en pacientes con una forma específica de enfermedad de von Willebrand, llamada tipo 3 de la enfermedad. Estos anticuerpos pueden provocar reacciones anafilácticas. En consecuencia, los pacientes que han experimentado una reacción anafiláctica deben ser sometidos a un análisis para detectar la presencia de inhibidores. En estos casos, se recomienda contactar con un centro especializado en el tratamiento de la hemofilia.
Hemofilia A
- En el caso de niños no tratados previamente con medicamentos que contienen factor VIII, pueden aparecer anticuerpos bloqueantes (véase el punto 2) muy a menudo (en más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si ocurren, los medicamentos del paciente pueden dejar de funcionar correctamente y el paciente puede experimentar una hemorragia prolongada. Si ocurren, debe comunicarse de inmediato con su médico.
Efectos adversos en niños y adolescentes
La frecuencia, tipo y gravedad de las reacciones adversas en niños son comparables a las de los adultos.
Notificación de efectos adversos
Si ocurren cualquier efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico, o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: 902 10 50 50
Fax: 913 53 33 33
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos es importante para poder recopilar más información sobre la seguridad de este medicamento.
5. CÓMO CONSERVAR HAEMATE P
- Conservar este medicamento fuera del alcance y de la vista de los niños.
- No usar este medicamento después de la fecha de caducidad que se indica en el etiquetado y el embalaje (después del código EXP)
- No conservar a una temperatura superior a 25 oC.
- No congelar.
- Conservar las ampollas en el embalaje exterior para protegerlas de la luz.
- Haemate P no contiene conservantes, por lo que la solución preparada debe usarse de inmediato.
- Si la solución preparada no se administra de inmediato, debe usarse dentro de las 3 horas siguientes.
- Después de aspirar el producto en la jeringa, debe usarse de inmediato.
- El número de lote está grabado en el etiquetado y el embalaje después del código (Lote).
6. CONTENIDO DEL ENVASE Y OTRA INFORMACIÓN
Qué contiene Haemate P Los principios activos del medicamento son:
Factor de von Willebrand humano y factor de coagulación sanguínea humano VIII
Los demás componentes (excipientes) son:
Albumina humana, glicina, cloruro de sodio, citrato de sodio, hidróxido de sodio o ácido clorhídrico (en pequeñas cantidades para ajustar el pH)
Disolvente: Agua para inyección
Cómo se presenta Haemate P y qué contiene el envase
Haemate P se suministra como un polvo blanco o amarillento claro, o una masa cristalizada, y agua para inyección como disolvente. La solución resultante debe ser transparente o ligeramente opalescente, es decir, puede tener un brillo cuando se sostiene bajo la luz, pero no debe contener partículas visibles.
Envases disponibles
El envase de Haemate P en una dosis de 250 UI FVIII/ 600 UI VWF contiene:
1 ampolla de polvo
1 ampolla de 5 ml de agua para inyección
1 sistema de transferencia 20/20 con filtro,
Conjunto para la administración (envase interior)
1 jeringa de un solo uso de 5 ml,
1 conjunto para la punción,
2 hisopos empapados en alcohol,
1 parche no estéril
El envase de Haemate P en una dosis de 500 UI FVIII/1200 UI VWF contiene:
1 ampolla de polvo
1 ampolla de 10 ml de agua para inyección
1 sistema de transferencia 20/20 con filtro
Conjunto para la administración (envase interior)
1 jeringa de un solo uso de 10 ml,
1 conjunto para la punción,
2 hisopos empapados en alcohol,
1 parche no estéril
El envase de Haemate P en una dosis de 1000 UI FVIII/ 2400 UI VWF contiene:
1 ampolla de polvo
1 ampolla de 15 ml de agua para inyección
1 sistema de transferencia 20/20 con filtro,
Conjunto para la administración (envase interior)
1 jeringa de un solo uso de 20 ml,
1 conjunto para la punción,
2 hisopos empapados en alcohol,
1 parche no estéril
No todos los tamaños pueden estar disponibles en el mercado.
Título del responsable y fabricante
CSL Behring GmbH
Calle de Emil von Behring, 76
35041 Marburgo
Alemania
Fecha de aprobación de la hoja de instrucciones:
Información destinada exclusivamente al personal médico:
Dosis Enfermedad de von Willebrand:
Es importante calcular la dosis utilizando el número de unidades internacionales (UI) de VWF: RCo
1 UI/kg VWF: RCo aumenta generalmente el nivel de VWF: RCo en suero en aproximadamente 0,02 UI/ml (2%).
La dosis necesaria se calcula utilizando la siguiente fórmula:
Dosis necesaria = peso corporal [kg] x aumento deseado del nivel de VWF: RCo [% o UI/ml] x 0,5.
La dosis y la frecuencia de administración del producto deben determinarse siempre individualmente en función de la eficacia clínica en cada paciente.
En el caso de hemorragias o procedimientos quirúrgicos, la siguiente tabla puede utilizarse para determinar la dosis:
| Tipo de hemorragia/procedimiento quirúrgico | Nivel terapéutico de actividad de factor VIII en suero (% o UI/ml) | Frecuencia de dosificación (horas) / duración del tratamiento (días) |
| Hemorragias | ||
| Hemorragia menor en las articulaciones, hemorragia muscular o sangrado de boca | 20-40 | Repetir la inyección cada 12 a 24 horas durante al menos 1 día hasta que cese el dolor y la hemorragia o se produzca la curación |
| Hemorragia importante en las articulaciones; hemorragia muscular o hematoma | 30-60 | Repetir la inyección cada 12-24 horas durante 3 a 4 días o más hasta que cese el dolor y la disfunción aguda |
| Hemorragias que ponen en peligro la vida: | 60-100 | Repetir la inyección cada 8 a 24 horas hasta que cese el peligro |
| Procedimientos quirúrgicos | ||
| Procedimientos quirúrgicos menores con extracción de muelas incluida | 30-60 | Cada 24 horas, durante al menos 1 día, hasta la curación. |
| Procedimientos quirúrgicos importantes | 80-100 (pre y postoperatorio) | Repetir la inyección cada 8 – 24 horas hasta la curación adecuada de la herida, luego terapéuticamente durante al menos 7 días para alcanzar un nivel de 30% a 60% (UI/ml) de actividad de factor VIII. |
Profílaxis
En el tratamiento a largo plazo de profilaxis en pacientes con hemofilia A grave, generalmente se administra de 20 a 40 UI de factor VIII por kg de peso corporal en intervalos de 2 a 3 días.
En algunos casos, especialmente en pacientes jóvenes, puede ser necesario administrar el factor con más frecuencia o en dosis más altas.
Niños y adolescentes
No hay datos de estudios clínicos sobre la dosis de Haemate P en niños.
Precauciones y advertencias especiales para la administración
Al administrar productos VWF, el médico debe ser consciente de que la terapia prolongada puede provocar un aumento excesivo del nivel de FVIII:C. En pacientes que reciben productos VWF que contienen FVIII, debe controlarse el nivel de FVIII:C en suero para evitar un aumento excesivo y sostenido del nivel de FVIII:C, que puede aumentar el riesgo de trombosis, y también debe considerarse el uso de medidas antitrombóticas.
Efectos adversos
Cuando sea necesario administrar dosis muy altas o repetidas, o cuando estén presentes inhibidores, o en el caso de la atención pre y postoperatoria, todos los pacientes deben ser monitoreados en busca de signos de hipervolemia. Además, los pacientes con grupos sanguíneos A, B y AB deben ser controlados para detectar signos de hemólisis intravascular y/o disminución de los valores de hematocrito.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorCSL Behring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Iaemate P 250 i.m. Fviii/600 i.m. VvfForma farmacéutica: Polvo, 50 UI/ml; 500 UI + 60 UI/ml; 600 UIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: Polvo, 25 UI/ml; 250 UI + 30 UI/ml; 300 UIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: Polvo, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere receta
Alternativas a Iaemate P 250 i.m. Fviii/600 i.m. Vvf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Iaemate P 250 i.m. Fviii/600 i.m. Vvf en Ucrania
Alternativa a Iaemate P 250 i.m. Fviii/600 i.m. Vvf en España
Médicos online para Iaemate P 250 i.m. Fviii/600 i.m. Vvf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Iaemate P 250 i.m. Fviii/600 i.m. Vvf – sujeta a valoración médica y normativa local.














