

Fanidi

Consulta con un médico sobre la receta médica de Fanidi

Cómo usar Fanidi
PROSPECTO: INFORMACIÓN PARA
USUARIOS
FANHDI
500 UI de FVIII + 600 UI de VWF
Polvo y disolvente para la preparación de una solución para inyección e infusión
Complejo de factor de coagulación humana VIII y factor de von Willebrand humano
Es importante leer el prospecto antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar este prospecto para poder volver a leerlo si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos.
- Si el paciente experimenta algún efecto no deseado, incluyendo cualquier efecto no deseado no mencionado en este prospecto, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice del prospecto:
- 1. Qué es FANHDI y para qué se utiliza
- 2. Información importante antes de tomar FANHDI
- 3. Cómo tomar FANHDI
- 4. Efectos no deseados
- 5. Cómo conservar FANHDI
- 6. Contenido del envase y otra información
1. QUÉ ES FANHDI Y PARA QUÉ SE UTILIZA
FANHDI se presenta en forma de polvo y disolvente para la preparación de una solución para inyección e infusión en viales que contienen nominalmente 500 UI de factor de coagulación humana VIII (FVIII) y 600 UI de factor de von Willebrand humano (VWF).
Después de la reconstitución con la cantidad adecuada de disolvente (agua para inyección), el producto contiene 50 UI/ml de FVIII y 60 UI/ml de VWF.
Grupo farmacoterapéutico: medicamentos antihemorrágicos, combinación de factor VIII de coagulación sanguínea y factor de von Willebrand.
FANHDI se utiliza para la prevención y el tratamiento de hemorragias en pacientes con hemofilia A (deficiencia congénita de factor VIII de coagulación sanguínea).
- 1.3.1. ESP, etiquetado y prospecto
La administración de FANHDI también está indicada para la prevención y el tratamiento de hemorragias (incluyendo hemorragias durante procedimientos quirúrgicos) en pacientes con enfermedad de von Willebrand (VWD), cuando el tratamiento con desmopresina (DDAVP) es ineficaz o contraindicado.
El producto puede ser utilizado para el tratamiento de la deficiencia adquirida de factor VIII de coagulación sanguínea humana.
2. INFORMACIÓN IMPORTANTE ANTES DE TOMAR FANHDI
Cuándo no tomar FANHDI
- Cuando el paciente es alérgico (hipersensible) al complejo de factor VIII de coagulación sanguínea y factor de von Willebrand o a cualquier otro componente de este medicamento (enumerado en el punto 6).
Debe consultar a su médico si necesita consejo o información adicional.
Advertencias y precauciones
- En casos raros, pueden ocurrir reacciones anafilácticas (reacciones alérgicas graves y repentinas). La hipersensibilidad a FANHDI puede manifestarse como erupción, urticaria generalizada, sensación de opresión en el pecho, mareo, incluso en posición de pie. En caso de que ocurran estos síntomas, debe dejar de administrar el medicamento y notificar a su médico.
- Para determinar la dosis de FANHDI que garantice el logro y el mantenimiento de un nivel adecuado de factor VIII, el médico puede ordenar una serie de pruebas.
- Si la hemorragia no se detiene a pesar de la administración de FANHDI, debe notificar a su médico. Puede ser debido a la producción de un inhibidor del factor VIII, lo que requiere confirmación mediante pruebas. Los inhibidores del factor VIII son anticuerpos que bloquean la acción del factor VIII administrado. Como resultado, se produce una disminución de la eficacia del factor VIII para detener las hemorragias.
- Si previamente ya se ha producido la formación de un inhibidor del factor VIII y luego se cambia el tratamiento a otro producto que contenga factor VIII, existe un mayor riesgo de recurrencia de esta complicación.
- Durante el tratamiento de la enfermedad de von Willebrand con factores de riesgo clínicos o de laboratorio conocidos, existe un riesgo de trombosis. Por lo tanto, es necesario realizar pruebas adecuadas para detectar temprano los síntomas causados por ellas y aplicar el tratamiento actualmente recomendado para las complicaciones tromboembólicas.
- En la enfermedad de von Willebrand, especialmente del tipo 3, pueden producirse anticuerpos neutralizantes (inhibidores) del factor de von Willebrand. Los inhibidores del factor de von Willebrand son anticuerpos presentes en la sangre que pueden bloquear el factor administrado.
- 1.3.1. ESP, etiquetado y prospecto
En esos casos en los que no se logran los niveles esperados de actividad del factor de von Willebrand en el suero o no se puede controlar la hemorragia a pesar de la administración de dosis adecuadas, debe realizarse una prueba para detectar la presencia de un inhibidor del factor de von Willebrand. En pacientes con un nivel alto de inhibidor, el tratamiento con factor de von Willebrand puede ser ineficaz.
- Si es necesario administrar FANHDI mediante un acceso venoso central, el médico debe tener en cuenta la posibilidad de infección local, bacteriemia (infección de la sangre por bacterias) y la formación de un coágulo en el vaso sanguíneo en el lugar donde se introduce el catéter.
En el proceso de fabricación de productos derivados de la sangre humana o el suero, se aplican las siguientes medidas para garantizar la seguridad frente a la transmisión de agentes infecciosos:
- selección cuidadosa de los donantes para excluir a los portadores de agentes infecciosos,
- análisis de cada donación y lote de suero para detectar la presencia de virus,
- aplicación de procedimientos de inactivación/eliminación de virus en la sangre y el suero durante el proceso de fabricación.
A pesar de ello, no se puede excluir completamente la transmisión de agentes infecciosos durante el uso de productos medicinales derivados de la sangre humana o el suero. Esto se aplica también a los virus y patógenos desconocidos o que acaban de aparecer.
Los métodos utilizados se consideran efectivos contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH), la hepatitis B (VHB), la hepatitis C (VHC) y el virus de la hepatitis A sin envoltura. La eficacia de estos métodos contra los virus sin envoltura, como el parvovirus B19, puede ser limitada.
La infección por parvovirus B19 puede ser particularmente grave en mujeres embarazadas (infección del feto) y en personas con sistema inmunitario debilitado o ciertos tipos de anemia (como la anemia falciforme o la anemia hemolítica).
En pacientes que reciben dosis repetidas de productos derivados del suero que contienen factor VIII, el médico que los trata puede recomendar la administración de vacunas contra la hepatitis A y B.
Se recomienda encarecidamente que, en cada administración de FANHDI al paciente, se anote el nombre del paciente y el número de lote del producto para poder vincular al paciente con el lote del medicamento.
Véase también el punto 4
Niños y adolescentes
Las advertencias y precauciones mencionadas se aplican tanto a adultos como a niños.
- 1.3.1. ESP, etiquetado y prospecto
FANHDI y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que está tomando actualmente o que planea tomar.
Las interacciones entre el complejo de factor VIII de coagulación sanguínea y factor de von Willebrand y otros medicamentos no son conocidas.
Embarazo y lactancia
Debido a que la hemofilia A es rara en mujeres, no hay datos sobre el uso del complejo de factor FVIII/VWF durante el embarazo y la lactancia.
Debe consultar a su médico o farmacéutico antes de tomar cualquier medicamento.
Conducción de vehículos y uso de máquinas
FANHDI no afecta la capacidad de conducir vehículos o usar máquinas.
3. CÓMO TOMAR FANHDI
El medicamento debe administrarse por vía intravenosa. La velocidad de administración no debe exceder los 10 ml/min.
Debe seguir las instrucciones de su médico o del personal de salud del centro de tratamiento de hemofilia. En caso de dudas, debe consultar a su médico o farmacéutico.
La dosis de FANHDI que se administra depende de varios factores, como el peso corporal, el estado clínico y el tipo y la gravedad de la hemorragia. Para lograr el nivel adecuado de factor VIII y factor de von Willebrand en la sangre, el médico determinará la dosis de FANHDI y la frecuencia de administración.
El médico determinará la duración del tratamiento con FANHDI.
No debe conservar el resto para un uso posterior, incluso si se almacena en el refrigerador.
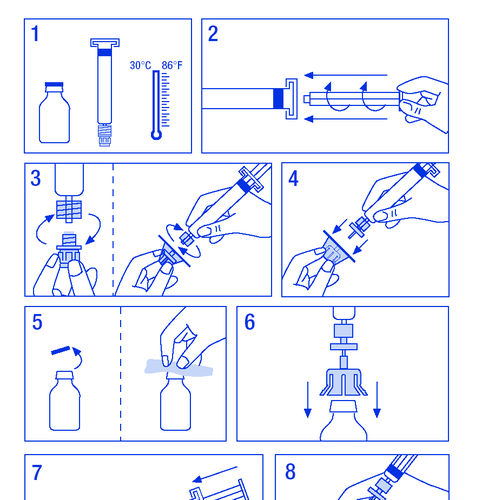
Preparación de la solución:
- 1. Calentar los viales a una temperatura no superior a 30 ºC (figura 1).
- 2. Fijar el émbolo en la jeringa con el disolvente (figura 2).
- 1.3.1. ESP, etiquetado y prospecto
- 3. Retirar el filtro de su envase. Quitar la cubierta de plástico del extremo de la jeringa y fijar el filtro (figura 3).
- 4. Retirar el conector que sujeta la jeringa al vial y conectar la jeringa con el filtro (figura 4).
- 5. Quitar la cubierta de plástico del vial y descubrir el tapón de goma para desinfectarlo con un desinfectante (figura 5).
- 6. Perforar el tapón del vial con la aguja del conector (figura 6).
- 7. Inyectar todo el disolvente en el vial (figura 7).
- 8. Agitar suavemente el vial hasta que el polvo se disuelva (figura 8). Al igual que con otros productos para administración intravenosa, no debe administrarse si el producto no está disuelto o hay partículas visibles.
- 9. Desconectar la jeringa con el filtro del vial durante un momento para permitir que entre aire (figura 9).
- 10. Invertir el vial y aspirar la solución en la jeringa (figura 10).
- 11. Preparar el lugar de la inyección, desconectar la jeringa y administrar el producto mediante una aguja de mariposa o otra aguja estéril. Administrar lentamente por vía intravenosa a una velocidad de 3 ml/min y nunca exceder los 10 ml/min para evitar reacciones vasculares (figura 11).
- 1.3.1. ESP, etiquetado y prospecto
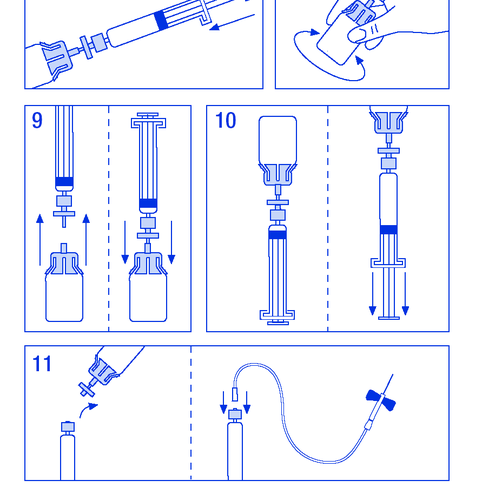
- 1.3.1. ESP, etiquetado y prospecto
No debe reutilizar el conjunto para la administración.
Todos los restos del producto no utilizado y otros desechos deben eliminarse de acuerdo con las regulaciones locales.
Uso de una dosis mayor de la recomendada de FANHDI
No se han notificado síntomas de sobredosis del complejo de factor VIII de coagulación sanguínea y factor de von Willebrand. Después de una sobredosis significativa, pueden ocurrir complicaciones tromboembólicas. Sin embargo, cualquier caso de sobredosis de FANHDI debe ser consultado de inmediato con un farmacéutico o médico.
Omision de la administración de FANHDI
- Si se omite una dosis, debe administrarse la siguiente dosis lo antes posible y continuar el tratamiento de manera regular según las indicaciones del médico.
- No debe administrarse una dosis doble para compensar la dosis omitida.
4. EFECTOS NO DESEADOS
Como cualquier medicamento, este medicamento puede causar efectos no deseados, aunque no todos los pacientes los experimentan.
La hipersensibilidad o las reacciones alérgicas (eritema, picazón o sensación de pinchazo en el lugar de la inyección, escalofríos, enrojecimiento de la cara, urticaria generalizada, dolor de cabeza, erupción, hipotensión, somnolencia, náuseas, ansiedad, taquicardia, sensación de opresión en el pecho, mareo, vómitos, sudoración) se han observado raramente y solo en algunos casos han llevado al desarrollo de una reacción anafiláctica grave (incluyendo anafilaxia).
En casos raros, se ha observado un aumento de la temperatura corporal.
En caso de una reacción anafiláctica o alérgica, debe suspenderse la administración del medicamento y notificar de inmediato a un médico.
No se puede excluir completamente la posibilidad de reacciones alérgicas después de la administración de este medicamento.
Pacientes con hemofilia A pueden desarrollar anticuerpos neutralizantes (inhibidores) contra el factor VIII.
En caso de que aparezcan estos inhibidores, se observa una respuesta clínica insuficiente al tratamiento.
- 1.3.1. ESP, etiquetado y prospecto
Los inhibidores pueden aumentar el riesgo de reacciones alérgicas (anafilaxia). En caso de que ocurran reacciones alérgicas, debe realizarse una prueba para detectar la presencia de inhibidores.
En tales casos, se recomienda contactar con un centro especializado en el tratamiento de trastornos de la coagulación.
Durante el uso de este medicamento en pacientes con enfermedad de von Willebrand con factores de riesgo clínicos o de laboratorio conocidos, existe un riesgo de complicaciones trombóticas.
Mantener un nivel excesivamente alto de FVIII durante el tratamiento con factor VIII que contiene factor de von Willebrand aumenta el riesgo de complicaciones trombóticas.
Durante varios estudios clínicos realizados con 164 pacientes, se administraron un total de 7000 infusiones de FANHDI. Los resultados obtenidos en ambos estudios indican una buena tolerancia al medicamento y una baja frecuencia de efectos no deseados. Solo se observaron 2 casos en los que se produjeron efectos no deseados relacionados con el producto medicinales administrado. En estos casos, se notificó un aumento de la temperatura corporal.
Tabla de efectos no deseados
La siguiente tabla contiene categorías de sistemas y órganos (SOC y nivel de término preferido) de acuerdo con la clasificación MedDRA.
La frecuencia de ocurrencia se evaluó utilizando los siguientes criterios:
- muy frecuente (≥ 1/10)
- frecuente (≥ 1/100 a <1>
- no muy frecuente (≥ 1/1000 a <1>
- raros (≥ 1/10 000 a <1>
- muy raros (<1>
- desconocidos (frecuencia no puede ser establecida en base a los datos disponibles).
En cada categoría de frecuencia, los efectos no deseados se enumeran comenzando con los más graves hasta los menos graves.
Niños y adolescentes
La frecuencia de ocurrencia, el tipo y la gravedad de los efectos no deseados esperados en niños no difieren de los que ocurren en adultos.
| Clasificación de sistemas y órganos | Efectos no deseados | Frecuencia de ocurrencia |
| Trastornos generales y condiciones en el lugar de administración | Aumento de la temperatura corporal. | Raro |
- 1.3.1. ESP, etiquetado y prospecto
Notificación de sospechas de efectos no deseados
Después de la autorización del medicamento, es importante notificar cualquier sospecha de efectos no deseados. Esto permite el monitoreo continuo de la relación beneficio/riesgo del medicamento. El personal médico debe notificar cualquier sospecha de efectos no deseados a través de:
Departamento de Vigilancia de Efectos No Deseados de Medicamentos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: +48 222 49 21 301
Fax: +48 222 49 21 309
correo electrónico: [email protected]
Gracias a la notificación de efectos no deseados, se puede recopilar más información sobre la seguridad del medicamento.
Información sobre las medidas de seguridad para prevenir la transmisión de agentes infecciosos, véase el punto 2.
- 2.
5. CÓMO CONSERVAR FANHDI
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe conservarse a una temperatura superior a 30°C. No debe congelarse.
No debe administrarse después de la fecha de caducidad.
La solución debe ser transparente y ligeramente opalescente.
No debe administrarse si la solución contiene partículas o sedimentos.
No debe administrarse si, después de la reconstitución, el producto contiene partículas o ha cambiado de color.
Después de la reconstitución, la estabilidad química y física del producto se mantiene durante 12 horas a 25 ºC. Desde el punto de vista microbiológico, el producto debe usarse de inmediato. Si después de la reconstitución el producto no se ha utilizado, puede conservarse durante un máximo de 24 horas a una temperatura de 2 ºC – 8 ºC, pero solo si la preparación de la solución se ha realizado de acuerdo con las normas de esterilidad y el usuario es responsable de ello.
- 1.3.1. ESP, etiquetado y prospecto
Los medicamentos no deben tirarse por el desagüe. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este comportamiento ayudará a proteger el medio ambiente.
Fecha de caducidad
3 años,
No debe administrarse después de la fecha de caducidad indicada en el etiquetado.
6. CONTENIDO DEL ENVASE Y OTRA INFORMACIÓN
Qué contiene FANHDI
El principio activo es el complejo de factor de coagulación humana VIII y factor de von Willebrand humano.
Cada vial de polvo contiene 500 UI de factor de coagulación humana VIII y 600 UI de factor de von Willebrand humano.
Después de la reconstitución con 10 ml de agua para inyección, el producto contiene 50 UI/ml de FVIII y 60 UI/ml de VWF.
Los demás componentes son: albúmina humana, histidina y arginina.
Cada jeringa precargada contiene 10 ml de agua para inyección.
Cómo se presenta FANHDI y contenido del envase
Vial con polvo blanco o amarillo claro y jeringa precargada con agua para inyección.
Cada envase de FANHDI contiene un vial con 500 UI de factor de coagulación humana VIII y 600 UI de factor de von Willebrand humano (polvo para inyección y infusión) y 1 jeringa precargada con 10 ml de agua para inyección (disolvente).
El conjunto para la preparación de la solución y la administración viene incluido en el envase de FANHDI: conector que sujeta la jeringa al vial, filtro y conjunto para infusión.
Envases disponibles:
FANHDI 250 UI de FVIII + 300 UI de VWF
FANHDI 1000 UI de FVIII + 1200 UI de VWF
No todos los envases pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
- 1.3.1. ESP, etiquetado y prospecto
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona, España
Para obtener información más detallada, debe consultar con el representante local del titular de la autorización de comercialización:
Grifols Polska Sp. z o. o.
Ul. Grzybowska 87, 00-844 Varsovia
Tel: +48 22 378 85 61
Fecha de la última revisión del prospecto:
…………………………………………………………………………………………………
Información destinada exclusivamente al personal médico:
Dosificación
Deficiencia de factor VIII de coagulación sanguínea
La dosificación y la duración del tratamiento de sustitución dependen del grado de deficiencia de factor VIII, de la ubicación y la extensión de la hemorragia, así como del estado clínico del paciente.
La dosis de factor VIII de coagulación sanguínea administrada se expresa en unidades internacionales (UI) de acuerdo con las normas actuales de la OMS para los productos medicinales que contienen factor VIII de coagulación sanguínea humana. La actividad del factor VIII de coagulación sanguínea en el suero puede expresarse en porcentajes (en relación con la actividad en suero normal) o en unidades internacionales (de acuerdo con el estándar internacional para el factor VIII de coagulación sanguínea en suero).
Una unidad internacional (UI) de actividad del factor VIII de coagulación sanguínea equivale a la cantidad de factor VIII de coagulación sanguínea en 1 ml de suero sanguíneo humano normal.
Tratamiento de hemorragias agudas
El cálculo de la dosis necesaria de factor VIII de coagulación sanguínea se basa en la observación empírica de que la administración de 1 UI/kg de peso corporal aumenta la actividad del factor VIII de coagulación sanguínea en suero en un 1,7% al 2,5% de la actividad normal. La dosis se calcula según la siguiente fórmula:
Número de unidades necesarias = peso corporal (kg) x aumento deseado de la actividad del factor VIII de coagulación sanguínea (%) (UI/dl) x 0,5
La dosis y la frecuencia de administración deben adaptarse siempre individualmente para cada caso, dependiendo de la respuesta del paciente al tratamiento.
- 1.3.1. ESP, etiquetado y prospecto
En el tratamiento de hemorragias, dependiendo de su causa y ubicación, debe mantenerse durante el período de tratamiento recomendado un nivel adecuado de actividad del factor VIII de coagulación sanguínea (en % de la norma o UI/dl).
Al determinar la dosis en función del tipo de hemorragia y del procedimiento quirúrgico, puede utilizarse la siguiente tabla:
| Gravedad de la hemorragia/tipo de procedimiento quirúrgico | Nivel de factor VIII requerido (%) (UI/dl) | Frecuencia de dosificación (horas)/duración del tratamiento (días) |
| Hemorragia aguda Hemorragia reciente en las articulaciones, músculos o hemorragia oral. Hemorragia más grave en las articulaciones, músculos o hemorragia subcutánea. Hemorragias que ponen en peligro la vida. |
| Repetir cada 12-24 horas durante al menos 1 día, hasta que cese el dolor causado por la hemorragia o se produzca la cicatrización de la herida. Repetir las infusiones cada 12-24 horas durante 3-4 días o más, hasta que cese el dolor o se produzca la recuperación. Repetir las infusiones cada 8-24 horas hasta que cese el peligro |
| Procedimientos quirúrgicos Menores Incluyendo la extracción de un diente Mayores |
| Cada 24 horas, durante al menos 1 día, hasta la cicatrización de la herida. Repetir las infusiones cada 8-24 horas hasta lograr una cicatrización adecuada de la herida, luego continuar el tratamiento durante 7 días más, manteniendo la actividad del factor VIII entre el 30% y el 60% (UI/dl) |
Tratamiento profiláctico
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia A grave, se administra generalmente una dosis de 20 a 40 UI/kg de peso corporal cada 2 a 3 días. En algunos casos, especialmente en pacientes jóvenes, puede ser necesario reducir los intervalos de tiempo entre las inyecciones o aumentar la dosis.
- 1.3.1. ESP, etiquetado y prospecto
Durante el tratamiento, para determinar la dosis y la frecuencia de administración de las infusiones, se recomienda realizar pruebas para determinar los niveles de factor VIII en suero. Especialmente en casos de procedimientos quirúrgicos importantes, es necesario un monitoreo preciso del tratamiento de sustitución mediante pruebas de la coagulación.
Los pacientes pueden responder individualmente al tratamiento con factor VIII, lo que se refleja en diferentes niveles de recuperación in vivo y diferentes períodos de semivida en pacientes individuales.
Enfermedad de von Willebrand
En general, se acepta que la administración de 1 UI de VWF:RCo/kg de peso corporal aumenta el nivel de VWF:RCo en un 2% en la circulación. El objetivo del tratamiento es lograr un nivel de VWF:RCo > 0,6 UI/ml (60%) y FVIII:C > 0,4 UI/ml (40%) en suero.
En la mayoría de los casos, para lograr la hemostasia, se recomienda una dosis de 40-80 UI/kg de peso corporal de factor de von Willebrand y 20-40 UI/kg de peso corporal de factor FVIII:C.
Pacientes con enfermedad de von Willebrand del tipo 3, que pueden requerir dosis más altas para mantener los niveles adecuados del factor, pueden necesitar una dosis inicial de 80 UI/kg de peso corporal de factor de von Willebrand.
La dosis adecuada debe administrarse cada 12-24 horas. La dosificación y la duración del tratamiento dependen del estado clínico del paciente, la ubicación y la extensión de la hemorragia, así como del nivel de VWF:RCo y FVIII:C.
- 24 – 48 horas después del inicio del tratamiento, debe considerarse la reducción de la dosis o el aumento del intervalo entre dosis, o el uso de productos medicinales que contengan VWF y una cantidad menor de factor VIII.
Niños y adolescentes
En esta indicación, solo hay datos limitados de estudios clínicos en niños menores de 6 años, y por lo tanto, no hay recomendaciones para el uso de este medicamento en este grupo de edad.
En niños, en las indicaciones mencionadas anteriormente, la adaptación de la dosis para lograr la eficacia clínica se basa, al igual que en adultos, en el cálculo de la dosis en función del peso corporal.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorInstituto Grifols, S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FanidiForma farmacéutica: Polvo, 25 UI/ml; 250 UI + 30 UI/ml; 300 UIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: Polvo, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UIPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requiere recetaForma farmacéutica: Polvo, 1000 UI + 2400 UI/15 mlPrincipio activo: Von Willebrand factor and coagulation factor VIII in combinationFabricante: CSL Behring GmbHRequiere receta
Alternativas a Fanidi en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fanidi en Ukraine
Alternativa a Fanidi en Spain
Médicos online para Fanidi
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fanidi – sujeta a valoración médica y normativa local.














