
Gartior
Consulta con un médico sobre la receta médica de Gartior

Cómo usar Gartior
Hoja de instrucciones del paquete: información para el paciente
Gartior, 18 microgramos/dosis medida, polvo para inhalación en cápsula dura
Tiotropio
Es importante leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Gartior y para qué se utiliza
- 2. Información importante antes de tomar Gartior
- 3. Cómo tomar Gartior
- 4. Posibles efectos adversos
- 5. Cómo conservar Gartior
- 6. Contenido del paquete y otra información
1. Qué es Gartior y para qué se utiliza
Gartior, 18 microgramos/dosis medida, polvo para inhalación en cápsula dura, contiene el principio activo tiotropio y pertenece a un grupo de medicamentos utilizados para tratar enfermedades obstructivas de las vías respiratorias, medicamentos inhalados, medicamentos anticolinérgicos.
Gartior facilita la respiración en personas con enfermedad pulmonar obstructiva crónica (EPOC).
La EPOC es una enfermedad pulmonar crónica que causa dificultad para respirar y tos. El nombre EPOC está relacionado con la bronquitis crónica y el enfisema pulmonar. La EPOC es una enfermedad crónica, por lo que Gartior debe tomarse diariamente, y no solo cuando aparecen problemas para respirar u otros síntomas de la EPOC.
Gartior es un medicamento broncodilatador de acción prolongada que ayuda a ampliar las vías respiratorias y facilita la entrada y salida del aire en los pulmones. El uso regular de Gartior también puede ayudar a reducir la dificultad para respirar persistente asociada con la enfermedad y ayudará a reducir los efectos de la enfermedad en la vida diaria. El uso diario de Gartior también ayudará a prevenir el empeoramiento repentino y temporal de los síntomas de la EPOC, que puede durar varios días. El efecto del medicamento dura 24 horas, por lo que debe tomarse solo una vez al día.
La información sobre la dosificación correcta de Gartior se encuentra en la sección 3. Cómo tomar Gartior y en las instrucciones de uso.
2. Información importante antes de tomar Gartior
Cuándo no tomar Gartior
- si el paciente es alérgico al tiotropio o a cualquier otro componente de este medicamento (enumerado en el punto 6).
- si el paciente es alérgico a la atropina o a sus derivados, como la ipratropio o la oxitropio.
Advertencias y precauciones
Antes de comenzar a tomar Gartior, debe discutirlo con su médico o farmacéutico.
- Debe consultar a su médico si tiene glaucoma de ángulo estrecho, problemas de próstata o dificultades para orinar.
- Si el paciente tiene problemas renales, debe consultar a su médico.
- Gartior está indicado para el tratamiento de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica. No debe utilizarse para tratar los ataques agudos de dificultad para respirar o sibilancias.
- Después de tomar Gartior, pueden ocurrir reacciones alérgicas inmediatas, como erupciones, hinchazón, picazón, sibilancias y dificultad para respirar. En este caso, debe contactar inmediatamente a su médico.
- Inmediatamente después de tomar medicamentos inhalados, como Gartior, puede ocurrir una sensación de opresión en el pecho, tos, sibilancias o dificultad para respirar. En este caso, debe contactar inmediatamente a su médico.
- Debe tener cuidado para que el polvo no entre en los ojos durante la inhalación, ya que puede causar la aparición o empeoramiento de los síntomas del glaucoma de ángulo estrecho, que es una enfermedad ocular. El dolor en los ojos o la incomodidad, la visión borrosa, la visión de un halo de colores alrededor de una fuente de luz o la visión de colores alterada, junto con la hinchazón de los ojos, pueden ser signos de la aparición del glaucoma de ángulo estrecho. Los trastornos oculares pueden ir acompañados de dolor de cabeza, náuseas y vómitos. Si ocurren síntomas del glaucoma de ángulo estrecho, debe suspender el uso de tiotropio y contactar inmediatamente a su médico, preferiblemente un oftalmólogo.
- La sequedad de la mucosa bucal que ocurre durante el uso del medicamento, relacionada con su acción anticolinérgica, puede causar caries dentales después de un período prolongado, por lo que es importante mantener la higiene bucal.
- Si el paciente ha tenido un ataque al corazón en los últimos 6 meses o ha experimentado una arritmia cardíaca inestable o peligrosa para la vida en el último año, debe informar a su médico. Es importante tomar una decisión adecuada sobre si Gartior puede ser utilizado por el paciente.
- No debe tomar Gartior más de una vez al día.
Niños y adolescentes
Gartior no se recomienda para niños y adolescentes menores de 18 años.
Gartior y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Debe informar a su médico o farmacéutico sobre otros medicamentos que esté tomando para la enfermedad pulmonar, como la ipratropio o la oxitropio.
No se han reportado efectos adversos al tomar Gartior con otros medicamentos utilizados para tratar la EPOC, como los medicamentos inhalados de acción rápida, como el salbutamol, las metilxantinas, como la teofilina, y los esteroides orales o inhalados, como el prednisolona.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de tomar este medicamento. No debe tomar este medicamento a menos que lo haya recetado su médico.
Conducción de vehículos y uso de máquinas
Si ocurren mareos, visión borrosa o dolor de cabeza, estos estados pueden afectar la capacidad para conducir vehículos y operar máquinas.
Gartior contiene lactosa
Si se ha determinado previamente que el paciente tiene intolerancia a algunos azúcares o alergia a las proteínas de la leche (que pueden estar presentes en pequeñas cantidades en el componente de lactosa), el paciente debe consultar a su médico antes de tomar el medicamento.
3. Cómo tomar Gartior
Este medicamento siempre debe tomarse según las indicaciones de su médico o farmacéutico. En caso de dudas, debe consultar a su médico o farmacéutico.
La dosis recomendada es la inhalación del contenido de una cápsula (18 microgramos de tiotropio) una vez al día.
Debe realizar 2 inhalaciones de la misma cápsula (véase el punto "Instrucciones de uso" al final de esta hoja de instrucciones).
No debe tomar una dosis mayor que la recomendada.
Gartior no se recomienda para niños y adolescentes menores de 18 años.
Debe tomar la cápsula a la misma hora cada día. Esto es importante, ya que Gartior actúa durante 24 horas.
Las cápsulas solo deben utilizarse para inhalación y no deben tomarse por vía oral. No debe tragar las cápsulas.
El inhalador Vertical-Haler, en el que se coloca la cápsula de Gartior, perfora la cápsula, lo que permite la inhalación del polvo que contiene.
El paciente debe asegurarse de que tenga un inhalador y de que lo esté utilizando correctamente. Las instrucciones de uso del inhalador se encuentran en la sección siguiente de esta hoja de instrucciones.
Debe asegurarse de que no se exhale aire en el inhalador Vertical-Haler.
Si tiene dificultades para utilizar el inhalador Vertical-Haler, debe contactar a su médico, enfermera o farmacéutico para que le indiquen el uso correcto.
El inhalador Vertical-Haler debe limpiarse una vez a la semana. Las instrucciones de limpieza del inhalador se encuentran en la sección siguiente de esta hoja de instrucciones.
Al tomar Gartior, debe tener cuidado para que el polvo no entre en los ojos. Esto puede causar visión borrosa, dolor en los ojos y (o) enrojecimiento de los ojos. Debe enjuagar los ojos con agua tibia y contactar inmediatamente a su médico.
Si siente que los problemas para respirar empeoran, debe contactar inmediatamente a su médico.
Uso de una dosis mayor que la recomendada de Gartior
Si toma más de 1 cápsula de Gartior al día, debe contactar inmediatamente a su médico. El paciente puede tener un mayor riesgo de experimentar efectos adversos, como sequedad de la mucosa bucal, estreñimiento, dificultades para orinar, aceleración del ritmo cardíaco o visión borrosa.
Olvido de una dosis de Gartior
Si el paciente olvida tomar una dosis, debe tomarla tan pronto como recuerde.
Nunca debe tomar dos dosis al mismo tiempo o en el mismo día. La siguiente dosis debe tomarse a la hora habitual.
Suspensión del tratamiento con Gartior
Antes de suspender el tratamiento con Gartior, debe consultar a su médico o farmacéutico.
Después de suspender el tratamiento con Gartior, los síntomas de la EPOC pueden empeorar.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Gartior puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los efectos adversos descritos a continuación han sido reportados por pacientes que tomaron este medicamento. Los efectos adversos se enumeran según su frecuencia: frecuentes, poco frecuentes, raros o frecuencia desconocida.
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas):
- sequedad de la mucosa bucal: generalmente de gravedad leve
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 personas):
- mareos
- dolor de cabeza
- trastornos del gusto
- visión borrosa
- ritmo cardíaco irregular (fibrilación auricular)
- faringoamigdalitis
- ronquera (disfonía)
- tos
- reflujo gastroesofágico (enfermedad de reflujo gastroesofágico)
- estreñimiento
- infecciones fúngicas en la boca y la garganta (candidiasis oral y faríngea)
- erupciones
- dificultades para orinar (retención urinaria)
- dolor al orinar
Raros (pueden ocurrir en hasta 1 de cada 1000 personas):
- dificultades para dormir (insomnio)
- visión de un halo de colores alrededor de una fuente de luz o visión de colores alterada, junto con enrojecimiento de los ojos (glaucoma)
- aumento de la presión en el ojo
- ritmo cardíaco irregular (taquicardia supraventricular)
- aceleración del ritmo cardíaco (taquicardia)
- sensación de ritmo cardíaco acelerado (palpitaciones)
- opresión en el pecho relacionada con tos, sibilancias o dificultad para respirar que ocurren inmediatamente después de la inhalación (broncoespasmo)
- hemorragia nasal
- faringoamigdalitis
- sinusitis
- obstrucción intestinal o falta de movimientos intestinales (obstrucción intestinal, incluyendo obstrucción intestinal paralítica)
- gingivitis
- glositis
- dificultades para tragar (disfagia)
- estomatitis
- náuseas
- reacciones de hipersensibilidad, incluyendo reacciones inmediatas
- reacción alérgica grave que puede causar hinchazón en la cara o la garganta (angioedema)
- urticaria
- picazón
- infecciones del tracto urinario
Frecuencia desconocida (frecuencia no puede ser determinada a partir de los datos disponibles):
- disminución de la cantidad de agua en el cuerpo (deshidratación)
- caries dentales
- reacciones alérgicas graves (reacciones anafilácticas)
- infecciones o úlceras de la piel
- sequedad de la piel
- hinchazón de las articulaciones
Los efectos adversos graves, como las reacciones alérgicas que pueden causar hinchazón en la cara o la garganta (angioedema), o otras reacciones de hipersensibilidad (como la caída repentina de la presión arterial o los mareos) pueden ocurrir solos o como parte de una reacción alérgica grave (reacción anafiláctica) después de tomar Gartior. Además, al igual que con otros medicamentos inhalados, algunos pacientes pueden experimentar opresión en el pecho, tos, sibilancias o dificultad para respirar inmediatamente después de la inhalación (broncoespasmo). Si ocurre alguno de estos síntomas, debe contactar inmediatamente a su médico.
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56, 28071 Madrid
Teléfono: +34 91 596 34 00, fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Gartior
El medicamento debe conservarse en un lugar fuera del alcance de los niños.
No debe tomar este medicamento después de la fecha de caducidad que aparece en el paquete de cartón o en el blister después de: VENC.
La fecha de caducidad es el último día del mes indicado.
El inhalador Vertical-Haler debe desecharse después de 90 días desde su primera utilización.
La cápsula debe utilizarse inmediatamente después de abrir el blister.
No debe conservar a temperaturas superiores a 30°C.
No debe tirar los medicamentos por el desagüe ni por los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Esto ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Gartior?
El principio activo es tiotropio. Cada cápsula contiene 22,5 microgramos de bromuro de tiotropio monohidratado, lo que equivale a 18 microgramos de tiotropio.
La dosis administrada durante la inhalación, desde el extremo del inhalador Vertical-Haler, contiene 10 microgramos de tiotropio.
Los demás componentes son lactosa monohidratada (que puede contener pequeñas cantidades de proteínas de la leche).
La cápsula contiene gelatina, agua purificada, macrogol 4000, dióxido de titanio (E 171), óxido de hierro amarillo (E 172) y azul brillante FCF (E 133).
Cómo se presenta Gartior y qué contiene el paquete?
Gartior, 18 microgramos/dosis medida, polvo para inhalación en cápsula dura, son cápsulas de gelatina duras verdes no transparentes que contienen un polvo blanco.
Blister de folio PA/Aluminio/PVC/Aluminio que contiene 10 cápsulas.
Vertical-Haler es un inhalador de dosis única con una boquilla naranja y un cuerpo blanco. Está hecho de un polímero acrilonitrilo-butadieno-estireno (ABS) y acero inoxidable.
Los materiales que tienen contacto directo con el medicamento en el momento de la inhalación son: acero inoxidable 304 (agujas que perforan la cápsula), acrilonitrilo-butadieno-estireno-ABS (forma parte de la boquilla por la que sale el medicamento y de la cámara de la cápsula).
Los tamaños de paquete disponibles son:
- Caja de cartón que contiene 30 cápsulas (3 blisters) y un inhalador de polvo seco
- Caja de cartón que contiene 60 cápsulas (6 blisters) y un inhalador de polvo seco
- Caja de cartón que contiene 90 cápsulas (9 blisters) y un inhalador de polvo seco
- Caja de cartón que contiene 30 cápsulas (3 blisters)
- Caja de cartón que contiene 60 cápsulas (6 blisters)
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Titular de la autorización de comercialización
Glenmark Pharmaceuticals s.r.o.
Hvězdova 1716/2b
140 78 Praga 4
República Checa
Fabricante/Importador
Pharmadox Healthcare Limited
Kw20a Kordin Industrial Park
Paola, PLA 3000
Malta
Glenmark Pharmaceuticals s.r.o.
Fibichova 143
566 17 Vysoké Mýto
República Checa
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Para obtener información más detallada sobre este medicamento, debe consultar al representante local del titular de la autorización de comercialización:
| País | Nombre del medicamento |
| República Checa | Gartior |
| Polonia | Gartior |
| Eslovaquia | Tiotropium Glenmark |
Glenmark Pharmaceuticals Sp. z o. o.
ul. Dziekońskiego 3
00-728 Varsovia
Tel: +48 22 35 12 500
Correo electrónico: [email protected]
Fecha de la última revisión de la hoja de instrucciones:
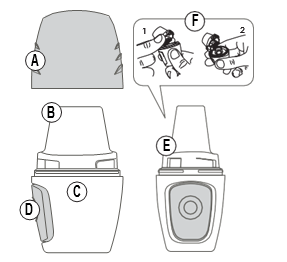
Dispositivo médico: Inhalador de polvo seco
- (inglés: DPI - Dry Powder Inhaler) Nombre comercial: Vertical-Haler
Partes del inhalador:
A) Boquilla D) Botón lateral
B) Extremo E) Espacio abierto
C) Cámara F) Cámara para la cápsula
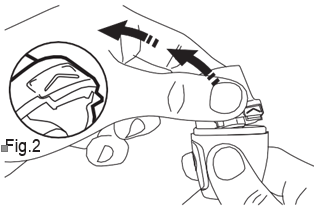
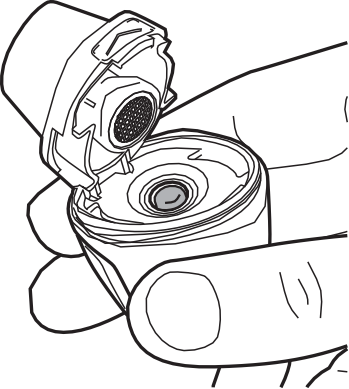
- 1) Retirar la boquillaAl usar el inhalador, las manos deben estar limpias y secas. Debe sostener firmemente la base del inhalador y retirar la boquilla lateral, como se muestra a continuación. (fig. 1).






Antes de usar:
El inhalador ha sido diseñado para
ayudar a la inhalación de medicamentos
en polvo seco contenido en cápsulas;
tal dispositivo es activado por la
inhalación (inhalador de polvo seco
activado por la inhalación - DPI).
Las cápsulas que contienen el medicamento
se almacenan por separado del inhalador.
Cada cápsula que contiene una dosis única debe colocarse en la cámara del inhalador solo en el momento de su uso.
Después de colocar la cápsula en la cámara del inhalador y perforarla con el botón, justo antes de la inhalación, el paciente puede comenzar a inhalar el medicamento.
El inhalador debe venderse solo con el medicamento.
Contraindicaciones:
Pacientes que no pueden controlar su respiración por sí mismos.
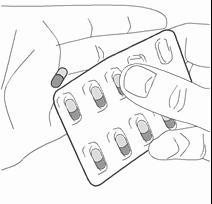
- 3) Retirar la cápsulaDebe retirar la cubierta protectora para sacar la cápsula del blister (fig. 3).
- 4) Colocar la cápsulaDebe sostener el inhalador abierto en posición vertical. Debe colocar la cápsula en la cámara (fig. 4).
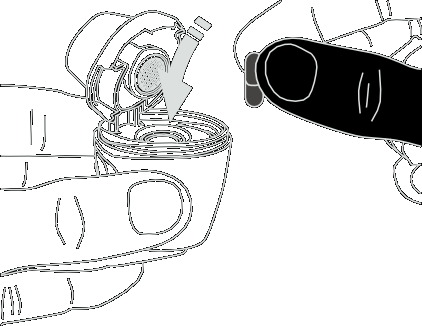
- 5) Verificar la posición correcta de la cápsulaLa cápsula debe estar en el hueco de la cámara (fig. 5).
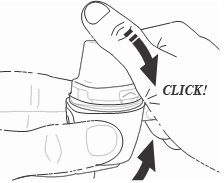
- 6) Cerrar el inhalador Vertical-HalerDebe sostener el inhalador Vertical-Haler en posición vertical y cerrar el extremo. El sonido de "clic" confirma que el inhalador Vertical-Haler se ha cerrado correctamente (fig. 6).
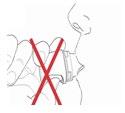
- 8) Realizar una exhalación profundaDebe sostener el inhalador a distancia de los labios y realizar una exhalación tranquila y profunda (fig. 9). Debe contener la respiración.
No debe soplar aire en el inhalador. El aire húmedo soplado en el interior del inhalador
puede reducir la dosis inhalada.
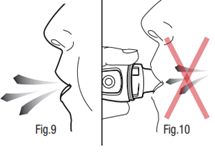
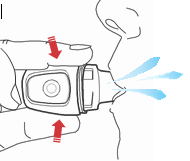

- 10) Contener la respiraciónDebe contener la respiración durante al menos 10 segundos. Debe retirar el inhalador de los labios y respirar normalmente (fig. 9). Esto asegura que el medicamento se deposita en los pulmones. Debe repetir los pasos del 8 al 10 para asegurarse de que se ha administrado toda la dosis del medicamento.

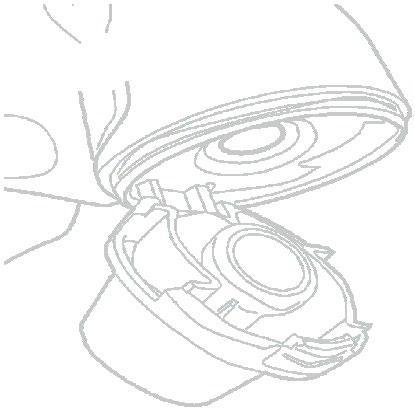
- 11) Verificar la cápsula vacíaDebe abrir el inhalador Vertical-Inhaler y verificar si queda polvo del medicamento en la cápsula. Si el polvo todavía está en la cápsula, debe repetir los pasos del 8 al 11.
- 12) Vaciar el inhalador Vertical-HalerDebe retirar la cápsula vacía (fig. 13). La cápsula puede haberse roto en fragmentos pequeños que pueden haber entrado en la boca o la garganta. No debe preocuparse por esto, ya que el componente de la cápsula es comestible y no es perjudicial.
- 13) Limpiar el inhalador Vertical-HalerEl inhalador Vertical-Haler debe limpiarse una vez a la semana. El extremo del inhalador y la cámara de la cápsula deben limpiarse con un paño limpio y seco. Alternativamente, puede usar un cepillo suave y limpio para eliminar cualquier residuo que pueda haber quedado dentro del inhalador. Debe cerrar el inhalador Vertical-Haler.
Debe volver a colocar la boquilla en el extremo para proteger el dispositivo de los contaminantes.
No debe usar agua ni detergentes agresivos para limpiar el dispositivo.
- 14) Enjuagar la bocaDebe enjuagar la boca con agua, sin tragar el agua.
- 15) Desechar el dispositivoEl inhalador Vertical-Inhaler está diseñado para usarse solo con el medicamento que se suministra con él y con ningún otro. Si el paciente recibe un nuevo paquete con un nuevo inhalador Vertical-Haler, debe desechar el inhalador antiguo.
Precauciones adicionales:
No debeintercambiar el inhalador
Vertical-Haler con otras personas. Existe
un riesgo grave de infección cruzada.
Puede desecharlo con los residuos domésticos.
El inhalador solo debe usarse con el medicamento
suministrado, según las indicaciones.
No debeabrir la cápsula y tocar el polvo.
No debecolocar más de una cápsula en la cámara
del inhalador ni colocar dos medicamentos diferentes.
El ruido en la habitación puede dificultar la
escucha para determinar si el dispositivo está
funcionando correctamente. Se recomienda
usar el dispositivo en una habitación tranquila.
Para obtener información adicional sobre el uso
del inhalador, debe consultar a su médico o
farmacéutico.
No debedesmontar el inhalador.
Si ocurren problemas con el uso del dispositivo
médico, el paciente debe devolverlo al titular
de la autorización de comercialización o a su
representante en un paquete que garantice la
integridad física.
Todos los incidentes graves que ocurran después
de usar el dispositivo médico deben notificarse
al titular de la autorización de comercialización
que tiene la autorización de comercialización y
al organismo nacional de vigilancia correspondiente.

- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGlenmark Pharmaceuticals s.r.o. Pharmadox Healthcare Limited
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a GartiorForma farmacéutica: Polvo, 18 mcgPrincipio activo: tiotropium bromideFabricante: Ferrer Internacional, S.A.Requiere recetaForma farmacéutica: Polvo, 10 mcgPrincipio activo: tiotropium bromideFabricante: Actavis Ltd. Laboratorios Liconsa S.A. Teva Operations Poland Sp. z o.o. Teva Pharma B.V.Requiere recetaForma farmacéutica: Polvo, 18 mcg/dosis medidaPrincipio activo: tiotropium bromideNo requiere receta
Alternativas a Gartior en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Gartior en Ucrania
Alternativa a Gartior en España
Médicos online para Gartior
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Gartior – sujeta a valoración médica y normativa local.














