
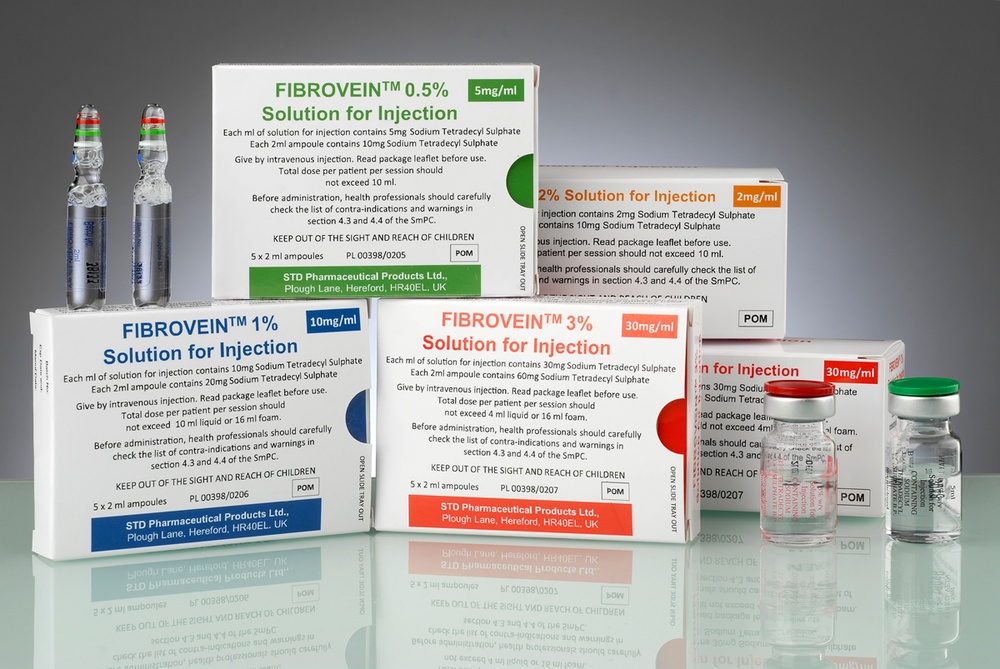
Fibrovein

Consulta con un médico sobre la receta médica de Fibrovein

Cómo usar Fibrovein
Hoja de instrucciones del paquete: información para el paciente
Fibrovein, 0,2%, 0,5%, 1% y 3%, solución para inyección
Tetradecilsulfato sódico
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
Si tiene alguna duda, debe consultar a su médico o enfermera.
Si el paciente experimenta algún efecto adverso grave, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera.
Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Fibrovein y para qué se utiliza
- 2. Información importante antes de usar Fibrovein
- 3. Cómo usar Fibrovein
- 4. Posibles efectos adversos
- 5. Cómo conservar Fibrovein
- 6. Contenido del paquete y otra información
1. Qué es Fibrovein y para qué se utiliza
Fibrovein contiene el principio activo tetradecilsulfato sódico.
Fibrovein está disponible en diferentes concentraciones y se utiliza para tratar varices, venas dilatadas grandes, medianas y pequeñas, y telangiectasias.
El principio activo del medicamento pertenece a los llamados medicamentos esclerosantes. Los medicamentos esclerosantes son sustancias químicas que, cuando se inyectan en una vena afectada por la enfermedad, causan hinchazón de su superficie interior y adhesión de sus paredes. El flujo sanguíneo a través de la vena se vuelve imposible y, finalmente, se produce una cicatrización del tejido. Después de varias semanas, la vena generalmente deja de ser visible.
Fibrovein está indicado exclusivamente para uso en adultos.
2. Información importante antes de usar Fibrovein
Cuándo no usar Fibrovein:
- si el paciente es alérgico al tetradecilsulfato sódico o a alguno de los demás componentes de este medicamento (enumerados en el punto 6) o si el paciente tiene una enfermedad alérgica;
- si el paciente no puede caminar por cualquier razón o está postrado en cama;
- si el paciente tiene un mayor riesgo de formación de coágulos sanguíneos en el sistema venoso debido a:
- enfermedad sanguínea hereditaria, por ejemplo, trombofilia;
- uso de medicamentos anticonceptivos hormonales o terapia hormonal de reemplazo;
- obesidad severa;
- fumar;
- inmovilización prolongada;
- si el paciente ha tenido coágulos sanguíneos recientemente en venas superficiales o profundas, o en los pulmones;
- si el paciente ha sido operado recientemente;
- si el paciente tiene venas retorcidas (varices de las extremidades inferiores) causadas por tumores en la pelvis o el abdomen, a menos que el tumor haya sido eliminado;
- si el paciente tiene una enfermedad sistémica no controlada, como diabetes, hipertiroidismo, asma, anormalidades en la sangre, infección sanguínea o trastornos cutáneos o dificultades para respirar recientemente;
- si el paciente tiene hinchazón o enrojecimiento de la piel, calor o sensibilidad al tacto (inflamación del tejido conectivo);
- si el paciente tiene alguna infección;
- si el paciente tiene un tumor en crecimiento;
- si el paciente ha sido diagnosticado con un cierre anormal de las válvulas venosas (insuficiencia valvular);
- si el paciente tiene un coágulo en una arteria;
- si el paciente ha sido diagnosticado con inflamación aguda de las venas de las extremidades inferiores (flebitis aguda);
- si el paciente tiene un agujero en el corazón (solo en el caso de que se use el esclerosante en forma de espuma).
Precauciones y advertencias
Antes de comenzar a usar Fibrovein, el paciente debe discutir con su médico si:
es alérgico a algún alimento o medicamento, o si tiene alguna otra alergia, antes de tomar el medicamento, debe consultar a su médico para que pueda administrarle una dosis de prueba durante 24 horas antes de continuar con el tratamiento;
ha tenido coágulos sanguíneos en venas superficiales o profundas, o en los pulmones en el pasado;tiene un agujero en el corazón (en el caso de que se use el esclerosante en forma de espuma).
tiene un agujero en el corazón (en el caso de que se use el esclerosante en forma de espuma).
tiene migrañas;
tiene trastornos venosos en las piernas, que se asocian con un estado prolongado que causa hinchazón de los tejidos del cuerpo (linfedema). Fibrovein puede aumentar el dolor y la inflamación local durante varios días o semanas;
ha tenido hipertensión pulmonar en el pasado;ha tenido un ataque transitorio de isquemia (ATI), un accidente cerebrovascular o un incidente cerebral grave;ha sido diagnosticado con una enfermedad de las arterias o venas (aterosclerosis);ha sido diagnosticado con coágulos y inflamación de las arterias y venas de las manos y los pies (enfermedad de Buerger);tiene dificultades para respirar, que se controlan con tratamiento (asma).
Fibrovein solo debe ser administrado por un médico, y si las directrices nacionales lo permiten, el medicamento puede ser administrado bajo la supervisión de un médico por personal médico calificado, con experiencia en anatomía del sistema venoso y familiarizado con la técnica correcta de inyección.
Antes de realizar la inyección, el médico puede realizar una evaluación de la función valvular venosa del paciente.
Antes de comenzar el tratamiento, el médico le hará al paciente algunas preguntas sobre su estado de salud y le proporcionará información sobre los posibles efectos adversos asociados con el tratamiento.
Durante el tratamiento
El médico monitoreará al paciente durante y después del tratamiento de escleroterapia para detectar signos de sensibilidad (enrojecimiento, picazón, tos) o síntomas neurológicos (trastornos visuales, migrañas, hormigueo o entumecimiento).
El médico recomendará al paciente que regrese para una visita de seguimiento.
Niños y adolescentes
No se ha establecido la seguridad y eficacia de Fibrovein en niños y adolescentes.
Fibrovein y otros medicamentos
Si el paciente está tomando medicamentos anticonceptivos hormonales (píldoras) o está sometido a terapia hormonal de reemplazo, puede haber un mayor riesgo de formación de coágulos sanguíneos en las venas (véase "Cuándo no usar Fibrovein").
El paciente debe informar a su médico o enfermera sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los que se venden sin receta.
Embarazo y lactancia
La paciente debe informar a su médico si:
está embarazada o cree que podría estar embarazada;
planea quedarse embarazada;
está amamantando.
No se ha establecido la seguridad del uso de Fibrovein durante el embarazo. Fibrovein no debe usarse en mujeres embarazadas a menos que sea absolutamente necesario. El médico decidirá si Fibrovein es adecuado para el paciente.
No se sabe si Fibrovein se excreta en la leche materna. Si la paciente está amamantando, el médico decidirá si Fibrovein es adecuado para ella.
Conducción de vehículos y uso de maquinaria
Después de usar Fibrovein, para reducir el riesgo de inflamación y decoloración de la piel, el médico puede recomendar vendaje adecuado de las piernas y (o) uso de medias de compresión, lo que puede afectar la capacidad de conducir vehículos.
Fibrovein contiene sodio, potasio y alcohol bencílico
Este medicamento contiene:
menos de 1 mmol (23 mg) de sodio por vial/ampolla, es decir, el medicamento se considera "libre de sodio".
menos de 1 mmol (39 mg) de potasio por vial/ampolla, es decir, el medicamento se considera "libre de potasio".
40 mg de alcohol bencílico en cada ampolleta de 2 ml o 100 mg de alcohol bencílico en cada vial de 5 ml, lo que equivale a 20 mg/ml. El alcohol bencílico puede causar reacciones alérgicas. En caso de embarazo, lactancia o enfermedad hepática o renal, debe consultar a su médico o farmacéutico. Esto se debe a que el alcohol bencílico puede acumularse en el organismo y causar efectos adversos (llamados "acidosis metabólica").
3. Cómo usar Fibrovein
Nodebe intentar inyectarse Fibrovein por su cuenta. El tratamiento siempre debe ser realizado por un médico experimentado, capacitado en las técnicas correctas de inyección.
El tratamiento consiste en inyectar muy lentamente y con mucha precaución el medicamento en las venas afectadas por la enfermedad, utilizando las agujas más pequeñas posible, lo que permite eliminar la sangre de las venas. El medicamento se puede mezclar manualmente utilizando dos jeringas y un conector, para crear una mezcla con aire y producir una espuma que ayuda a eliminar la sangre de las venas más grandes. En este caso, el medicamento debe ser administrado por un médico capacitado en las técnicas correctas de preparación y administración del medicamento en forma de espuma.
En el caso del tratamiento de varices no visibles de las extremidades inferiores y de la escleroterapia con espuma, el procedimiento debe realizarse bajo control de ultrasonido.
El médico decidirá qué concentración de Fibrovein usar y qué áreas tratar. Las dosis recomendadas son:
Adultos y ancianos
- de 0,1 ml a 2 ml de Fibrovein por inyección. El médico puede inyectar como máximo 10 ml de tres concentraciones más bajas de Fibrovein, pero no más de 4 ml en el caso de la concentración más alta.
Debido a las limitaciones de la dosis diaria máxima del esclerosante, puede ser necesario repetir el procedimiento varias veces.
Después de finalizar el tratamiento con Fibrovein, el paciente debe seguir las instrucciones del médico. El médico puede recomendar vendaje adecuado de las piernas y (o) uso de medias de compresión para reducir el riesgo de inflamación y decoloración de la piel.
Si el paciente tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, Fibrovein puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Pueden ocurrir efectos adversos graves. Debe interrumpir el tratamiento con Fibrovein y consultar inmediatamente a un médico o acudir a la sala de emergencias del hospital más cercano si ocurre alguno de los siguientes síntomas:
No muy frecuentes (pueden ocurrir en hasta 1 de cada 100 personas)
- Coágulos sanguíneos en las venas profundas (trombosis venosa profunda, probablemente causada por la enfermedad subyacente). Los síntomas incluyen dolor, hinchazón y sensibilidad en una pierna (generalmente en la pantorrilla), dolor intenso en el área afectada, enrojecimiento de la piel en el área del coágulo o calor.
Raros (pueden ocurrir en hasta 1 de cada 1,000 personas)
- Necrosis local de la piel o, con menos frecuencia, de los nervios. Los síntomas incluyen dolor, cambio de color de la piel (enrojecimiento), hinchazón o acumulación de líquido, ampollas en la piel (que pueden estar llenas de líquido claro o sangre), color rojo oscuro, púrpura o negro de la piel, sensaciones anormales (hormigueo, picazón, ardor), entumecimiento o pérdida de sensibilidad
Muy raros (pueden ocurrir en hasta 1 de cada 10,000 personas)
- La reacción alérgica más grave es el choque anafiláctico, que puede causar dificultad para respirar o una caída repentina de la presión arterial, lo que puede provocar mareo o pérdida de conciencia. El choque anafiláctico es raro, pero puede ser mortal, por lo que si ocurre, es necesario administrar tratamiento inmediato.
- Obstrucción de una arteria causada por un coágulo, lo que puede provocar:
o
un accidente cerebrovascular o una interrupción del flujo sanguíneo al cerebro o al ojo (ataque isquémico transitorio).
Los síntomas pueden incluir debilidad, entumecimiento o parálisis de la cara, la mano o la pierna, generalmente en un lado del cuerpo, habla confusa o dificultad para entender a los demás, ceguera en un ojo o visión doble.
o
un embolia pulmonar. Los síntomas pueden incluir dificultad para respirar repentina, dolor agudo en el pecho que puede empeorar con la respiración profunda o la tos, latido cardíaco rápido o respiración acelerada.
Para proteger a los pacientes de este efecto adverso muy raro, no debe usarse este medicamento en pacientes con un mayor riesgo de formación de coágulos sanguíneos en las venas y arterias (riesgo de trombosis).
- Insuficiencia cardíaca. Los síntomas pueden incluir sensación de cansancio, mareo, pérdida de conciencia, dolor en el pecho, dificultad para respirar, debilidad, mareo, náuseas y palpitaciones.
- Necrosis del tejido en caso de inyección en una arteria. Los síntomas pueden variar dependiendo de la cantidad de medicamento inyectado, el lugar de la inyección y la rapidez con la que se recibe atención médica. Pueden incluir dolor, pero sin daño duradero, hasta la pérdida de grandes áreas de tejido, incluida la pérdida de un pie, lo que puede provocar la necesidad de amputación de la extremidad.
Otros efectos adversos que pueden ocurrir incluyen:
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- Flebitis superficial.
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas)
- Dolor o ardor (transitorio en el lugar de la inyección);
- Pigmentación de la piel;
- Expansión de los capilares subcutáneos en el lugar de la inyección (llamado "matting").
No muy frecuentes (pueden ocurrir en hasta 1 de cada 100 personas):
- Reacciones alérgicas o no alérgicas locales en la piel, como enrojecimiento, picazón, erupción o hinchazón;
- Trastornos visuales;
- Migraña.
Raros (pueden ocurrir en hasta 1 de cada 1,000 personas):
- Tos, dificultad para respirar, sensación de opresión o presión en el pecho;
- Ardor, picazón, hormigueo o picazón en la piel;
- Dolor de cabeza, sensación de mareo;
- Desorientación, mareo, pérdida de conciencia.
Muy raros (pueden ocurrir en hasta 1 de cada 10,000 personas):
- Fiebre, escalofríos, erupción cutánea roja y picazón (urticaria);
- Náuseas, vómitos, diarrea, sensación de tener la lengua hinchada o aumentada, sequedad en la boca;
- Flebitis.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, o a la autoridad competente del país.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Fibrovein
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No hay recomendaciones especiales para la temperatura de conservación del medicamento.
- No congelar.
- Las ampollas y los viales deben conservarse en el paquete exterior para protegerlos de la luz.
- No usar este medicamento después de la fecha de caducidad que aparece en el paquete de cartón después de "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
Solo para uso único. El contenido del paquete debe usarse inmediatamente después de abrirlo.
Los restos de medicamento no utilizado deben eliminarse.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Fibrovein?
El principio activo del medicamento es tetradecilsulfato sódico.
En el caso de una concentración del 0,2%
Cada ml de solución para inyección contiene 2 mg de tetradecilsulfato sódico.
Cada vial de 5 ml contiene 10 mg de tetradecilsulfato sódico.
En el caso de una concentración del 0,5%
Cada ml de solución para inyección contiene 5 mg de tetradecilsulfato sódico.
Cada ampolla de 2 ml contiene 10 mg de tetradecilsulfato sódico.
En el caso de una concentración del 1%
Cada ml de solución para inyección contiene 10 mg de tetradecilsulfato sódico.
Cada ampolla de 2 ml contiene 20 mg de tetradecilsulfato sódico.
En el caso de una concentración del 3%
Cada ml de solución para inyección contiene 30 mg de tetradecilsulfato sódico.
Cada ampolla de 2 ml contiene 60 mg de tetradecilsulfato sódico.
Cada vial de 5 ml contiene 150 mg de tetradecilsulfato sódico.
Los demás componentes del medicamento son: alcohol bencílico (20 mg/ml), fosfato disódico dodecahidratado, fosfato monopotásico, agua para inyección, hidróxido sódico (para ajustar el pH). Véase el punto 2 "Fibrovein contiene sodio y potasio".
Cómo se presenta Fibrovein y qué contiene el paquete?
Fibrovein es una solución para inyección que se presenta en ampollas o viales de vidrio. La solución es transparente, incolora, estéril y no contiene partículas sólidas visibles.
Fibrovein, 0,2%: el paquete contiene 2, 5 o 10 viales de 5 ml.
Fibrovein, 0,5%: el paquete contiene 5 ampollas de 2 ml.
Fibrovein, 1%: el paquete contiene 5 ampollas de 2 ml.
Fibrovein, 3%: el paquete contiene 5 ampollas de 2 ml o 2, 5 o 10 viales de 5 ml.
No todas las tallas de paquete deben estar en circulación.
Titular de la autorización de comercialización y fabricante:
Titular de la autorización de comercialización:
STD Pharmaceutical (Ireland) Limited
Block 1, Blanchardstown Corporate Park, Ballycoolen Road, Blanchardstown, Dublín 15
D15 AKK1, Irlanda
+353 1588 6916
Fabricante:
Medipha Sante
Les Fjords-Immeuble Oslo
19 Avenue de Norvege
91953 Courtaboeuf CEDEX
Francia
Chemische Fabrik Kreussler & Co. GmbH
Rheingaustrasse 87-93
65203 Wiesbaden,
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Fibrovein
Bulgaria, República Checa, Francia, Alemania,
Irlanda, Holanda, Polonia, Rumania
Austria, España
Veinfibro
Fecha de la última revisión de la hoja de instrucciones:05/2024
Otras fuentes de información:
Información detallada sobre este medicamento está disponible en el sitio web de la Agencia Europea de Medicamentos
www.ema.europa.eu
Información destinada exclusivamente a profesionales de la salud:
Fibrovein, 0,2%, solución para inyección
Fibrovein, 0,5%, solución para inyección
Fibrovein, 1%, solución para inyección
Fibrovein, 3%, solución para inyección
Información adicional sobre este producto se encuentra en la Ficha Técnica del Medicamento (FTM).
Dosificación y administración
Dosificación
Fibrovein está indicado exclusivamente para administración intravenosa. Según el tamaño y la gravedad de las lesiones venosas, se requiere el uso de diferentes concentraciones. Las telangiectasias deben tratarse solo con una concentración del 0,2%, y las varices reticulares con una concentración del 0,5%. La concentración del 1% es más efectiva para las varices pequeñas y medianas, y la concentración del 3% para las lesiones venosas más grandes. El tamaño de las varices no visibles debe determinarse bajo control de ultrasonido.
El esclerosante debe administrarse en pequeñas cantidades iguales a lo largo de la vena afectada por la enfermedad. Fibrovein en concentraciones del 0,2% y del 0,5% debe administrarse en forma líquida. Fibrovein en concentraciones del 1% y del 3% puede administrarse en forma líquida o en forma de espuma (según se describe en la tabla a continuación). El objetivo del procedimiento es lograr la destrucción óptima de las paredes del vaso con la concentración mínima efectiva del medicamento necesario para un tratamiento eficaz. Una concentración demasiado alta del medicamento puede provocar necrosis del tejido u otras complicaciones.
Adultos
| Concentración | Dosis estándar para inyección intravenosa en los lugares designados para el procedimiento | Dosis total máxima para inyección en el procedimiento | ||
| Líquido | Espuma* | Líquido | Espuma* | |
| Fibrovein, 0,2% y 0,5% | de 0,1 a 1,0 ml | No aplica | 10 ml | No aplica |
| Fibrovein, 1% | de 0,1 a 1,0 ml | de 0,5 a 2,0 ml | 10 ml | 16 ml |
| Fibrovein, 3% | de 0,5 a 2,0 ml | de 0,5 a 2,0 ml | 4 ml | 16 ml |
*Suma de los volúmenes de líquido y aire
En casos en los que se requiere una precaución especial, se recomienda realizar una prueba de sensibilidad, administrando al paciente de 0,25 a 0,5 ml del medicamento Fibrovein y observando al paciente durante varias horas, y luego administrarle una segunda dosis o una dosis mayor.
El procedimiento a menudo requiere repetición (el paciente necesita en promedio 2 a 4 procedimientos adicionales) debido a la dosis limitada que se puede administrar durante un procedimiento. Para proteger al paciente de una reacción alérgica, al comienzo de cada procedimiento se recomienda administrar una pequeña dosis de prueba del medicamento Fibrovein.
Fibrovein, 1% y 3% solución para inyección
En el caso de la administración del esclerosante en forma de espuma
La espuma destinada al tratamiento de venas más grandes se puede preparar utilizando el medicamento Fibrovein en concentraciones del 1% y del 3%. La espuma debe prepararse justo antes de su administración. Debe ser administrada al paciente por un médico capacitado en las técnicas correctas de preparación y administración del medicamento en forma de espuma. Es recomendable que el procedimiento de escleroterapia con espuma se realice bajo control de ultrasonido.
Fibrovein, 0,2% solución para inyección
En el caso de las telangiectasias para inyección
Para el tratamiento de las telangiectasias, debe utilizarse una aguja lo más pequeña posible (por ejemplo, 30 G) y el medicamento debe inyectarse lentamente para permitir la eliminación de la sangre de los vasos venosos tratados. También se puede utilizar una técnica que consiste en la administración adicional de aire, llamada air-block.
Ancianos
No hay recomendaciones especiales para la dosificación.
Niños y adolescentes
No se ha establecido la seguridad y eficacia del medicamento Fibrovein en niños y adolescentes. No hay datos.
Vía de administración
Las instrucciones a continuación se refieren a la preparación de la espuma. El método de preparación de la espuma es la técnica de Tessari. También se pueden utilizar otras técnicas (por ejemplo, DSS, Easyfoam, Sterivein).
Al preparar Fibrovein para la administración, debe mantenerse una técnica estrictamente estéril.
Fibrovein está destinado a un uso único y administración parenteral. Después de abrir el vial o la ampolla, el medicamento debe usarse inmediatamente y los restos del medicamento no utilizado deben eliminarse.
Antes de usar, debe realizarse una inspección visual para detectar la presencia de partículas sólidas. Si la solución contiene partículas sólidas, no debe usarse.
Es recomendable que el procedimiento de escleroterapia con espuma se realice bajo control de ultrasonido. En este caso, el medicamento debe ser administrado por un médico capacitado en las técnicas correctas de preparación y administración del medicamento en forma de espuma.
Incompatibilidades
No debe mezclarse este medicamento con heparina.
No debe mezclarse el medicamento con otros medicamentos, ya que no se han realizado estudios sobre la compatibilidad.
Precauciones y advertencias especiales
Fibrovein debe administrarse solo por un médico, y si las directrices nacionales lo permiten, el medicamento puede ser administrado bajo la supervisión de un médico por personal médico calificado, con experiencia en anatomía del sistema venoso, diagnóstico y tratamiento de enfermedades venosas, y conocedor de la técnica correcta de inyección.
También se han notificado reacciones alérgicas, incluido el choque anafiláctico, por lo que el médico que administra este medicamento debe estar preparado para aplicar un tratamiento contra el choque.
Durante el procedimiento, el médico debe tener acceso directo a equipo de reanimación de emergencia.
Debido a la precaución especial, el paciente debe ser tratado en un hospital.
En caso de extravasación, pueden ocurrir efectos adversos locales graves, incluida la necrosis del tejido, por lo que debe tenerse cuidado al insertar la aguja y se debe inyectar la dosis mínima efectiva en cada lugar de inyección. La solución debe inyectarse lentamente.
Debe tenerse cuidado para no inyectar la solución en una arteria, ya que puede causar necrosis del tejido y provocar la necesidad de amputación de la extremidad.
Debe tenerse cuidado al realizar inyecciones en el pie y por encima y por debajo de la pantorrilla ( malleolus) debido al riesgo para una de las arterias. En el tratamiento de venas de menor tamaño, debe aplicarse compresión, ya que la probabilidad de pigmentación puede ser mayor si ocurre extravasación de sangre en el lugar de la inyección.
Preparación de la espuma y administración
Recomendaciones generales
La calidad de la espuma depende de condiciones específicas:
Concentración del medicamento: la espuma solo se puede preparar utilizando tetradecilsulfato sódico en concentraciones del 1% al 3%.
Proporción de líquido a aire: generalmente, la proporción es de 1 volumen de líquido por 3 a 4 volúmenes de aire.
Número de bombas de la mezcla de esclerosante/aire de una jeringa a otra: el médico debe seguir el número de bombas especificado para cada técnica.
Consistencia macroscópica de la espuma: antes de la administración, debe controlarse la calidad de la espuma fuera de la jeringa. La espuma debe ser uniforme, suave y coherente sin burbujas grandes visibles. Si la espuma contiene burbujas grandes, debe desecharse y prepararse una nueva espuma.
Tiempo total de preparación de la espuma: la preparación de la espuma debe llevar aproximadamente 10 segundos desde la primera hasta la última bomba del líquido de una jeringa a otra.
Tiempo máximo entre la preparación y la administración de la espuma: la espuma del esclerosante debe usarse dentro de los 60 segundos después de su preparación. Después de 60 segundos, los restos de la espuma no utilizada deben desecharse. Si es necesario, se puede preparar más espuma.
Preparación de la espuma (técnica de Tessari)
Al preparar la espuma, debe mantenerse una técnica estrictamente estéril.
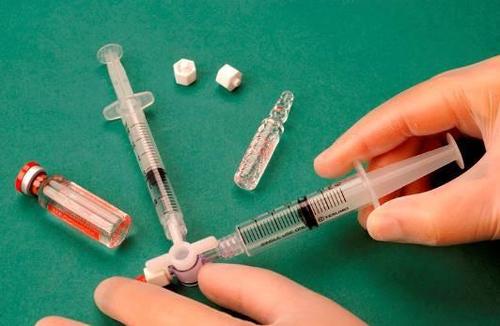
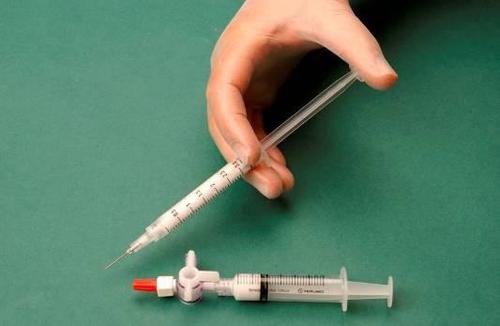
Para preparar la espuma para una jeringa estéril, se toma 1 ml de esclerosante líquido y se introduce en una jeringa, y 3 ml o 4 ml de aire estéril se introducen en otra jeringa. El aire se aspira a través de un filtro esterilizante de 0,2 μm, lo que garantiza su esterilidad. Las jeringas se conectan utilizando un conector de tres vías estéril (figura 1). Se recomienda el uso de jeringas del tipo Luer Lock y protección para los ojos. La conexión de una jeringa con conector Luer Slip al conector de tres vías bajo presión puede fallar y provocar una fuga no controlada del medicamento.
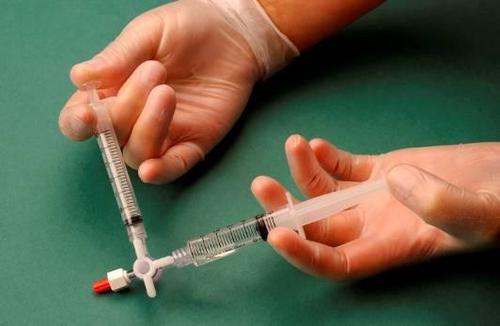
Después de conectar las jeringas, la mezcla de esclerosante/aire se bombea dinámicamente alrededor de 20 veces de una jeringa a otra a través del conector de tres vías hasta lograr una espuma de consistencia uniforme y suave (figuras 2 y 3).
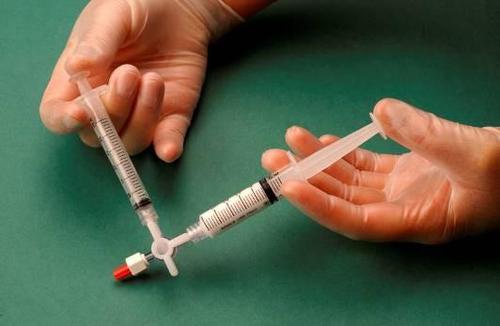
La jeringa que contiene la espuma se retira del conector y se utiliza para realizar la inyección inmediatamente, a través de la cual se administra la espuma al vaso (figura 4).
La espuma del esclerosante debe usarse dentro de los 60 segundos después de su preparación. Después de 60 segundos, los restos de la espuma no utilizada deben desecharse. Si es necesario, se puede preparar más espuma.
Antes de la administración, debe controlarse la calidad de la espuma. La espuma debe tener una consistencia uniforme, ser blanca y no contener burbujas grandes visibles para el ojo desnudo.
Excipientes
Este medicamento contiene:
menos de 1 mmol (23 mg) de sodio por vial/ampolla, es decir, el medicamento se considera "libre de sodio".
menos de 1 mmol (39 mg) de potasio por vial/ampolla, es decir, el medicamento se considera "libre de potasio".
40 mg de alcohol bencílico en cada ampolla de 2 ml o 100 mg de alcohol bencílico en cada vial de 5 ml, lo que equivale a 20 mg/ml. El alcohol bencílico puede causar reacciones alérgicas. Puede causar acidosis metabólica en caso de embarazo, lactancia o enfermedad hepática o renal.
- País de registro
- Principio activo
- Requiere recetaNo
- ImportadorChemische Fabrik Kreussler Co.GmbH Medipha Sante
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FibroveinForma farmacéutica: Solución, 0.2% (2 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere recetaForma farmacéutica: Solución, 0.5% (5 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere recetaForma farmacéutica: Solución, 1% (10 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere receta
Alternativas a Fibrovein en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fibrovein en España
Médicos online para Fibrovein
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fibrovein – sujeta a valoración médica y normativa local.














