
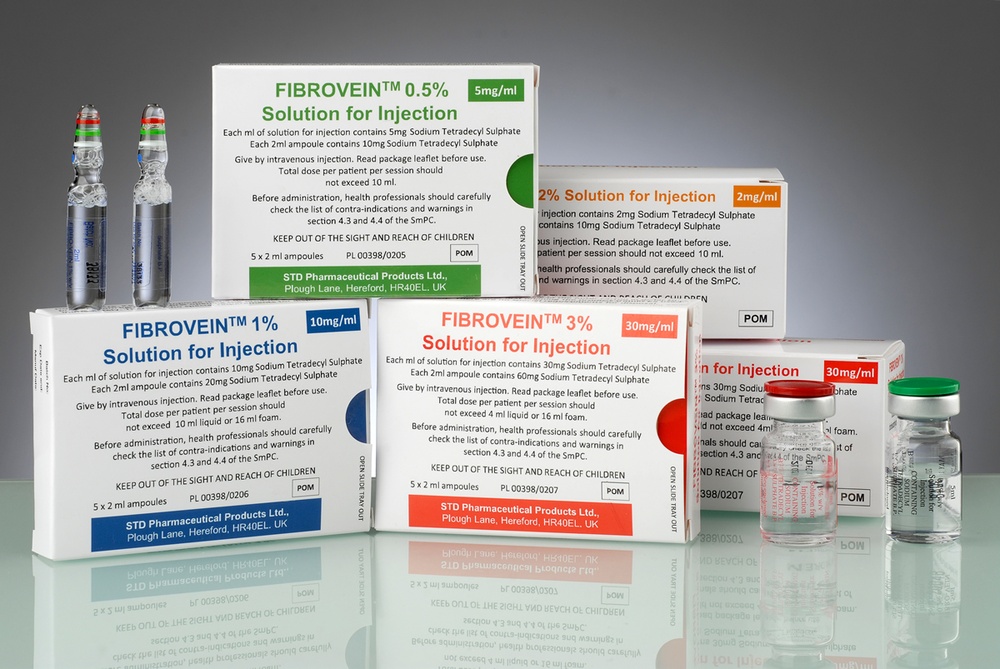
Fibrovein

Consulta con un médico sobre la receta médica de Fibrovein

Cómo usar Fibrovein
Hoja de instrucciones del paquete: información para el paciente
Fibrovein, 0,2%, 0,5%, 1% y 3%, solución para inyección
Tetradecilsulfato de sodio
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
Si tiene alguna duda, debe consultar a su médico o enfermera.
Si el paciente presenta algún efecto adverso grave, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera.
Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Fibrovein y para qué se utiliza
- 2. Información importante antes de usar Fibrovein
- 3. Cómo usar Fibrovein
- 4. Efectos adversos posibles
- 5. Cómo conservar Fibrovein
- 6. Contenido del paquete y otra información
1. Qué es Fibrovein y para qué se utiliza
Fibrovein contiene el principio activo tetradecilsulfato de sodio.
Fibrovein está disponible en diferentes concentraciones y se utiliza para tratar las varices, los vasos sanguíneos dilatados grandes, medianos y pequeños, y las arañas vasculares.
El principio activo del medicamento pertenece a los llamados medicamentos esclerosantes. Los medicamentos esclerosantes son sustancias químicas que, cuando se inyectan en una vena afectada por la enfermedad, causan hinchazón de su superficie interior y adhesión de sus paredes. El flujo sanguíneo a través de la vena se vuelve imposible y, finalmente, se produce la cicatrización del tejido. Después de varias semanas, la vena generalmente deja de ser visible.
Fibrovein está indicado exclusivamente para uso en adultos.
2. Información importante antes de usar Fibrovein
Cuándo no usar Fibrovein:
- si el paciente es alérgico al tetradecilsulfato de sodio o a alguno de los demás componentes de este medicamento (enumerados en el punto 6) o si el paciente tiene una enfermedad alérgica;
- si el paciente no puede caminar por cualquier razón o está postrado en cama;
- si el paciente tiene un mayor riesgo de formación de coágulos sanguíneos en el sistema venoso debido a:
- enfermedad sanguínea hereditaria, como trombofilia;
- uso de medicamentos anticonceptivos hormonales o terapia hormonal de reemplazo;
- obesidad severa;
- fumar;
- inmovilización prolongada;
- si el paciente ha tenido coágulos sanguíneos recientemente en las venas superficiales o profundas, o en los pulmones;
- si el paciente ha sido operado recientemente;
- si el paciente tiene venas retorcidas (varices de las extremidades inferiores) causadas por tumores en la pelvis o el abdomen, a menos que el tumor haya sido eliminado;
- si el paciente tiene una enfermedad sistémica no controlada, como diabetes, hipertiroidismo, asma, anormalidades en la sangre, infección sanguínea o trastornos cutáneos o respiratorios recientes;
- si el paciente tiene hinchazón o enrojecimiento de la piel, calidez o sensibilidad al tacto (inflamación del tejido conjuntivo);
- si el paciente tiene alguna infección;
- si el paciente tiene un tumor en crecimiento;
- si el paciente ha sido diagnosticado con cierre anormal de las válvulas venosas profundas (insuficiencia valvular);
- si el paciente tiene un coágulo en una arteria;
- si el paciente ha sido diagnosticado con inflamación aguda de las venas de las extremidades inferiores (flebitis aguda);
- si el paciente tiene un agujero en el corazón (solo en caso de que se use el esclerosante en forma de espuma).
Precauciones y advertencias
Antes de comenzar a usar Fibrovein, el paciente debe discutir con su médico si:
es alérgico a algún alimento o medicamento, o si tiene alguna otra alergia, antes de tomar el medicamento, debe consultar a su médico para que pueda administrarle una dosis de prueba durante 24 horas antes de continuar con el tratamiento;
ha tenido coágulos sanguíneos en las venas superficiales o profundas, o en los pulmones en el pasado;tiene un agujero en el corazón (en caso de que se use el esclerosante en forma de espuma).
tiene un agujero en el corazón (en caso de que se use el esclerosante en forma de espuma).
tiene migrañas;
tiene trastornos venosos en las piernas, lo que puede estar asociado con un estado de hinchazón crónica de los tejidos (linfedema). Fibrovein puede empeorar el dolor y la inflamación local durante varios días o semanas;
ha tenido hipertensión pulmonar en el pasado;ha tenido un ataque transitorio de isquemia cerebral (ATI), un accidente cerebrovascular o un incidente cerebral grave;ha sido diagnosticado con una enfermedad arterial o venosa (aterosclerosis);ha sido diagnosticado con coágulos y inflamación de las arterias y venas de las manos y los pies (enfermedad de Buerger);tiene dificultades para respirar, que están controladas con tratamiento (asma).
Fibrovein solo debe ser administrado por un médico, y si las directrices nacionales lo permiten, el medicamento puede ser administrado bajo la supervisión de un médico por personal médico calificado, con experiencia en anatomía del sistema venoso y familiarizado con la técnica correcta de inyección.
Antes de realizar la inyección, el médico puede realizar una evaluación de la función valvular venosa del paciente.
Antes de comenzar el tratamiento, el médico le hará al paciente algunas preguntas sobre su estado de salud y le proporcionará información sobre los posibles efectos adversos asociados con el tratamiento.
Durante el tratamiento
El médico monitoreará al paciente durante y después del tratamiento de escleroterapia para detectar signos de sensibilidad (enrojecimiento, picazón, tos) o síntomas neurológicos (trastornos visuales, migrañas, hormigueo o entumecimiento).
El médico recomendará al paciente que regrese para una visita de seguimiento.
Niños y adolescentes
No se ha establecido la seguridad y eficacia de Fibrovein en niños y adolescentes.
Fibrovein y otros medicamentos
Si el paciente está tomando medicamentos anticonceptivos hormonales (píldoras) o está sometido a terapia hormonal de reemplazo, puede haber un mayor riesgo de formación de coágulos sanguíneos en las venas (véase "Cuándo no usar Fibrovein").
El paciente debe informar a su médico o enfermera sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los que se venden sin receta.
Embarazo y lactancia
La paciente debe informar a su médico si:
está embarazada o cree que puede estar embarazada;
planea quedarse embarazada;
está amamantando.
No se ha establecido la seguridad de usar Fibrovein durante el embarazo. No se debe usar Fibrovein en mujeres embarazadas a menos que sea absolutamente necesario. El médico decidirá si Fibrovein es adecuado para el paciente.
No se sabe si Fibrovein pasa a la leche materna. Si la paciente está amamantando, el médico decidirá si Fibrovein es adecuado para ella.
Conducción de vehículos y uso de maquinaria
Después de usar Fibrovein, para reducir el riesgo de inflamación y decoloración de la piel, el médico puede recomendar vendaje adecuado de las piernas y (o) uso de medias de compresión, lo que puede afectar la capacidad de conducir vehículos.
Fibrovein contiene sodio, potasio y alcohol bencílico
Este medicamento contiene:
menos de 1 mmol (23 mg) de sodio por vial/ampolla, es decir, el medicamento se considera "libre de sodio".
menos de 1 mmol (39 mg) de potasio por vial/ampolla, es decir, el medicamento se considera "libre de potasio".
40 mg de alcohol bencílico en cada ampolleta de 2 ml o 100 mg de alcohol bencílico en cada vial de 5 ml, lo que equivale a 20 mg/ml. El alcohol bencílico puede causar reacciones alérgicas. En caso de embarazo, lactancia o enfermedad hepática o renal, se debe consultar a un médico o farmacéutico. Esto se debe a que el alcohol bencílico puede acumularse en el organismo y causar efectos adversos (llamados "acidosis metabólica").
3. Cómo usar Fibrovein
Nose debe intentar inyectar Fibrovein por cuenta propia. El tratamiento siempre debe ser realizado por un médico experimentado, capacitado en las técnicas correctas de inyección.
El tratamiento consiste en inyectar muy lentamente y con mucho cuidado el medicamento en las venas afectadas por la enfermedad, utilizando las agujas más pequeñas posibles, lo que permite eliminar la sangre de las venas. El medicamento se puede mezclar manualmente utilizando dos jeringas y un conector para crear una mezcla con aire y producir una espuma que ayuda a eliminar la sangre de las venas más grandes. En este caso, el medicamento debe ser administrado por un médico capacitado en las técnicas correctas de producción y administración del medicamento en forma de espuma.
En el caso del tratamiento de varices invisibles de las extremidades inferiores y la escleroterapia con espuma, el procedimiento debe realizarse bajo control de ultrasonido.
El médico decidirá qué concentración de Fibrovein usar y qué áreas tratar. Las dosis recomendadas son:
Adultos y ancianos
- de 0,1 ml a 2 ml de Fibrovein por inyección. El médico puede inyectar un máximo de 10 ml de tres concentraciones más pequeñas de Fibrovein, pero no más de 4 ml en el caso de la concentración más grande.
Debido a las limitaciones de la dosis diaria máxima del esclerosante, puede ser necesario repetir el procedimiento varias veces.
Después de completar el tratamiento con Fibrovein, el paciente debe seguir las instrucciones del médico. El médico puede recomendar vendaje adecuado de las piernas y (o) uso de medias de compresión para reducir el riesgo de inflamación y decoloración de la piel.
Si el paciente tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o enfermera.
4. Efectos adversos posibles
Como cualquier medicamento, Fibrovein puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Pueden ocurrir efectos adversos graves. Debe interrumpir el tratamiento con Fibrovein y consultar inmediatamente a un médico o acudir a la sala de emergencias del hospital más cercano si ocurre alguno de los siguientes síntomas:
No muy frecuentes (pueden ocurrir en hasta 1 de cada 100 personas)
- Coágulos sanguíneos en las venas profundas (trombosis venosa profunda, probablemente causada por la enfermedad subyacente). Los síntomas incluyen dolor, hinchazón y sensibilidad en una pierna (generalmente en la pantorrilla), dolor intenso en el área afectada, enrojecimiento de la piel en el área del coágulo o calidez.
Raros (pueden ocurrir en hasta 1 de cada 1.000 personas)
- Necrosis local de la piel o, con menor frecuencia, de los nervios. Los síntomas incluyen dolor, cambio de color de la piel (enrojecimiento), hinchazón o acumulación de líquido, ampollas en la piel (que pueden estar llenas de líquido claro o sangre), color rojo oscuro, púrpura o negro de la piel, sensaciones anormales (hormigueo, picazón, ardor), entumecimiento o pérdida de sensibilidad
Muy raros (pueden ocurrir en hasta 1 de cada 10.000 personas)
- La reacción alérgica más grave es la anafilaxia, que puede causar dificultad para respirar o una caída repentina de la presión arterial, lo que puede provocar mareo o pérdida de conciencia. La anafilaxia es rara, pero puede ser mortal, por lo que si ocurre, se debe administrar tratamiento inmediato.
- Obstrucción de una arteria debido a un coágulo, lo que puede causar:
o
un accidente cerebrovascular o una interrupción del flujo sanguíneo al cerebro o al ojo (ataque isquémico transitorio).
Los síntomas pueden incluir debilidad, entumecimiento o parálisis de la cara, la mano o la pierna, generalmente en un lado del cuerpo, habla confusa o dificultad para entender a los demás, ceguera en un ojo o visión doble.
o
un embolia pulmonar. Los síntomas pueden incluir dificultad para respirar, dolor agudo en el pecho que puede empeorar con la respiración profunda o la tos, latido cardíaco rápido o respiración acelerada.
Para proteger a los pacientes de este efecto adverso muy raro, no se debe usar este medicamento en pacientes con un mayor riesgo de formación de coágulos sanguíneos en las venas y arterias (riesgo de trombosis).
- Insuficiencia cardíaca. Los síntomas pueden incluir sensación de fatiga, mareo, pérdida de conciencia, dolor en el pecho, dificultad para respirar, debilidad, mareo, náuseas y palpitaciones.
- Necrosis del tejido en caso de inyección en una arteria. Los síntomas pueden variar dependiendo de la cantidad de medicamento inyectado, el lugar de la inyección y la rapidez con la que se recibe atención médica. Pueden incluir dolor, pero sin daño duradero, hasta la pérdida de grandes áreas de tejido, incluida la pérdida de un pie, lo que puede requerir amputación.
Otros efectos adversos que pueden ocurrir incluyen:
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- Flebitis superficial.
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas)
- Dolor o ardor (transitorio en el lugar de la inyección);
- Pigmentación de la piel;
- Extensión de los vasos sanguíneos subcutáneos en el lugar de la inyección (llamado "matting").
No muy frecuentes (pueden ocurrir en hasta 1 de cada 100 personas):
- Reacciones alérgicas o no alérgicas de la piel, como enrojecimiento, picazón, erupción o hinchazón;
- Trastornos visuales;
- Migraña.
Raros (pueden ocurrir en hasta 1 de cada 1.000 personas):
- Tos, dificultad para respirar, sensación de opresión en el pecho;
- Ardor, hormigueo, picazón o picazón en la piel;
- Dolor de cabeza, sensación de mareo;
- Desorientación, mareo, pérdida de conciencia.
Muy raros (pueden ocurrir en hasta 1 de cada 10.000 personas):
- Fiebre, escalofríos, erupción cutánea roja y picazón (urticaria);
- Náuseas, vómitos, diarrea, sensación de tener la lengua hinchada o aumentada, sequedad en la boca;
- Flebitis.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, se debe informar al médico o enfermera. Los efectos adversos se pueden notificar directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, o al centro de farmacovigilancia de la comunidad autónoma correspondiente.
Los efectos adversos también se pueden notificar al titular de la autorización de comercialización.
La notificación de efectos adversos es importante, ya que permite recopilar más información sobre la seguridad de este medicamento.
5. Cómo conservar Fibrovein
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No hay recomendaciones especiales para la temperatura de conservación del medicamento.
- No congelar.
- Los viales y ampolletas deben conservarse en el paquete exterior para protegerlos de la luz.
- No usar este medicamento después de la fecha de caducidad que se indica en el paquete de cartón después de "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
Solo para uso único. El contenido del paquete debe usarse inmediatamente después de abrirlo.
Se deben eliminar todos los restos del producto no utilizado.
No se deben tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Se debe preguntar a un farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Fibrovein?
El principio activo del medicamento es tetradecilsulfato de sodio.
En el caso de una concentración del 0,2%
Cada ml de solución para inyección contiene 2 mg de tetradecilsulfato de sodio.
Cada vial de 5 ml contiene 10 mg de tetradecilsulfato de sodio.
En el caso de una concentración del 0,5%
Cada ml de solución para inyección contiene 5 mg de tetradecilsulfato de sodio.
Cada ampolleta de 2 ml contiene 10 mg de tetradecilsulfato de sodio.
En el caso de una concentración del 1%
Cada ml de solución para inyección contiene 10 mg de tetradecilsulfato de sodio.
Cada ampolleta de 2 ml contiene 20 mg de tetradecilsulfato de sodio.
En el caso de una concentración del 3%
Cada ml de solución para inyección contiene 30 mg de tetradecilsulfato de sodio.
Cada ampolleta de 2 ml contiene 60 mg de tetradecilsulfato de sodio.
Cada vial de 5 ml contiene 150 mg de tetradecilsulfato de sodio.
Los demás componentes del medicamento son: alcohol bencílico (20 mg/ml), fosfato disódico dodecahidratado, fosfato dipotásico, agua para inyección, hidróxido de sodio (para ajustar el pH). Véase el punto 2 "Fibrovein contiene sodio y potasio".
Cómo se presenta Fibrovein y qué contiene el paquete?
Fibrovein es una solución para inyección que se presenta en ampolletas o viales de vidrio. La solución es transparente, incolora, estéril y no contiene partículas sólidas visibles.
Fibrovein, 0,2%: el paquete contiene 2, 5 o 10 viales de 5 ml.
Fibrovein, 0,5%: el paquete contiene 5 ampolletas de 2 ml.
Fibrovein, 1%: el paquete contiene 5 ampolletas de 2 ml.
Fibrovein, 3%: el paquete contiene 5 ampolletas de 2 ml o 2, 5 o 10 viales de 5 ml.
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante:
Titular de la autorización de comercialización:
STD Pharmaceutical (Ireland) Limited
Block 1, Blanchardstown Corporate Park, Ballycoolen Road, Blanchardstown, Dublín 15
D15 AKK1, Irlanda
+353 1588 6916
Fabricante:
Medipha Sante
Les Fjords-Immeuble Oslo
19 Avenue de Norvege
91953 Courtaboeuf CEDEX
Francia
Chemische Fabrik Kreussler & Co. GmbH
Rheingaustrasse 87-93
65203 Wiesbaden,
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Fibrovein
Bulgaria, República Checa, Francia, Alemania,
Irlanda, Holanda, Polonia, Rumania
Austria, España
Veinfibro
Fecha de la última revisión de la hoja de instrucciones:05/2024
Otras fuentes de información:
Información detallada sobre este medicamento está disponible en el sitio web de la Agencia Europea de Medicamentos
www.ema.europa.eu
Información destinada exclusivamente a profesionales de la salud:
Fibrovein, 0,2%, solución para inyección
Fibrovein, 0,5%, solución para inyección
Fibrovein, 1%, solución para inyección
Fibrovein, 3%, solución para inyección
Información adicional sobre este producto se encuentra en la Ficha Técnica del Medicamento (FTM).
Dosificación y administración
Dosificación
El medicamento Fibrovein está indicado exclusivamente para administración intravenosa. Dependiendo del tamaño y la gravedad de las lesiones venosas, se requiere el uso de diferentes concentraciones. Las arañas vasculares deben tratarse solo con la concentración del 0,2%, y las varices en red con la concentración del 0,5%. La concentración del 1% es más efectiva para las varices pequeñas y medianas, y la concentración del 3% para las lesiones venosas más grandes. El tamaño de las varices invisibles debe determinarse bajo control de ultrasonido.
El esclerosante debe administrarse intravenosamente en pequeñas cantidades iguales a lo largo del curso de la vena afectada por la enfermedad. Fibrovein en concentraciones del 0,2% y del 0,5% debe administrarse en forma de líquido. Fibrovein en concentraciones del 1% y del 3% puede administrarse en forma de líquido o en forma de espuma (mezcla de esclerosante con aire) según lo descrito en la tabla a continuación. El objetivo del tratamiento es lograr la destrucción óptima de las paredes del vaso después de la administración del esclerosante a la concentración mínima efectiva necesaria para un tratamiento eficaz. Una concentración demasiado alta del medicamento puede provocar necrosis del tejido u otras complicaciones.
Adultos
| Concentración | Dosis estándar para inyección intravenosa en los sitios designados para el tratamiento | Dosis total máxima para inyección en el tratamiento | ||
| Líquido | Espuma* | Líquido | Espuma* | |
| Fibrovein, 0,2% y 0,5% | de 0,1 a 1,0 ml | No aplica | 10 ml | No aplica |
| Fibrovein, 1% | de 0,1 a 1,0 ml | de 0,5 a 2,0 ml | 10 ml | 16 ml |
| Fibrovein, 3% | de 0,5 a 2,0 ml | de 0,5 a 2,0 ml | 4 ml | 16 ml |
*Suma de los volúmenes de líquido y aire
En casos en los que se requiere especial precaución, se recomienda realizar una prueba de sensibilidad, administrando al paciente de 0,25 a 0,5 ml del medicamento Fibrovein y observando al paciente durante varias horas, y luego administrar una segunda dosis o una dosis mayor.
El tratamiento a menudo requiere repetición (en promedio, el paciente necesita 2 a 4 tratamientos adicionales) debido a la dosis limitada que se puede administrar en un solo tratamiento. Para proteger al paciente de una reacción alérgica, al comienzo de cada tratamiento se recomienda administrar una pequeña dosis de prueba del medicamento Fibrovein.
Fibrovein, 1% y 3% solución para inyección
En el caso de la administración del esclerosante en forma de espuma
La espuma destinada al tratamiento de venas más grandes se puede preparar utilizando el medicamento Fibrovein en concentraciones del 1% y del 3%. La espuma debe prepararse justo antes de su administración. Debe ser administrada al paciente por un médico adecuadamente capacitado en las técnicas correctas de producción y administración del medicamento en forma de espuma. Es recomendable que el tratamiento de escleroterapia con espuma se realice bajo control de ultrasonido.
Fibrovein, 0,2% solución para inyección
En el caso de las arañas vasculares para inyección
Se debe utilizar la aguja más pequeña posible (por ejemplo, 30 G) y se debe inyectar el medicamento lentamente para permitir la eliminación de la sangre de los vasos sanguíneos venosos que se están tratando. También se puede utilizar la técnica de inyección de aire adicional, llamada air-block.
Personas mayores
No hay recomendaciones especiales para la dosificación.
Niños y adolescentes
No se ha establecido la seguridad y eficacia del medicamento Fibrovein en niños y adolescentes. No hay datos.
Administración
A continuación, se presentan las instrucciones para la preparación de la espuma. El método de preparación de la espuma es la técnica de Tessari. También se pueden utilizar otras técnicas (por ejemplo, DSS, Easyfoam, Sterivein).
Al preparar Fibrovein para la administración, se deben mantener condiciones estrictamente asépticas.
Fibrovein está destinado a un uso único y administración parenteral. Después de abrir el vial o la ampolleta, el producto debe usarse inmediatamente y se deben eliminar los restos del medicamento no utilizado.
Antes de usar, se debe realizar un control visual para detectar la presencia de partículas sólidas. Si la solución contiene partículas sólidas, no se debe usar.
Es recomendable que el tratamiento de escleroterapia con espuma se realice bajo control de ultrasonido. En este caso, el medicamento debe ser administrado por un médico adecuadamente capacitado en las técnicas correctas de producción y administración del medicamento en forma de espuma.
Incompatibilidades farmacéuticas
No se debe mezclar este medicamento con heparina.
No se debe mezclar el medicamento con otros medicamentos, ya que no se han realizado estudios sobre la compatibilidad.
Precauciones y advertencias especiales
Fibrovein debe ser administrado exclusivamente por un médico, y si las directrices nacionales lo permiten, el medicamento puede ser administrado bajo la supervisión de un médico por personal médico calificado, que tenga experiencia en anatomía del sistema venoso, diagnóstico y tratamiento de enfermedades venosas, y conozca la técnica correcta de inyección.
Se han notificado reacciones alérgicas, incluida la anafilaxia, por lo que el médico que administra este medicamento debe estar preparado para aplicar un tratamiento contra el choque.
Durante el tratamiento, el médico debe tener acceso directo a equipos de reanimación de emergencia.
Debido a la especial precaución, el paciente debe ser tratado en un hospital.
En caso de extravasación, pueden ocurrir efectos adversos graves locales, incluida la necrosis del tejido, por lo que se debe tener especial cuidado al insertar la aguja y se debe inyectar la dosis mínima efectiva en cada sitio de inyección. La solución se debe inyectar lentamente.
Se debe tener especial cuidado para no inyectar la solución en una arteria, ya que puede causar necrosis del tejido, lo que puede llevar a la amputación de una extremidad.
Se debe tener especial cuidado al realizar inyecciones en el pie y por encima y por debajo de la pantorrilla ( malleolus) debido al riesgo para una de las arterias. En el tratamiento de venas de menor tamaño, se debe aplicar compresión, ya que la probabilidad de pigmentación puede ser mayor si ocurre extravasación de sangre en el sitio de inyección.
Preparación de la espuma y administración
Recomendaciones generales
La calidad de la espuma depende de condiciones específicas:
Concentración del producto: la espuma solo se puede preparar utilizando tetradecilsulfato de sodio en concentraciones del 1% al 3%.
Proporción de líquido a aire: generalmente, esta proporción es de 1 volumen de líquido por 3 a 4 volúmenes de aire.
Número de bombas de la mezcla de esclerosante/aire de una jeringa a otra: el médico debe seguir el número de bombas especificado para cada técnica.
Consistencia macroscópica de la espuma: antes de la administración, se debe controlar la calidad de la espuma fuera de la jeringa. La espuma debe ser uniforme, suave y coherente sin burbujas grandes visibles. Si la espuma contiene burbujas grandes, se debe desechar y preparar una nueva espuma.
Tiempo total de preparación de la espuma: la preparación de la espuma debe tomar alrededor de 10 segundos desde la primera hasta la última bomba del líquido de una jeringa a otra.
Tiempo máximo entre la preparación y la inyección de la espuma: la espuma del esclerosante debe usarse dentro de los 60 segundos después de su preparación. Después de 60 segundos, se deben desechar los restos de la espuma no utilizada. Si es necesario, se debe preparar más espuma.
Antes de la administración, se debe controlar la calidad de la espuma. La espuma debe tener una consistencia uniforme, ser blanca y no contener burbujas grandes visibles para el ojo desnudo.
Preparación de la espuma (técnica de Tessari)
Al preparar la espuma, se deben mantener condiciones estrictamente asépticas.
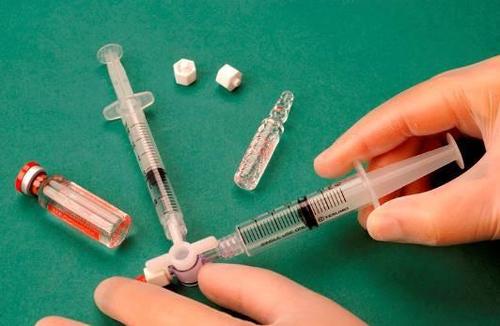
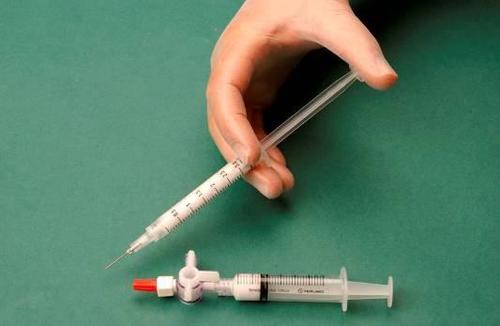
Para preparar la espuma para una jeringa estéril, se toma 1 ml de esclerosante líquido y se introduce en una jeringa, y 3 ml o 4 ml de aire estéril se introducen en otra jeringa. El aire se aspira a través de un filtro esterilizante de 0,2 μm, lo que garantiza su esterilidad. Las jeringas se conectan utilizando un conector de tres vías estéril (figura 1). Se recomienda el uso de jeringas del tipo Luer Lock y protección para los ojos. La conexión de una jeringa con conector Luer Slip al conector de tres vías bajo presión puede fallar y provocar una fuga no controlada del producto.
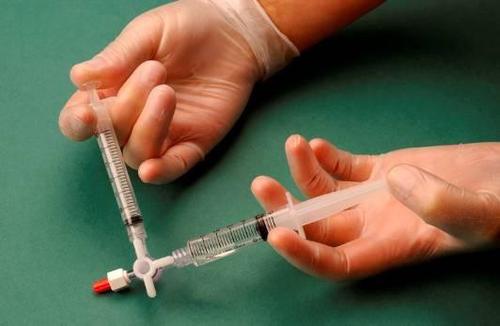
Después de conectar las jeringas, la mezcla de esclerosante/aire se bombea dinámicamente alrededor de 20 veces de una jeringa a otra a través del conector de tres vías hasta lograr una espuma de consistencia uniforme y suave (figuras 2 y 3).
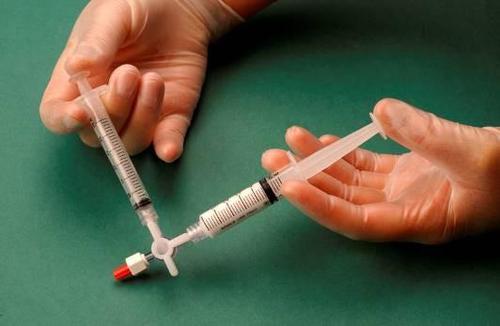
La jeringa que contiene la espuma se retira del conector y se utiliza para realizar la inyección inmediatamente, a través de la cual se administra la espuma al vaso (figura 4).
La espuma del esclerosante debe usarse dentro de los 60 segundos después de su preparación. Después de 60 segundos, se deben desechar los restos de la espuma no utilizada. Si es necesario, se debe preparar más espuma.
Antes de la administración, se debe controlar la calidad de la espuma. La espuma debe tener una consistencia uniforme, ser blanca y no contener burbujas grandes visibles para el ojo desnudo.
Excipientes
Este medicamento contiene:
menos de 1 mmol (23 mg) de sodio por vial/ampolla, es decir, el medicamento se considera "libre de sodio".
menos de 1 mmol (39 mg) de potasio por vial/ampolla, es decir, el medicamento se considera "libre de potasio".
40 mg de alcohol bencílico en cada ampolleta de 2 ml o 100 mg de alcohol bencílico en cada vial de 5 ml, lo que equivale a 20 mg/ml. El alcohol bencílico puede causar reacciones alérgicas. Puede causar acidosis metabólica en caso de embarazo, lactancia o enfermedad hepática o renal.
- País de registro
- Principio activo
- Requiere recetaNo
- ImportadorChemische Fabrik Kreussler Co.GmbH Medipha Sante
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FibroveinForma farmacéutica: Solución, 0.5% (5 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere recetaForma farmacéutica: Solución, 1% (10 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere recetaForma farmacéutica: Solución, 3% (30 mg/ml)Principio activo: sodium tetradecyl sulfateNo requiere receta
Alternativas a Fibrovein en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fibrovein en Испания
Médicos online para Fibrovein
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fibrovein – sujeta a valoración médica y normativa local.














