
Biotum
Consulta con un médico sobre la receta médica de Biotum

Cómo usar Biotum
Hoja de instrucciones del paquete: información para el usuario
Biotum, 500 mg, polvo para preparar solución para inyección
Ceftazidina
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Biotum y para qué se utiliza
- 2. Información importante antes de tomar Biotum
- 3. Cómo tomar Biotum
- 4. Posibles efectos adversos
- 5. Cómo conservar Biotum
- 6. Contenido del paquete y otra información
1. Qué es Biotum y para qué se utiliza
Biotum es un antibiótico utilizado en adultos y niños (incluidos recién nacidos). Actúa de manera bactericida sobre las bacterias que causan infecciones. Pertenece a un grupo de medicamentos llamados cefalosporinas .
Biotum se utiliza para tratar infecciones bacterianas graves:
- de las vías respiratorias inferiores, incluyendo los pulmones
- de los pulmones y los bronquios en pacientes con fibrosis quística
- del cerebro (meningitis)
- del oído
- del tracto urinario
- de la piel y los tejidos blandos
- de la cavidad abdominal y las membranas que la rodean (peritonitis)
- de los huesos y las articulaciones.
Biotum también se puede utilizar:
- para prevenir infecciones durante la resección transuretral de la próstata en hombres
- para tratar a pacientes con una baja cantidad de glóbulos blancos (neutropenia) que tienen fiebre debido a una infección bacteriana.
2. Información importante antes de tomar Biotum
Cuándo no tomar Biotum
- Si el paciente es alérgico a la ceftazidima o a cualquier otro componente de este medicamento (enumerado en el punto 6).
- Si el paciente ha experimentado alguna vez una reacción alérgica gravea cualquier otro antibiótico(penicilinas, monobactámicos y carbapenémicos), ya que el paciente también puede ser alérgico a Biotum.
➢
Si el paciente sospecha que se aplican las circunstancias descritas anteriormente, debe informar a su médicoantes de comenzar el tratamiento con Biotum.
No se debe administrar Biotum al paciente.
Precauciones y advertencias
Antes de comenzar a tomar Biotum, debe discutirlo con su médico o enfermera.
Debe prestar atención a si durante el tratamiento con Biotum, el paciente experimenta síntomas especiales, como reacciones alérgicas, trastornos del sistema nervioso y trastornos gastrointestinales, incluyendo diarrea. Esto reducirá el riesgo de posibles problemas. Véase "Síntomas a tener en cuenta" en el punto 4. Si el paciente ha experimentado alguna vez una reacción alérgica a otros antibióticos, puede ser alérgico a Biotum.
Se han notificado reacciones cutáneas graves con ceftazidima, incluyendo síndrome de Stevens-Johnson, necrolisis epidérmica tóxica, reacción medicamentosa con eosinofilia y síntomas sistémicos (DRESS) y pustulosis exantemática generalizada aguda (AGEP). Si el paciente experimenta alguno de los síntomas asociados con estas reacciones cutáneas graves descritas en el punto 4, debe ponerse en contacto con su médico de inmediato.
Análisis de sangre y orina
Biotum puede alterar los resultados de las pruebas de detección de azúcar en la orina y las pruebas de sangre conocidas como prueba de Coombs.
- Debe informar a la persona que toma las muestrasde que el paciente ha tomado Biotum.
Biotum y otros medicamentos
Debe decirle a su médico todos los medicamentos que esté tomando actualmente o recientemente, así como cualquier medicamento que planea tomar.
El paciente no debe tomar Biotum sin consultar a su médico, si también está tomando:
- un antibiótico llamado clorafenicol
- un antibiótico del grupo llamado aminoglucósidos, como la gentamicina o la tobramicina
- pastillas diuréticas que contienen furosemida.
➢
Si las circunstancias descritas anteriormente se aplican al paciente, debe informar a su médico.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de tomar este medicamento.
El médico decidirá si los beneficios de tomar Biotum durante el embarazo y la lactancia superan los riesgos para el feto.
Conducción de vehículos y uso de maquinaria
Biotum puede causar efectos adversos que afecten la capacidad de conducir vehículos o operar maquinaria, como mareos (véase el punto 4). El paciente no debe conducir vehículos ni operar maquinaria a menos que esté seguro de que no experimenta estos efectos adversos.
Biotum contiene sodio
Cada vial de Biotum de 500 mg contiene 30 mg de sodio. Esto equivale al 1,5% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos.
El medicamento contiene 60 mg de sodio (principal componente de la sal común) por gramo de polvo. Esto equivale al 3% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos. Esto debe tenerse en cuenta en pacientes con función renal reducida y en pacientes que controlan el contenido de sodio en su dieta.
Preparación del medicamento para administración - véase el punto: "Información destinada exclusivamente al personal médico especializado" al final de la hoja de instrucciones. Al calcular el contenido total de sodio en la solución preparada, debe tenerse en cuenta el sodio procedente del diluyente. Para obtener información precisa sobre el contenido de sodio en la solución utilizada para diluir el medicamento, debe consultar la hoja de instrucciones del paciente del diluyente utilizado.
3. Cómo tomar Biotum
Este medicamento siempre debe tomarse según las indicaciones de su médico. Si tiene alguna duda, debe consultar a su médico.
Biotum suele administrarse por un médico o enfermera.Puede administrarse en goteo(infusión intravenosa) o como inyección directa en una vena o inyección intramuscular. Biotum se prepara por un médico o enfermera utilizando agua para inyección o otro líquido de infusión adecuado.
Dosis habitual
El médico decidirá la dosis adecuada de Biotum para el paciente, teniendo en cuenta la gravedad y el tipo de infección, la ingesta de otros antibióticos por parte del paciente, su peso corporal, edad y función renal.
Recién nacidos y lactantes (de 0 a 2 meses)
Por cada kilogramo de peso corporal del lactante, se administran de 25 mg a 60 mg de Biotum en dos dosis divididas durante 24 horas.
Lactantes (mayores de 2 meses) y niñoscon un peso corporal inferior a 40 kg por cada kilogramo de peso corporal del lactante o niñose administran de 100 mg a 150 mg de Biotum en tres dosis divididas durante 24 horas. Máximo 6 g al día.
Adultos y adolescentescon un peso corporal de 40 kg o más
De 1 g a 2 g de Biotum tres veces al día. Máximo 9 g al día.
Pacientes mayores de 65 años
La dosis diaria no debe ser superior a 3 g al día, especialmente en pacientes mayores de 80 años.
Pacientes con riñones enfermos
El paciente puede recibir una dosis diferente a la habitual. El médico o enfermera decidirá qué dosis de Biotum debe administrarse al paciente, dependiendo de la gravedad de la enfermedad renal. El médico supervisará atentamente al paciente y puede ordenar análisis de función renal más frecuentes.
Uso de una dosis mayor de la recomendada de Biotum
En caso de administración accidental de una dosis mayor de la prescrita de Biotum, debe ponerse en contacto de inmediato con su médico o acudir al hospital más cercano.
Omision de la administración de Biotum
Si el paciente no ha tomado una inyección, debe administrarla lo antes posible.
No debe tomar una dosis doble (dos inyecciones al mismo tiempo) para compensar la dosis omitida, sino que debe tomar la siguiente dosis a la hora habitual.
Interrupción del tratamiento con Biotum
No debe dejar de tomar las dosis de Biotum sin el consejo de su médico.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Síntomas a tener en cuenta
➢
Los síntomas adversos graves descritos a continuación se han producido en un pequeño número de personas, pero su frecuencia exacta es desconocida (la frecuencia no puede determinarse a partir de los datos disponibles).
Si el paciente experimenta alguno de los siguientes síntomas, debe ponerse en contacto con su médico de inmediato:
- Reacción alérgica grave. Los síntomas son: erupción cutánea con picazón y hinchazón, sometimes en la cara o los labios, que puede causar dificultad para respirar.
- Manchas rojizas en el tronco, manchas que parecen un escudo o círculo, a menudo con ampollas centrales, descamación de la piel, úlceras en la boca, la garganta, la nariz, los genitales y los ojos. Estas erupciones cutáneas graves pueden estar precedidas por fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrolisis epidérmica tóxica).
- Erupción cutánea generalizada, fiebre alta y ganglios linfáticos inflamados (síndrome DRESS o síndrome de hipersensibilidad a medicamentos).
- Erupción cutánea roja, descamativa y generalizada con nódulos bajo la piel y ampollas, y fiebre simultánea. Los síntomas suelen ocurrir al comienzo del tratamiento (pustulosis exantemática generalizada aguda).
- Trastornos del sistema nervioso: temblores, convulsiones y, a veces, coma. Estos trastornos se han producido en pacientes a quienes se les han administrado dosis demasiado altas, especialmente en pacientes con riñones enfermos.
Efectos adversos frecuentes
Pueden ocurrir en menos de 1 de cada 10pacientes:
- diarrea
- hinchazón y enrojecimiento a lo largo de la vena
- erupción cutánea roja y con picazón
- dolor, ardor, hinchazón o inflamación en el lugar de la inyección.
➢
Si alguno de los síntomas anteriores preocupa al paciente, debe informar a su médico.
Efectos adversos frecuentes que pueden aparecer en los resultados de los análisis de sangre:
- aumento del número de un tipo de glóbulos blancos (eosinofilia)
- aumento del número de plaquetas en la sangre
- aumento de la actividad de las enzimas hepáticas.
Efectos adversos poco frecuentes
Pueden ocurrir en menos de 1 de cada 100pacientes:
- colitis, que puede causar dolor o diarrea, que puede contener sangre
- infecciones por hongos en la boca o la vagina
- dolor de cabeza
- mareos
- dolor abdominal
- náuseas o vómitos
- fiebre y escalofríos.
➢
Debe informar a su médico si experimenta alguno de los síntomas anteriores
de los anteriores.
Efectos adversos poco frecuentes que pueden aparecer en los resultados de los análisis de sangre:
- disminución del número de glóbulos blancos
- disminución del número de plaquetas en la sangre
- aumento de la concentración de urea, nitrógeno ureico o creatinina en suero sanguíneo.
Efectos adversos muy raros
Pueden ocurrir en menos de 1 de cada 10,000pacientes:
- inflamación o insuficiencia renal.
Otros efectos adversos
Otros efectos adversos que se han producido en un pequeño número de pacientes, pero cuya frecuencia exacta es desconocida:
- entumecimiento
- sabor desagradable en la boca
- amarillamiento de la parte blanca de los ojos y la piel.
Otros efectos adversos que pueden aparecer en los resultados de los análisis de sangre:
- destrucción de glóbulos rojos demasiado rápida
- aumento del número de un tipo de glóbulos blancos en la sangre
- disminución significativa del número de glóbulos blancos.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 88
Fax: +34 91 596 24 87
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Biotum
El medicamento debe conservarse a una temperatura de hasta 25°C. Proteger de la luz.
La solución preparada puede conservarse durante 24 horas en el refrigerador, es decir, a una temperatura de 2°C a 8°C.
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe tomar este medicamento después de la fecha de caducidad que figura en el paquete. La fecha de caducidad es el último día del mes indicado.
La inscripción en el paquete después de la abreviatura EXP indica la fecha de caducidad, y después de la abreviatura Lot, el número de lote.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Biotum?
- El principio activo del medicamento es ceftazidima. Cada vial contiene 500 mg de ceftazidima en forma de pentahidratado y bufferizado con carbonato de sodio.
- El otro componente es: carbonato de sodio.
Cómo se presenta Biotum y qué contiene el paquete?
Polvo blanco o amarillento claro en un vial de vidrio, cerrado con un tapón de goma y protegido por una tapa de aluminio o una tapa de aluminio con una cubierta, en una caja de cartón.
El paquete contiene 1 o 10 viales.
No todas las tallas de paquete deben estar en circulación.
Título de la autorización de comercialización y fabricante
Título de la autorización de comercialización
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
tel. + 48 22 364 61 01
Fabricante
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
Zakłady Farmaceutyczne POLPHARMA S.A.
División de producción en Duchnice
ul. Ożarowska 28/30, 05-850 Ożarów Mazowiecki
Fecha de la última revisión de la hoja de instrucciones:
---------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado
Biotum, 500 mg, polvo para preparar solución para inyección
Ceftazidima
La presión en los viales de Biotum de cualquier tamaño es menor que la presión atmosférica. Durante la disolución del polvo, la presión aumenta debido a la liberación de dióxido de carbono. Se pueden ignorar las pequeñas burbujas de dióxido de carbono presentes en la solución preparada.
Instrucciones para la preparación del medicamento para su administración
Debe consultar la tabla de volúmenes añadidos y concentraciones obtenidas, lo que puede ser útil cuando se necesitan dosis parciales.
| Contenido del vial | Vía de administración | Volúmen de disolvente para añadir [ml] | Concentración aproximada de ceftazidima [mg/ml] |
| 500 mg | inyección intramuscular | 1,5 ml | 260 |
| inyección intravenosa | 5 ml | 90 |
El color de la solución puede variar desde amarillento claro hasta ámbar, dependiendo de la concentración, el tipo de disolvente y las condiciones de almacenamiento. Si se cumplen las condiciones recomendadas, la variabilidad del color de la solución no afecta desfavorablemente a la eficacia del medicamento.
Para preparar soluciones para infusión intravenosa con una concentración de ceftazidima entre 1 mg/ml y 40 mg/ml, se utilizan:
- solución al 9 mg/ml (0,9%) de cloruro de sodio para inyección
- solución de lactato de sodio al 1/6 para inyección
- solución de lactato de sodio multicomponente para inyección (solución de Hartmann)
- solución al 5% de glucosa para inyección
- solución al 0,225% de cloruro de sodio con solución al 5% de glucosa para inyección
- solución al 0,45% de cloruro de sodio con solución al 5% de glucosa para inyección
- solución al 0,9% de cloruro de sodio con solución al 5% de glucosa para inyección
- solución al 0,18% de cloruro de sodio con solución al 4% de glucosa para inyección
- solución al 10% de glucosa para inyección
- solución al 10% de dextrán 40 en solución al 0,9% de cloruro de sodio para inyección
- solución al 10% de dextrán 40 en solución al 5% de glucosa para inyección
- solución al 6% de dextrán 70 en solución al 0,9% de cloruro de sodio
- solución al 6% de dextrán 70 en solución al 5% de glucosa para inyección.
La ceftazidima a concentraciones entre 0,05 mg/ml y 0,25 mg/ml es compatible con el líquido de diálisis peritoneal (con lactato).
La ceftazidima para inyección intramuscular se puede disolver en una solución que contenga clorhidrato de lidocaína al 0,5% o al 1% para inyección.
La solución de 500 mg de ceftazidima en 1,5 ml de agua para inyección se puede agregar a una solución de metronidazol (500 mg en 100 ml) y ambos productos mantienen su actividad.
Preparación de la solución para inyección rápida
- 1. Perforar el tapón con la aguja y inyectar en el vial el volumen recomendado de disolvente. Para perforar el tapón, debe utilizar una aguja con un diámetro no superior a 0,8 mm (21 G en la escala Gauge [G]). La aguja debe insertarse en el centro del tapón a un ángulo de 90°, de acuerdo con el siguiente esquema:
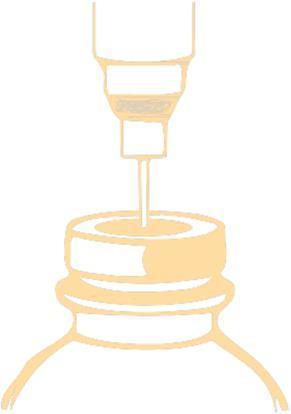
La presión negativa dentro del vial puede facilitar la entrada del disolvente. Retirar la aguja de la jeringuilla.
- 2. Agitar hasta que se disuelva: se libera dióxido de carbono y, en 1 a 2 minutos, se obtiene una solución clara.
- 3. Invertir el vial. Manteniendo el émbolo de la jeringuilla en posición completamente presionada, perforar el tapón del vial con la aguja y aspirar todo el volumen de la solución a la jeringuilla (la presión aumentada en el vial facilitará esta operación). La aguja debe mantenerse dentro de la solución para evitar aspirar aire. La solución aspirada a la jeringuilla puede contener pequeñas burbujas de dióxido de carbono. Estas soluciones se pueden administrar directamente en una vena o en un conjunto para infusión intravenosa, si el paciente está recibiendo líquidos intravenosos. La ceftazidima es compatible con la mayoría de los líquidos intravenosos más comúnmente utilizados.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorZakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w Duchnicach
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a BiotumForma farmacéutica: Polvo, 1 gPrincipio activo: CeftazidimaFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachNo requiere recetaForma farmacéutica: Polvo, 2 gPrincipio activo: CeftazidimaFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachNo requiere recetaForma farmacéutica: Polvo, 1 gPrincipio activo: CeftazidimaNo requiere receta
Alternativas a Biotum en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Biotum en España
Alternativa a Biotum en Ucrania
Médicos online para Biotum
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Biotum – sujeta a valoración médica y normativa local.














