

Aprokam

Consulta con un médico sobre la receta médica de Aprokam

Cómo usar Aprokam
Hoja de instrucciones del paquete: información para el paciente
APROKAM, 50 mg, polvo para preparar solución para inyección
Cefuroxima
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, consultar al médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para esta persona. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar al médico, farmacéutico o enfermera. Ver sección 4.
Índice de la hoja de instrucciones:
- 1. Qué es APROKAM y para qué se utiliza
- 2. Información importante antes de usar APROKAM
- 3. Cómo usar APROKAM
- 4. Posibles efectos adversos
- 5. Cómo conservar APROKAM
- 6. Contenido del paquete y otra información
1. Qué es APROKAM y para qué se utiliza
- APROKAM contiene el principio activo cefuroxima (en forma de cefuroxima sódica), que pertenece a un grupo de antibióticos llamados cefalosporinas. Los antibióticos se utilizan para matar bacterias o "microorganismos patógenos" que causan infecciones.
- Este medicamento se utilizará cuando el paciente se someta a una operación de cataratas (opacidad del cristalino).
- El cirujano oftálmico administrará este medicamento en forma de inyección en el ojo al final de la operación quirúrgica (cirugía) de cataratas para prevenir la infección del ojo.
2. Información importante antes de usar APROKAM
Cuándo no usar APROKAM
- Si el paciente es alérgico a la cefuroxima o a cualquier otro antibiótico del grupo de las cefalosporinas.
Advertencias y precauciones
Antes de usar APROKAM, debe informar al médico, farmacéutico o enfermera:
- si el paciente es alérgico a otros antibióticos, como la penicilina,
- si el paciente tiene riesgo de infección causada por bacterias llamadas Staphylococcus aureus resistentes a la meticilina,
- si el paciente tiene riesgo de infección grave,
- si el paciente tiene cataratas complicadas,
- si se planea una operación quirúrgica combinada del ojo,
- si el paciente tiene enfermedad tiroidea grave.
APROKAM se administra exclusivamente en forma de inyección en el ojo (inyección en la cámara anterior del globo ocular).
APROKAM debe administrarse en condiciones asépticas (entorno limpio y libre de microorganismos) durante la operación de extracción de cataratas.
Cada vial de APROKAM está destinado exclusivamente a un paciente.
APROKAM y otros medicamentos
Debe informar al médico o farmacéutico sobre todos los medicamentos que el paciente esté tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
Embarazo y lactancia
- si la paciente está embarazada o en período de lactancia, o si sospecha que puede estar embarazada o planea tener un hijo, debe consultar al médico o farmacéutico antes de usar este medicamento.
- APROKAM se administrará a la paciente solo si los beneficios superan el riesgo potencial.
APROKAM contiene sodio
El medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, lo que significa que el medicamento se considera "exento de sodio".
3. Cómo usar APROKAM
- Las inyecciones de APROKAM serán administradas por el cirujano oftálmico al final de la operación quirúrgica (cirugía) de cataratas.
- APROKAM se suministra en forma de polvo estéril (ásptico) y antes de la administración se disuelve en solución de cloruro de sodio para inyección.
Uso de una dosis mayor o menor que la recomendada de APROKAM
El medicamento generalmente será administrado por personal médico.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar al médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, APROKAM puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
El siguiente efecto adverso es muy raro (puede afectar hasta 1 de cada 10,000 personas):
- Reacción alérgica grave que causa dificultad para respirar o mareo.
El siguiente efecto adverso se informa con una frecuencia "desconocida" (la frecuencia no puede determinarse con los datos disponibles):
- Edema de la mácula (visión borrosa o ondulada en el centro del campo visual o cerca de él).
Informes de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar al médico, farmacéutico o enfermera. Los efectos adversos pueden informarse directamente al Departamento de Vigilancia de Reacciones Adversas de Medicamentos del Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas, Al. Jerozolimskie 181C, 02-222 Varsovia,
tel.: +48 22 49 21 301, fax: +48 22 49 21 309.
correo electrónico: [email protected]
Los efectos adversos también pueden informarse al titular de la autorización de comercialización.
Al informar los efectos adversos, se pueden recopilar más datos sobre la seguridad del medicamento.
5. Cómo conservar APROKAM
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No usar APROKAM después de la fecha de caducidad que figura en el paquete y la etiqueta del vial después de EXP. La fecha de caducidad es el último día del mes indicado.
Conservar a una temperatura inferior a 25°C. Conservar el vial en el paquete exterior para protegerlo de la luz.
Únicamente para uso único.
Después de la preparación de la solución: el producto debe usarse de inmediato.
No desechar los medicamentos por el desagüe o los contenedores de basura domésticos. Debe preguntar al farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene APROKAM?
El principio activo del medicamento es cefuroxima (en forma de cefuroxima sódica).
Un vial contiene 50 mg de cefuroxima.
Después de la preparación de la solución, 0,1 ml de solución contiene 1 mg de cefuroxima.
El medicamento no contiene otros componentes.
Cómo se presenta APROKAM y qué contiene el paquete?
APROKAM es un polvo blanco o casi blanco para preparar solución para inyección, suministrado en vias de vidrio.
Un paquete contiene diez o veinte vias o diez vias con diez agujas estériles con filtro de 5 micrómetros. No todas las tallas de paquete deben estar en circulación.
Título de la autorización de comercialización y fabricante
Título de la autorización de comercialización:
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
Francia
Fabricante:
BIOPHARMA S.R.L.
Via Delle Gerbere, 22/30 (loc. S. PALOMBA)
00134 ROMA (RM)
Italia
LABORATOIRES THEA
12 rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
Francia
Este medicamento está autorizado para su comercialización en los países miembros del Espacio Económico Europeo bajo los siguientes nombres:
Nombres del medicamento en otros países:
Austria, Bélgica, República Checa, Dinamarca, Finlandia, Francia, Alemania, Italia, Islandia, Luxemburgo, Países Bajos, Noruega, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, Suecia, Reino Unido................................................................................................................................APROKAM
Chipre, Grecia, España..........................................................................................................PROKAM
Irlanda………............................................................................................................................APROK
Fecha de la última actualización de la hoja de instrucciones: 07-08-2019
Para obtener más información, debe consultar al representante del titular de la autorización de comercialización:
Thea Polska Sp. z o.o.
ul. Cicha 7
00-353 Varsovia
www.thea.pl
Información destinada exclusivamente al personal médico especializado:
Incompatibilidades farmacéuticas
No se han descrito incompatibilidades con los productos más comúnmente utilizados durante la operación de cataratas. No mezclar este medicamento con otros medicamentos, excepto los mencionados a continuación [cloruro de sodio al 9 mg/ml (0,9%) solución para inyección].
Cómo preparar y administrar APROKAM
El vial de un solo uso es exclusivamente para administración en la cámara anterior del globo ocular.
APROKAM debe administrarse después de la preparación de la solución, en forma de inyección en la cámara anterior del globo ocular, por el cirujano oftálmico, en condiciones asépticas recomendadas durante la operación de extracción de cataratas.
La solución preparada debe inspeccionarse visualmente y solo debe usarse si es incolora o amarillenta y no contiene partículas visibles.
El producto debe usarse de inmediato después de la preparación de la solución y no debe reutilizarse.
La dosis recomendada de cefuroxima es de 1 mg en 0,1 ml de cloruro de sodio (solución para inyección) al 9 mg/ml (0,9%).
NO ADMINISTRAR UNA DOSIS MAYOR QUE LA RECOMENDADA.
Los viales son de un solo uso
Cada vial está destinado exclusivamente a un paciente. Debe pegar la etiqueta del vial en la documentación del paciente.
Para preparar APROKAM para la administración en la cámara anterior del globo ocular, debe seguir las siguientes instrucciones: 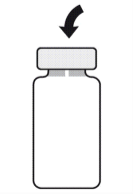 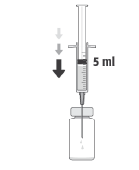 | |
Necesita desinfectar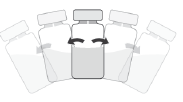 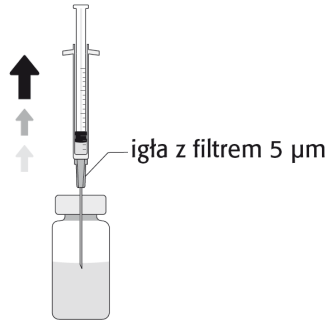 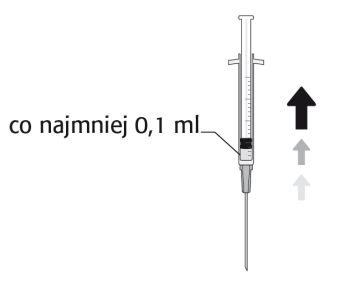 |
|
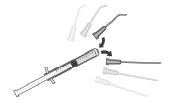 |
|
Después del uso, debe desechar el resto de la solución preparada. No debe conservar el resto de la solución preparada para reutilizarla.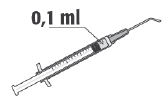 | |
Debe eliminar cualquier residuo del medicamento o sus desechos de acuerdo con las regulaciones locales. Las agujas usadas deben colocarse en un contenedor para desechos médicos punzocortantes.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBiopharma S.r.L. Laboratoires Thea
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a AprokamForma farmacéutica: Polvo, 1.5 gPrincipio activo: CefuroximaFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequiere recetaForma farmacéutica: Polvo, 250 mgPrincipio activo: CefuroximaFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequiere recetaForma farmacéutica: Polvo, 500 mgPrincipio activo: CefuroximaFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachRequiere receta
Alternativas a Aprokam en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Aprokam en España
Alternativa a Aprokam en Ucrania
Médicos online para Aprokam
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Aprokam – sujeta a valoración médica y normativa local.














