
MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL

Como usar MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Menveo pó e solução para solução injetável
Vacina conjugada contra o meningococo dos serogrupos A, C, W-135 e Y
Leia todo o prospecto atentamente antes de si ou seu filho receberem este medicamento,porque contém informações importantes para si
- Conserva este prospecto, pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Esta vacina foi prescrita apenas para si ou para seu filho.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Menveo e para que é utilizado
- O que precisa saber antes de si ou seu filho receberem Menveo
- Como usar Menveo
- Posíveis efeitos adversos
- Conservação de Menveo
- Conteúdo do envase e informações adicionais
1. O que é Menveo e para que é utilizado
Menveo é uma vacina que é utilizada para a imunização ativa de crianças (a partir dos 2 anos de idade), adolescentes e adultos que se encontrem em risco de exposição a uma bactéria chamada Neisseria meningitidisdos serogrupos A, C, W-135 e Y, com o objetivo de prevenir doenças invasivas.A vacina funciona de tal forma que faz com que o seu organismo gere a sua própria proteção (anticorpos) contra estas bactérias.
As bactérias dos serogrupos grupo A, C, W-135 e Y de Neisseria meningitidispodem causar infecções graves que, mesmo, podem colocar em risco a vida do paciente, como a meningite ou a septicemia (envenenamento do sangue).
Menveo não pode causar meningite bacteriana. Esta vacina contém uma proteína (chamada CRM197) da bactéria que causa a difteria. Menveo não protege contra a difteria. Portanto, si (ou seu filho) deverá receber outras vacinas que o protejam da difteria quando chegar a hora ou se o seu médico o aconselhar.
2. O que precisa saber antes de si ou seu filho receberem Menveo
Não devem administrar-lhe a si ou a seu filho Menveo se:
- Já tiveram alguma vez uma reação alérgica aos princípios ativos ou a qualquer um dos outros componentes desta vacina (incluídos na secção 6)
- Já tiveram alguma vez uma reação alérgica ao toxoide diftérico (uma substância utilizada em várias vacinas)
- Padece uma doença com febre alta. No entanto, uma infecção com febre leve ou das vias respiratórias superiores (por exemplo, um resfriado) não constitui por si só um motivo para adiar a vacinação.
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de si ou seu filho receberem Menveo se si (ou seu filho):
- Têm um sistema imunológico debilitado. Existe pouca informação sobre a eficácia de Menveo em pessoas cujo sistema imunológico está debilitado devido ao uso de medicamentos imunossupressores, à infecção por VIH ou a outras causas possíveis. Existe a possibilidade de que a eficácia de Menveo pudesse ser reduzida nestas pessoas.
- Têm hemofilia ou qualquer outra alteração que impida à sua sangue coagular-se de forma correcta. É o caso das pessoas que estão sob tratamento com anticoagulantes.
- Recebe tratamento que bloqueia a parte do sistema imunológico conhecida como activação do complemento, como eculizumab. Mesmo que si tenha sido vacinado com Menveo, continua a ter um maior risco de doença invasiva causada pela bactéria Neisseria meningitidis grupos A, C, W-135 e Y.
Pode produzir-se desfalecimento, sensação de perda de consciência ou outras reacções associadas ao stresse como resposta a qualquer injeção com agulha. Informe o seu médico ou enfermeiro se já teve uma reação deste tipo no passado.
Esta vacina só tem a capacidade de proteger contra as bactérias meningocócicas dos serogrupos A, C, W-135 e Y. Não protege contra outro tipo de bactérias meningocócicas que não sejam dos serogrupos A, C, W-135 e Y, ou contra outras causas de meningite ou septicemia (envenenamento do sangue).
Como sucede com qualquer vacina, é possível que Menveo não proteja 100% de todas as pessoas vacinadas.
Se si ou seu filho receberam uma dose de Menveo há mais de um ano e continuam em risco particular de exposição às bactérias meningocócicas dos serogrupos A, pode ser considerada a administração de uma dose de reforço para manter a proteção. O seu médico aconselhar-lhe-á se deve receber uma dose de reforço e quando o fazer.
Uso de Menveo com outros medicamentos
Informe o seu médico ou enfermeiro se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
É possível administrar Menveo ao mesmo tempo que outras vacinas, mas é preferível que a injeção de outras vacinas seja realizada no braço contrário ao que foi utilizado para a injeção de Menveo.
Entre estas vacinas incluem-se: tétano, difteria de carga reduzida e tos ferina acelular (Tdpa), vírus do papiloma humano (VPH), febre amarela, febre tifoide (polissacárido Vi), encefalite japonesa, raiva, hepatite A e B e meningococo do grupo B (Bexsero).
Pode existir uma redução no efeito de Menveo no caso de ser administrado em pessoas que estejam a tomar medicamentos que inibem o sistema imunológico.
É necessário realizar a injeção em locais diferentes no caso de ser administrada mais de uma vacina ao mesmo tempo.
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de receber este medicamento. É possível que o seu médico ou enfermeiro continue a recomendar a administração de Menveo se se encontrar em risco elevado de infecção por bactérias meningocócicas dos serogrupos A, C, W-135 e Y.
Condução e uso de máquinas
Não foi realizado qualquer estudo relativo aos efeitos sobre a capacidade para conduzir e utilizar máquinas. Foram descritos poucos casos de tonturas após a vacinação. Isso poderia afectar de forma temporária a capacidade para conduzir ou utilizar máquinas.
Menveo contém
Este medicamento contém menos de 23 mg (1 mmol) de sódio por dose; isto é, é essencialmente «isento de sódio».
Este medicamento contém menos de 39 mg (1 mmol) de potássio por dose; por lo que se considera essencialmente «isento de potássio».
3. Como usar Menveo
O seu médico ou enfermeiro administrar-lhe-á a si ou a seu filho Menveo.
Geralmente, a vacina é injetada no músculo da parte superior do braço (deltoides) em crianças (a partir dos 2 anos de idade), adolescentes e adultos. O seu médico ou enfermeiro procurarão garantir que a vacina não seja administrada em um vaso sanguíneo e que seja injetada no músculo e não na pele.
Será administrada uma única injeção (0,5 ml) da vacina em crianças (a partir dos 2 anos de idade), adolescentes e em adultos.
Não foi estabelecida ainda a segurança e eficácia de Menveo em crianças menores de 2 anos de idade. Os dados disponíveis para os sujeitos com idade entre 56-65 são limitados e não existem no caso de pessoas com mais de 65 anos.
Informe o seu médico se já lhe foi administrada anteriormente uma injeção de Menveo ou de outra vacina contra o meningococo. O médico indicar-lhe-á se precisa de outra injeção de Menveo.
Para mais informações sobre a reconstituição da vacina, dirija-se à secção dedicada aos profissionais de saúde ou médicos situada na parte final deste prospecto.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Em geral, os efeitos secundários mais frequentes que foram descritos durante os ensaios clínicos duraram apenas um a dois dias e não foram normalmente graves.
Em crianças (de 2 a 10 anos de idade), os efeitos adversos notificados durante os ensaios clínicos são descritos a seguir.
Muito frequentes (podem afectar mais de 1 pessoa em cada 10): sonolência, dor de cabeça, irritabilidade, sensação de mal-estar geral, dor no local da injeção, vermelhidão no local da injeção (≤ 50 mm), induração no local da injeção (≤ 50 mm)
Frequentes (podem afectar até 1 pessoa em cada 10): alterações nos hábitos alimentares, náuseas, vómitos, diarreia, erupção cutânea, dor muscular, dor articular, arrepios, febre ≥ 38°C, vermelhidão no local da injeção (> 50mm) e induração no local da injeção (> 50mm)
Pouco frequentes (podem afectar até 1 pessoa em cada 100): picazón no local da injeção
Em adolescentes (a partir de 11 anos de idade) e adultos, os efeitos adversos mais frequentes notificados durante os ensaios clínicos são descritos a seguir.
Muito frequentes: dor de cabeça, náuseas, dor no local da injeção, vermelhidão no local da injeção (≤ 50 mm), induração no local da injeção (≤ 50 mm), dor muscular, sensação de mal-estar geral
Frequentes: erupção cutânea, vermelhidão no local da injeção (> 50 mm), induração no local da injeção (> 50 mm), dor articular, febre ≥ 38°C, arrepios
Pouco frequentes: tonturas, picazón na zona da injeção
Os efeitos adversos comunicados durante o uso comercial incluem:
Raros: gânglios linfáticos aumentados.
Frequência não conhecida: reacções alérgicas, que podem incluir inchaço grave dos lábios, da boca e da garganta (que pode provocar dificuldade para engolir), dificuldade para respirar com sibilância (ruídos ao respirar) ou tosse, erupção e inchaço das mãos, dos pés e dos tornozelos, perda de consciência, pressão arterial muito baixa; ataques (convulsões), incluídos os associados à febre; alteração do equilíbrio; desmaio; infecção da pele na zona da injeção; inchaço na zona da injeção, incluindo o inchaço extenso do membro injetado.
Em caso de produzir-se uma reação alérgica grave, avise rapidamente o seu médico ou acuda de imediato/leve o seu filho ao serviço de urgências mais próximo, pois podem precisar de assistência médica urgente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Anexo V. Mediante a comunicação de efeitos adversos, si pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Menveo
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase após CAD. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2ºC e 8ºC). Não congelar. Conservar os frascos no embalagem original para protegê-los da luz.
Após a reconstituição, o produto deve ser utilizado de forma imediata. No entanto, demonstrou-se a estabilidade química e física após a reconstituição durante 8 horas por debaixo de 25º C.
Os medicamentos não devem ser deitados fora por os esgotos nem para o lixo. O seu médico ou enfermeiro se encarregará de se desfazer deste medicamento. Deste modo, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Menveo
Uma dose (0,5 ml de vacina reconstituída) contém:
Os princípios ativos são:
(Conteúdo original do pó)
- Oligossacarídeo meningocócico do grupo A 10 microgramas
Conjugado com proteína CRM197 de Corynebacterium diphtheriae16,7 a 33,3 microgramas
(Conteúdo original da solução injetável)
- Oligossacarídeo meningocócico do grupo C 5 microgramas
Conjugado com proteína CRM197 de Corynebacterium diphtheriae7,1 a 12,5 microgramas
- Oligossacarídeo meningocócico do grupo W-135 5 microgramas
Conjugado com proteína CRM197 de Corynebacterium diphtheriae3,3 a 8,3 microgramas
- Oligossacarídeo meningocócico do grupo Y 5 microgramas
Conjugado com proteína CRM197 de Corynebacterium diphtheriae5,6 a 10,0 microgramas
Os demais componentes (excipientes) são:
No pó: fosfato de potássio dihidrogenado e sacarose.
Na solução injetável: cloreto de sódio, fosfato de sódio dihidrogenado monohidratado, fosfato de sódio hidrogenado dihidratado e água para preparações injetáveis (ver também o final da Seção 2).
Aspecto do produto e conteúdo do envase
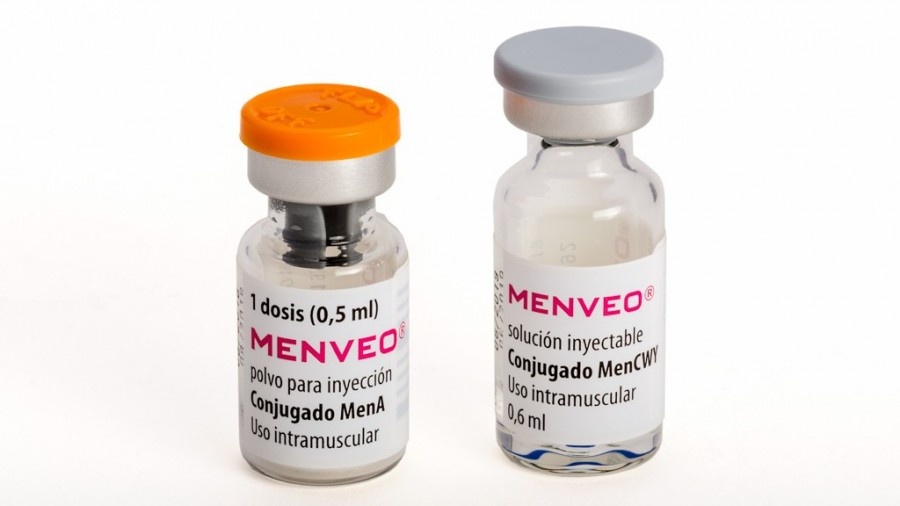
Menveo é composto por um pó e uma solução injetável.
Cada dose de Menveo é fornecida com:
- 1 frasco que contém componente de conjugado liofilizado MenA na forma de pó de cor branca a esbranquiçada.
- 1 frasco que contém componente de conjugado líquido MenCWY na forma de solução transparente.
- Tamanho do envase de uma dose (2 frascos), cinco doses (10 frascos) ou dez doses (20 frascos). Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Devem ser misturados ambos os conteúdos (do frasco e do outro frasco) antes da vacinação mediante1dose de0,5ml.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização:
GSK Vaccines S.r.l. –
Via Fiorentina 1, 53100 – Siena,
Itália.
Responsável pela fabricação:
GSK Vaccines S.r.l.
Bellaria Rosia, 53018 Sovicille (Siena),
Itália.
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 | Lituânia GSK Vaccines S.r.l Tel: +370 80000334 |
Bulgária GSK Vaccines S.r.l Tel: +359 80018205 | Luxemburgo GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 |
República Tcheca GlaxoSmithKline s.r.o. Tel: + 420 2 22 00 11 11 | Hungria GSK Vaccines S.r.l Tel.: +36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 | Malta GSK Vaccines S.r.l Tel: +356 80065004 |
Alemanha GlaxoSmithKline GmbH & Co. KG Tel: +49 (0)89 36044 8701 | Países Baixos GlaxoSmithKline BV Tel: + 31 (0)33 2081100 |
Estônia GSK Vaccines S.r.l Tel: +372 8002640 | Noruega GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Μονοπρ?σωπη A.E.B.E Tηλ: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH. Tel: + 43 (0)1 97075 0 |
Espanha GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polônia GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
França Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 | Portugal GlaxoSmithKline - Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 |
Croácia GSK Vaccines S.r.l Tel.: +385 800787089 | Romênia GSK Vaccines S.r.l Tel: +40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Ltd Tel: + 353 (0)1 495 5000 | Eslovênia GSK Vaccines S.r.l Tel: +386 80688869 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca GSK Vaccines S.r.l Tel: +421 800500589 |
Itália GlaxoSmithKline S.p.A. Tel: +39 (0)45 7741 111 | Finlândia GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 |
Chipre GSK Vaccines S.r.l Τηλ: +357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia GSK Vaccines S.r.l Tel: +371 80205045 | Reino Unido(Irlanda do Norte) GSK Vaccines S.r.l Tel: + 44 (0)800 221 441 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu
No site da Agência Europeia de Medicamentos, pode ser encontrado este prospecto em todas as línguas da União Europeia/Espaço Econômico Europeu.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Esta informação é destinada apenas a profissionais do setor sanitário:
Reconstituição da vacina
Menveo deve ser preparado para a administração mediante a reconstituição do pó com a solução.
O conteúdo dos dois diferentes frascos (MenA pó e MenCWY solução) deve ser misturado antes da vacinação, com o que se obtém 1 dose de 0,5 ml.
Retirar todo o conteúdo do frasco com a solução usando uma seringa e uma agulha adequada (21G, 40 mm de comprimento ou 21 G, 1 ½ polegadas de comprimento) e injetá-lo no frasco com o pó para reconstituir o componente de conjugado MenA.
Inverter e agitar o frasco energicamente e, em seguida, retirar 0,5 ml do produto reconstituído.
É necessário ter em conta que é normal que uma pequena quantidade de líquido permaneça no frasco após a retirada da dose. Antes da injeção, trocar a agulha por uma que seja adequada para a administração. É necessário garantir que não há bolhas de ar na seringa antes de injetar a vacina.
Após a reconstituição, a vacina é uma solução transparente, incolor ou ligeiramente amarelada, sem partículas estranhas visíveis. Em caso de se observar alguma partícula estranha ou uma variação do aspecto físico, deve-se descartar a vacina.
Menveo é administrado como injeção intramuscular, preferencialmente no músculo deltóide.
Toda vacina ou material de descarte não utilizado deve ser eliminado de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 0,5 mlFabricante: Sanofi Winthrop IndustrieRequer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mlFabricante: Sanofi Winthrop IndustrieRequer receita médicaForma farmacêutica: INJETÁVEL, 10 microgramas de polissacarídeo do grupo A da Neisseria Meningitidis/dose - REVISAR µgFabricante: Sanofi Winthrop IndustrieRequer receita médica
Alternativas a MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de MENVEO PÓ E SOLUÇÃO PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.














