INTRAROSA 6,5 mg ÓVULOS VAGINAIS

Pergunte a um médico sobre a prescrição de INTRAROSA 6,5 mg ÓVULOS VAGINAIS

Como usar INTRAROSA 6,5 mg ÓVULOS VAGINAIS
Introdução
Prospecto: informação para o utilizador
Intrarosa 6,5 mg óvulos
prasterona
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Intrarosa e para que é utilizado
- O que necessita de saber antes de começar a usar Intrarosa
- Como usar Intrarosa
- Efeitos adversos possíveis
- Conservação de Intrarosa
- Conteúdo do envase e informação adicional
1. O que é Intrarosa e para que é utilizado
Intrarosa contém o princípio ativo prasterona.
Para que é utilizado Intrarosa
Intrarosa é utilizado para tratar mulheres pós-menopáusicas com atrofia vulvar e vaginal com sintomas de moderados a graves. É utilizado para o alívio dos sintomas menopáusicos que afetam a vagina, como secura ou irritação. A causa é uma diminuição dos níveis de estrógenos no organismo. Isso ocorre de forma natural após a menopausa.
Como actua Intrarosa
A prasterona corrige os sintomas e sinais da atrofia vulvar e vaginal ao substituir os estrógenos que os ovários das mulheres produzem normalmente antes da menopausa. É introduzido dentro da vagina, de maneira que o hormônio é libertado no local onde é necessário. Isso pode aliviar as molestias vaginais.
2. O que necessita de saber antes de começar a usar Intrarosa
O uso de terapia hormonal substitutiva (THS) acarreta riscos que devem ser tidos em conta antes de decidir se se começa a usar ou se continua a utilizar essa terapia.
A experiência no tratamento de mulheres com menopausa prematura (devido a falha ovárica ou cirurgia) é limitada. Se tiver menopausa prematura, os riscos do uso de THS podem ser diferentes. Consulte o seu médico.
Antes de começar (ou de reiniciar) a THS, o médico irá perguntar sobre os seus antecedentes médicos e os da sua família. O médico pode decidir que é necessário fazer-lhe um exame físico, que pode consistir num exame das mamas e/ou num exame interno, se necessário.
Uma vez que tenha começado a tomar Intrarosa, deve ir ao médico para revisões periódicas (pelo menos de 6 em 6 meses). Nessas revisões, pode comentar com o médico os benefícios e riscos de continuar com Intrarosa.
Vá periodicamente para realizar exames mamários, segundo as recomendações do seu médico.
Não use Intrarosa:
se cumprir alguma das condições seguintes. Se não tiver certeza sobre algum dos pontos seguintes, consulte o seu médico antes de usar Intrarosa,
- Se tiver ou tiver tido câncer de mama, ou suspeita que possa tê-lo;
- Se tiver ou tiver tido câncer sensível aos estrógenos, como câncer do revestimento do útero (endométrio), ou suspeita que possa tê-lo;
- Se sofrer qualquer sangramento vaginal de origem desconhecida;
- Se tiver um engrossamento excessivo do revestimento do útero(hiperplasia endometrial) que não está sendo tratado;
- Se tiver ou tiver tido um coágulo sanguíneo em uma veia (trombose), seja nas pernas (trombose venosa profunda) ou nos pulmões (embolia pulmonar);
- Se padeça de algum distúrbio da coagulação (como deficiência de proteína C, proteína S ou antitrombina);
- Se tiver ou tiver tido recentemente uma doença provocada por coágulos sanguíneos nas artérias, como um infarto do miocárdio, um acidente vascular cerebral ou uma angina de peito.
- Se tiver ou tiver tido uma doença do fígadoe os análises da função hepática ainda não se normalizaram;
- Se tiver um raro distúrbio sanguíneo de transmissão hereditária denominado «porfiria»;
- Se for alérgicaà prasteronaou a qualquer um dos outros ingredientes deste medicamento (indicados na secção 6 «Conteúdo do envase e informação adicional»).
Se algum desses distúrbios aparecer pela primeira vez enquanto está usando Intrarosa, suspenda o tratamento e consulte o seu médico imediatamente.
Advertências e precauções
Quando ter especial cuidado com Intrarosa
Informa ao seu médico se alguma vez teve algum dos seguintes problemas, antes de iniciar o tratamento, pois podem reaparecer ou piorar durante o tratamento com Intrarosa. Se for o caso, deve ir ao médico com mais frequência para revisões:
- fibromas no útero;
- crescimento do revestimento uterino fora do útero (endometriose) ou antecedentes de engrossamento excessivo do revestimento uterino (hiperplasia endometrial);
- antecedentes de formação de coágulos sanguíneos (ver «Coágulos sanguíneos em uma veia (trombose)»);
- aumento do risco de sofrer um câncer sensível aos estrógenos (como ter tido uma mãe, irmã ou avó que tenham sofrido um câncer de mama);
- pressão arterial alta;
- distúrbios do fígado, como um tumor hepático benigno;
- diabetes;
- cálculos na vesícula biliar;
- enxaqueca ou dores de cabeça (fortes);
- uma doença do sistema imunológico que afeta muitos órgãos do corpo (lúpus eritematoso sistémico, LES);
- epilepsia;
- asma;
- uma doença que afeta a membrana do tímpano e a audição (otosclerose);
- um nível muito alto de gordura no sangue (triglicéridos);
- retenção de líquidos devido a problemas de coração ou de rim.
Deixe de tomar Intrarosa e vá ao médico imediatamente
Se observar algum dos seguintes sintomas ao utilizar a THS:
- qualquer um dos distúrbios mencionados na secção «Não utilize Intrarosa»;
- coloração amarelada da pele ou do branco dos olhos (icterícia). Pode ser um sintoma de uma doença do fígado;
- se ficar grávida;
- um grande aumento da pressão arterial (com sintomas como dor de cabeça, cansaço, tontura);
- dor de cabeça tipo enxaqueca, que pode aparecer pela primeira vez;
- se notar sintomas de um coágulo sanguíneo, como:
- inchaço com dor e vermelhidão das pernas;
- dor súbita no peito;
- dificuldade para respirar.
Para mais informações, ver «Coágulos sanguíneos em uma veia (trombose)».
Nota:Intrarosa não é um anticoncepcional. Se passaram menos de 12 meses desde a última menstruação ou se tiver menos de 50 anos, é possível que tenha que continuar a utilizar métodos anticoncepcionais para não ficar grávida. Peça conselho ao seu médico.
THS e câncer
Intrarosa não foi estudado em mulheres com diagnóstico atual ou antecedentes de câncer.
Engrossamento excessivo do revestimento do útero (hiperplasia endometrial) e câncer do revestimento do útero (câncer de endométrio)
A administração prolongada de THS apenas com estrógenos em comprimidos pode aumentar o risco de desenvolver câncer do revestimento do útero (endométrio). Intrarosa não estimula o crescimento do endométrio, como demonstra a atrofia do revestimento do útero em todas as mulheres tratadas com Intrarosa durante um ano nos ensaios clínicos.
Não está claro se existe algum risco quando Intrarosa é utilizado para tratamentos a longo prazo (mais de um ano). No entanto, demonstrou-se que a absorção de Intrarosa no sangue é muito pequena, por isso não é necessário adicionar um progestágeno.
Se apresentar sangramento ou manchado vaginal, normalmente não é preocupante, mas deve marcar uma visita com o seu médico. Pode ser um sinal de que o endométrio se engrossou.
Os riscos seguintes relacionam-se com os medicamentos de THS que circulam no sangue. Agora bem, Intrarosa é utilizado para o tratamento local da vagina e a absorção no sangue é muito pequena. É menos provável que os distúrbios mencionados a seguir piorem ou reapareçam durante o tratamento com Intrarosa, mas deve ir ao médico se estiver preocupada.
Câncer de mama
Os dados disponíveis indicam que a THS que combina estrógenos-progestágenos, e possivelmente também a THS com apenas estrógenos, aumenta o risco de câncer de mama. O risco adicional depende do tempo que dura a THS. O aumento do risco torna-se patente após alguns anos de THS. No entanto, retorna à normalidade a poucos anos (como máximo 5) de ter suspendido o tratamento.
- Examine as suas mamas regularmente. Vá ao médico se notar qualquer alteração, como:
- rugosidade na pele;
- alterações nos mamilos;
- qualquer nódulo que possa ver ou notar.
Além disso, recomendamos que siga programas de detecção precoce com mamografias quando lhe forem oferecidos.
Câncer de ovário
O câncer de ovário é raro, muito mais raro que o câncer de mama. O uso de THS com apenas estrógenos associou-se a um ligeiro aumento do risco de câncer de ovário.
O risco de câncer de ovário varia com a idade. Por exemplo, em mulheres de 50 a 54 anos que não recebem THS, diagnosticar-se-ão cerca de 2 casos de câncer de ovário por cada 2000 mulheres num período de 5 anos. Em mulheres que receberam THS durante 5 anos, produzir-se-ão cerca de 3 casos por cada 2000 usuárias de THS (ou seja, cerca de 1 caso adicional).
Comunicaram-se casos raros de câncer de ovário e de mama em mulheres tratadas com 6,5 mg de prasterona durante 52 semanas.
Efeito da THS sobre o coração e a circulação
Intrarosa não foi estudado em mulheres com antecedentes de doenças tromboembólicas, hipertensão não controlada ou doenças do coração.
Coágulos sanguíneos em uma veia (trombose)
O risco de coágulos sanguíneos nas veias é aproximadamente 1,3 a 3 vezes superior nas usuárias de THS em relação às não usuárias, especialmente no primeiro ano de tratamento.
Os coágulos sanguíneos podem ser graves e, se um deles chegar aos pulmões, pode provocar dor no peito, dificuldade para respirar, síncope ou até a morte.
A probabilidade de sofrer coágulos sanguíneos será maior com o aumento da idade e se intervir um dos seguintes fatores. Se alguma dessas situações puder aplicar-se a si, informe o seu médico:
- não pode caminhar durante muito tempo devido a uma intervenção cirúrgica maior, lesão ou doença (ver também a secção 3, Se necessita de se submeter a uma intervenção cirúrgica);
- tem um sobrepeso importante (IMC > 30 kg/m2);
- sofre um problema de coagulação sanguínea que necessita de um tratamento prolongado com medicação para prevenir os coágulos;
- algum familiar próximo teve um coágulo sanguíneo nas pernas, pulmões ou outros órgãos;
- padece lúpus eritematoso sistémico (LES);
- tem câncer.
Para ver os sintomas que provocam um coágulo sanguíneo, consulte a secção «Deixe de tomar Intrarosa e vá ao médico imediatamente».
Nos ensaios clínicos, não se observou trombose venosa profunda com prasterona intravaginal e o único caso de embolia pulmonar observado indica uma incidência menor com Intrarosa do que no grupo de placebo.
Comparação
Estima-se que, durante um período de 5 anos, um média de 4 a 7 de cada 1000 mulheres de cerca de 50 anos de idade que não recebem THS apresentarão um coágulo sanguíneo em uma veia.
Doença cardíaca (infarto do miocárdio)/Hipertensão
Nas mulheres que recebem terapia apenas com estrógenos, não aumenta o risco de sofrer uma doença do coração.
Acidente vascular cerebral
O risco de sofrer um acidente vascular cerebral é aproximadamente 1,5 vezes maior nas usuárias de THS do que nas não usuárias. O número de casos adicionais de acidente vascular cerebral devido ao uso de THS aumenta com a idade.
Não se observaram casos de acidente vascular cerebral com Intrarosa nos ensaios clínicos.
Comparação
Estima-se que, durante um período de 5 anos, um média de 8 de cada 1000 mulheres, de cerca de 50 anos, que não recebem THS sofrerão um acidente vascular cerebral. Nas mulheres de cerca de 50 anos que estão a receber THS, o número de casos será de 11 por cada 1000 usuárias durante um período de 5 anos (ou seja, 3 casos adicionais).
Outras condições
- A THS não previne a perda de memória. Existem alguns indícios de um maior risco de perda de memória em mulheres que começaram a usar THS após os 65 anos. Peça conselho ao seu médico.
- Pode apresentar fluxo vaginal devido a que a «base de gordura» se funde, e isso se adiciona ao aumento das secreções vaginais devido ao tratamento. Se se produzir fluxo vaginal, não é necessário interromper a administração de Intrarosa.
- Intrarosa pode alterar os preservativos, diafragmas e capuzes cervicais de látex.
- Se tiver uma infecção vaginal, necessitará de receber um ciclo de antibióticos antes de tomar Intrarosa.
Crianças e adolescentes
Intrarosa só é utilizado em mulheres adultas.
Outros medicamentos e Intrarosa
Informa ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou possa ter que tomar qualquer outro medicamento.
Não se dispõe de dados de eficácia e segurança em mulheres tratadas atualmente com tratamento hormonal como: andrógenos, THS (estrógenos sozinhos ou combinados com progestágenos).
Não se recomenda o uso de Intrarosa em combinação com THS (tratamento com apenas estrógenos, estrógenos-progestágenos ou tratamento com andrógenos) ou com estrógenos vaginais.
Gravidez, lactação e fertilidade
Gravidez e lactação
Intrarosa só deve ser utilizado em mulheres pós-menopáusicas. Se ficar grávida, deixe de tomar Intrarosa e consulte o seu médico.
Fertilidade
Intrarosa está contraindicado em mulheres em idade fértil. Não se sabe se este medicamento afeta a fertilidade.
Condução e uso de máquinas
Intrarosa não afeta geralmente a capacidade para conduzir ou utilizar máquinas.
3. Como usar Intrarosa
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
O seu médico tentará prescrever-lhe a dose mais baixa para tratar os seus sintomas durante o período mais curto possível. Fale com o seu médico se acredita que esta dose é excessiva ou insuficiente.
Quantidade que deve usar
Utilize um óvulo uma vez por dia, ao deitar-se.
Como usar Intrarosa
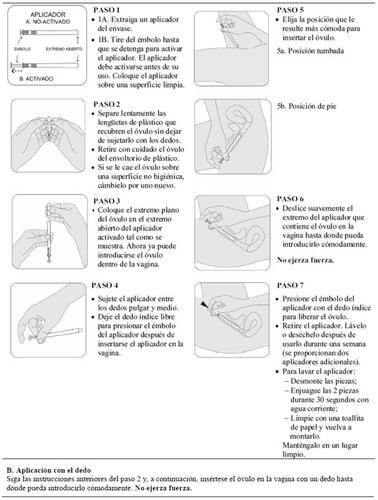
Introduza o óvulo na vagina com o dedo ou com um aplicador fornecido no envase.
Leia cuidadosamente as instruções de uso de Intrarosa no final do prospecto antes de utilizar este medicamento.
Durante quanto tempo se deve usar
Uma vez iniciado o uso, vá ao médico pelo menos de 6 em 6 meses para verificar se tem que continuar a usar Intrarosa.
Se usar mais Intrarosa do que deve
Recomenda-se um duche vaginal.
Se esquecer de usar Intrarosa
Se esquecer de usar um óvulo, insira um assim que se lembrar. No entanto, se faltarem menos de 8 horas para a dose seguinte, salte o óvulo esquecido.
Não use dois óvulos para compensar a dose esquecida.
Se necessita de se submeter a uma intervenção cirúrgica
Se vai se submeter a uma intervenção cirúrgica, informe o cirurgião de que está a usar Intrarosa. É possível que tenha que deixar de usar Intrarosa entre 4 e 6 semanas antes da operação para reduzir o risco de um coágulo de sangue (ver secção 2, «Coágulos de sangue em uma veia (trombose)»). Pergunte ao seu médico quando pode começar a usar Intrarosa novamente.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode provocar efeitos adversos, embora nem todas as pessoas os sofram.
As seguintes doenças são observadas com mais frequência em mulheres que utilizam medicamentos de THS que circulam no sangue, em comparação com as mulheres que não utilizam THS. Estes riscos aplicam-se menos aos tratamentos com estrógenos administrados por via vaginal:
- câncer de mama;
- câncer de ovários;
- coágulos sanguíneos nas veias das pernas ou nos pulmões (tromboembolismo venoso);
- acidente vascular cerebral;
- provável perda de memória se se inicia a THS com mais de 65 anos de idade.
Para mais informações sobre estes efeitos adversos, consulte a secção 2.
O efeito adverso comunicado com mais frequência nos estudos clínicos foi o fluxo vaginal. Isso se deve provavelmente a que a gordura dura se funde e isso se adiciona ao aumento esperado das secreções vaginais causado pelo tratamento. O fluxo vaginal não obriga a interromper a administração de Intrarosa.
Também se comunicaram os seguintes efeitos adversos:
- frequentes (pode afetar até 1 de cada 10 pessoas): citologia vaginal anormal (na maioria dos casos, ASCUS ou LGSIL), flutuações do peso (aumento ou diminuição);
- pouco frequentes (pode afetar até 1 de cada 100 pessoas): pólipos cervicais ou uterinos benignos, massa mamária benigna.
Comunicaram-se os seguintes efeitos adversos com THS que contêm estrógenos, mas não com Intrarosa, durante os ensaios clínicos:
- doença da vesícula biliar
- diversos distúrbios cutâneos:
- pigmentação da pele, especialmente no rosto e no pescoço, o que se conhece como «paño do embarazo» (cloasma)
- nódulos cutâneos vermelhos e dolorosos (eritema nodular)
- erupção com úlceras ou vermelhidão em forma de alvo (eritema multiforme)
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es
Ao comunicar efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Intrarosa
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e no blister após EXP. A data de validade é o último dia do mês que se indica.
Conservar abaixo de 30 °C.
Não congelar.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Intrarosa
- O princípio ativo é a prasterona. Cada óvulo contém 6,5 mg de prasterona.
- O outro componente é a gordura dura (adeps solidus).
Aspecto do produto e conteúdo do envase
Intrarosa é um óvulo de cor branca ou esbranquiçada, com forma de bala, de aproximadamente 28 mm de comprimento e 9 mm de diâmetro no seu extremo mais largo.
O aplicador é de LDPE e corante a 1 % (dióxido de titânio).
Apresenta-se em envases blister que contêm 28 óvulos com 6 aplicadores.
Título da autorização de comercialização
Endoceutics S.A.
Rue Belliard 40
1040 Bruxelas
Bélgica
Responsável pela fabricação
Basic Pharma Manufacturing B.V.
Burgemeester Lemmensstraat 352
6163 JT Geleen
Países Baixos
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização: Bélgica, Luxemburgo, Países Baixos Theramex Belgium BVBA Tel: + 32 (0) 28088080 |
Alemanha, Áustria Theramex Germany GmbH Tel: + 49 (0) 32 2122 490 37 |
Espanha Theramex Ireland Limited Tel: + 34 911 143 487 |
França Theramex France S.A.S. Tel: + 33 (0) 800100350 |
Itália Theramex Italy S.r.l. Tel: + 39 02 81480024 |
Polônia Theramex Poland sp. z o.o. Tel.: + 48 (0) 22 30 77 166 |
Portugal Tecnimede - Sociedade Técnico-Medicinal, S.A. Tel: + 351 210 414 100 |
Reino Unido (Irlanda do Norte), Irlanda, Malta Theramex UK Limited Tel: + 44 (0) 3330096795 |
Dinamarca, Islândia, Noruega, Finlândia, Suécia Avia Pharma AB Suécia/ Islândia/ Finlândia Tel: + 46 (0) 8 544 900 22 República Tcheca, Estônia, Grécia, Croácia, Chipre, Letônia, Lituânia, Hungria, Romênia, Eslovênia, Eslováquia Theramex Ireland Limited Tel: + 353 (0) 15138855 Data da última revisão deste prospecto 12/2023. Outras fontes de informação A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: http://www.ema.europa.eu. Instruções de uso de Intrarosa Como devo utilizar Intrarosa
Antes de começar
|
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a INTRAROSA 6,5 mg ÓVULOS VAGINAISForma farmacêutica: COMPRIMIDO, 20 mgSubstância ativa: bazedoxifeneFabricante: Pfizer Europe Ma EeigRequer receita médicaForma farmacêutica: COMPRIMIDO, 20 mgSubstância ativa: bazedoxifeneFabricante: Pfizer Europe Ma EeigRequer receita médicaForma farmacêutica: COMPRIMIDO, 20 mgSubstância ativa: bazedoxifeneFabricante: Pfizer Europe Ma EeigRequer receita médica
Médicos online para INTRAROSA 6,5 mg ÓVULOS VAGINAIS
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de INTRAROSA 6,5 mg ÓVULOS VAGINAIS – sujeita a avaliação médica e regras locais.