

Hemosol Bo

Pergunte a um médico sobre a prescrição de Hemosol Bo

Como usar Hemosol Bo
Folheto informativo para o utilizador
Hemosol B0 solução para hemodiálise/hemofiltragem
Cloruro de sód/cloreto de cálcio di-hidratado/cloreto de magnésio hexa-hidratado/ácido láctico/bicarbonato de sódio
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Hemosol B0 e para que é utilizado
- 2. Informações importantes antes de usar o medicamento Hemosol B0
- 3. Como usar o medicamento Hemosol B0
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Hemosol B0
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Hemosol B0 e para que é utilizado
O medicamento Hemosol B0 é utilizado em hospitais, nas unidades de cuidados intensivos, para corrigir o desequilíbrio químico do sangue resultante da insuficiência renal. O tratamento tem como objetivo remover do sangue os produtos de metabolismo acumulados em pessoas cujos rins não funcionam corretamente.
O medicamento Hemosol B0 é utilizado em adultos e crianças de todas as idades nos seguintes tipos de tratamento:
- hemofiltragem,
- hemodiafiltragem e
- hemodiálise.
2. Informações importantes antes de usar o medicamento Hemosol B0
Quando não usar o medicamento Hemosol B0:
Se o doente for alérgico a uma das substâncias ativas ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Hemosol B0, deve discutir com o médico, farmacêutico ou enfermeiro.
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados. Eles garantirão o uso seguro do medicamento.
Antes e durante o tratamento, o sangue do doente será examinado, por exemplo, controlando o equilíbrio ácido-básico e as concentrações de sais (eletrólitos) no sangue, bem como todos os líquidos administrados (infusão intravenosa) e eliminados (excreção urinária), mesmo aqueles que não estão diretamente relacionados ao tratamento.
Devido ao fato de o Hemosol B0 não conter potássio, é necessário prestar atenção especial à concentração de potássio no sangue do doente. Se o doente tiver uma concentração baixa de potássio, pode ser necessário suplementá-lo.
Crianças
Não há precauções ou advertências especiais relacionadas ao uso deste medicamento em crianças.
Medicamento Hemosol B0 e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar, incluindo aqueles que são vendidos sem receita.
Durante o tratamento com o medicamento Hemosol B0, a concentração no sangue de outros medicamentos administrados concomitantemente pode diminuir. O médico responsável pelo tratamento pode recomendar a alteração dos medicamentos atualmente administrados.
Em particular, deve informar o médico se o doente estiver a tomar algum dos seguintes medicamentos:
- glicosídeos cardíacos (usados no tratamento de certas doenças cardíacas), pois aumentam o risco de ritmo cardíaco irregular ou paroxístico (distúrbios do ritmo cardíaco), se a concentração de potássio no sangue for baixa (hipocalemia);
- vitamina D e medicamentos que contenham cálcio, pois podem aumentar o risco de ocorrência de uma concentração elevada de cálcio no sangue (hipercalcemia).
A adição de bicarbonato de sódio (ou outra substância tampão) pode aumentar o risco de ocorrência de um excesso de bicarbonatos no sangue (alcalose metabólica).
Se o citrato for usado como anticoagulante, pode diminuir a concentração de cálcio no soro.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de usar este medicamento. Não se espera que o medicamento tenha um efeito na fertilidade, gravidez ou nos recém-nascidos/crianças amamentadas. O médico responsável pelo tratamento deve considerar a relação risco-benefício antes de administrar o medicamento Hemosol B0 à doente grávida ou durante a amamentação.
Condução de veículos e utilização de máquinas
O Hemosol B0 não tem efeito na capacidade de conduzir veículos ou utilizar máquinas.
3. Como usar o medicamento Hemosol B0
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados.
A quantidade do medicamento Hemosol B0, ou seja, a dose administrada, depende do estado clínico do doente. A dose (quantidade) será determinada pelo médico responsável pelo tratamento.
O Hemosol B0 pode ser administrado diretamente na circulação sanguínea (intravenosamente) ou por hemodiálise, durante a qual a solução flui de um lado da membrana dialítica e o sangue do outro.
Uso de uma dose maior do que a recomendada do medicamento Hemosol B0
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados, e o equilíbrio de líquidos, eletrólitos e equilíbrio ácido-básico será cuidadosamente controlado no doente.
Neste caso, é muito improvável que o doente receba uma dose maior do medicamento Hemosol B0 do que a recomendada.
No entanto, se ocorrer uma sobredose, o médico responsável pelo tratamento tomará as medidas necessárias e ajustará a dose.
A sobredose pode levar a:
- uma quantidade excessiva de líquido no sangue,
- um aumento da concentração de bicarbonato no sangue (alcalose metabólica),
- e (ou) uma diminuição da concentração de sais no sangue (hipofosfatemia, hipocalemia).
Para saber mais sobre as instruções de uso do medicamento, ver o ponto "Informações destinadas apenas ao pessoal médico qualificado".
Em caso de dúvidas adicionais relacionadas ao uso deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Foram relatados os seguintes efeitos não desejados:
Frequência: desconhecida (frequência não pode ser estimada com base nos dados disponíveis)
- mudanças nas concentrações de sais minerais no sangue (distúrbios do equilíbrio eletrólito, como hipofosfatemia, hipocalemia);
- aumento da concentração de bicarbonato no soro (alcalose metabólica) ou diminuição da concentração de bicarbonato no soro (acidose metabólica);
- quantidade excessiva ou insuficiente de água no organismo (hiper-hidratação ou desidratação);
- náuseas;
- vômitos;
- cãibras musculares;
- baixa pressão sanguínea (hipotensão).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Autoridade de Regulação de Medicamentos, Produtos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode permitir a recolha de mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Hemosol B0
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não usar este medicamento após o prazo de validade impresso na parte traseira do saco e na etiqueta da caixa após: Prazo de validade. O prazo de validade refere-se ao último dia do mês indicado.
Não deve ser conservado a uma temperatura abaixo de 4°C.
Foi demonstrado que a solução pronta para uso mantém a estabilidade química e física durante 24 horas a 22°C. Do ponto de vista microbiológico, a solução pronta para uso deve ser utilizada imediatamente. Se não for utilizada imediatamente, a responsabilidade pelo tempo e condições de conservação da solução antes da administração cabe ao utilizador, e o tempo de conservação não deve exceder 24 horas, incluindo o tempo de tratamento.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Hemosol B0
As substâncias ativas antes e após a mistura são apresentadas abaixo.
Substâncias ativas antes da mistura:
1000 ml da solução contida na câmara pequena (A)contém:
Cloruro de cálcio, 2H2O
5,145 g
Cloruro de magnésio, 6H2O
2,033 g
Ácido láctico
5,4 g
1000 ml da solução contida na câmara grande (B)contém:
Bicarbonato de sódio
3,09 g
Cloruro de sódio
6,45 g
Substâncias ativas após a mistura:
A composição da solução (5000 ml) obtida após a mistura do conteúdo da câmara A (250 ml) e da câmara B (4750 ml) é a seguinte:
mmol/l
Cálcio, Ca
1,75
Magnésio, Mg
0,5
Sódio, Na
140
Cloruros, Cl
109,5
Lactatos
3
Bicarbonatos, HCO3
32
Osmolalidade teórica: 287 mOsm/l
Outros componentes são:dióxido de carbono (E 290) e água para injeção.
Como é o medicamento Hemosol B0 e o que contém o pacote
O Hemosol B0 está contido em um saco de duas câmaras. O saco está colocado em um pacote exterior transparente.
Para obter a solução pronta para uso, deve quebrar a tampa quebradiça e misturar as duas soluções.
A solução pronta para uso é transparente e incolor. Cada saco (A+B) contém 5000 ml de solução para hemofiltragem, hemodiafiltragem e (ou) hemodiálise.
Cada caixa contém dois sacos e um folheto informativo para o doente.
Titular da autorização de comercialização
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Bélgica
Fabricante
Bieffe Medital S.p.A.,
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited,
Moneen Road,
Castlebar,
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado para comercialização nos Estados-Membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
Áustria, Bélgica, Bulgária, Croácia, Chipre, República Checa, Dinamarca, Estónia, Finlândia, França, Alemanha, Grécia, Islândia, Irlanda, Letónia, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polónia, Portugal, Eslováquia, Eslovénia, Espanha, Suécia, Reino Unido (Irlanda do Norte): Hemosol B0.
Data da última revisão do folheto: setembro de 2024 -------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico qualificado
Hemosol B0 solução para hemodiálise/hemofiltragem
Precauções
Deve seguir estritamente as instruções de uso do medicamento Hemosol B0.
As soluções das duas câmaras devemser misturadas antes do uso.
A utilização de uma solução contaminada para hemofiltragem pode causar septicemia, choque e morte do doente.
Para aumentar o confort do doente, o Hemosol B0 pode ser aquecido a uma temperatura de 37°C. O aquecimento da solução antes do uso deve ser feito antes da reconstituição e apenas com uma fonte de calor seca. As soluções não devem ser aquecidas em banho-maria ou forno micro-ondas. Se a solução e o pacote o permitirem, antes da administração, deve verificar visualmente a solução para detectar a presença de partículas sólidas e alterações da cor. Não administrar se a solução não for transparente ou se a tampa quebradiça estiver danificada.
A substituição adicional de bicarbonato de sódio pode aumentar o risco de ocorrência de alcalose metabólica.
Antes de iniciar o tratamento e durante o seu curso, deve controlar estritamente o equilíbrio eletrólito e o equilíbrio ácido-básico. Como o Hemosol B0 não contém potássio, a concentração de potássio no soro deve ser monitorizada antes e durante a hemofiltragem e (ou) hemodiálise.
Pode ser necessário suplementar potássio.
À solução pode ser adicionado fosfato em uma quantidade de até 1,2 mmol/l. No caso de adição de fosfato de potássio, a concentração total de potássio não deve exceder 4 mEq/l (4 mmol/l).
A quantidade e a velocidade com que o medicamento Hemosol B0 é administrado dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do doente.
A forma de administração (dose, velocidade de infusão e volume total) do medicamento Hemosol B0 deve ser determinada pelo médico. A hemofiltragem contínua remove o excesso de líquido e eletrólitos.
Se ocorrer um distúrbio do equilíbrio de líquidos, deve monitorar estritamente o estado clínico do doente e, se necessário, corrigir o equilíbrio de líquidos.
Se o doente tiver insuficiência renal, como resultado de uma sobredose, pode ocorrer uma sobrecarga de líquidos e podem ocorrer consequências graves, como insuficiência cardíaca congestiva, distúrbios do equilíbrio eletrólito ou ácido-básico.
Como a solução não contém glicose, a sua administração pode levar à ocorrência de hipoglicemia.
Deve monitorar regularmente a concentração de glicose no sangue.
O Hemosol B0 contém bicarbonato (bicarbonato de sódio) e lactato (precursor de bicarbonato) que podem afetar o equilíbrio ácido-básico do doente. Se, durante o tratamento com a solução, ocorrer ou piorar a alcalose metabólica, pode ser necessário diminuir a velocidade de administração ou interromper a administração do medicamento.
Dosagem
A velocidade de fluxo comumente utilizada da solução de substituição na hemofiltragem e hemodiafiltragem é:
Adultos:
500-3000 ml/hora.
A velocidade de fluxo comumente utilizada da solução dialítica (dializato) na hemodiálise contínua é:
Adultos:
500-2500 ml/hora.
Nos adultos, a velocidade de fluxo combinada comumente utilizada é de aproximadamente 2000 a 2500 ml/hora, o que corresponde a um volume diário de líquido na faixa de aproximadamente 48 a 60 litros.
Crianças e jovens
A faixa de velocidade de fluxo da solução de substituição na hemofiltragem e hemodiafiltragem e da solução dialítica (dializato) na hemodiálise contínua é:
Crianças (desde recém-nascidos até jovens de 18 anos): 1000-2000 ml/hora/1,73 m2.
As velocidades de fluxo necessárias podem chegar a 4000 ml/hora/1,73 m2, especialmente em crianças mais jovens (≤10 kg). A velocidade de fluxo absoluta (em ml/hora) em crianças e jovens geralmente não deve exceder a velocidade de fluxo máxima utilizada em adultos.
Modo de uso
Para obter a solução pronta para uso, a solução de eletrólitos (câmara pequena A) deve ser adicionada à solução tampão (câmara grande B) após a quebra da tampa quebradiça, imediatamente antes do uso.
Deve ser utilizado apenas com o equipamento apropriado para o tratamento de substituição renal extracorpórea.
Durante o procedimento e a administração do medicamento ao doente, deve utilizar a técnica asséptica.
Deve ser utilizado apenas quando o pacote exterior de proteção estiver intacto, todas as soldas estiverem intactas, a tampa quebradiça estiver intacta e a solução for transparente. Deve apertar firmemente o saco para verificar a sua estanqueidade. Se detectar uma fuga, a solução deve ser descartada imediatamente, pois não é possível garantir a esterilidade.
A câmara grande B está equipada com um porto de injeção, que permite, após a reconstituição da solução, a adição de outros medicamentos necessários. O médico é responsável por avaliar a compatibilidade do medicamento adicional com o produto Hemosol B0, verificando se não ocorrem alterações da cor e (ou) precipitação de sedimento, formação de complexos insolúveis ou cristais. Antes de adicionar o medicamento, deve verificar se ele é solúvel e estável em água com um pH igual ao pH do produto Hemosol B0 (pH da solução pronta para uso é de 7,0 a 8,5). Os componentes adicionais podem não ser compatíveis com a solução. Deve ler as instruções de uso do medicamento a ser adicionado.
Deve remover o líquido do porto de injeção, segurar o saco com a parte inferior para cima, administrar o medicamento no porto de injeção e misturar completamente. Deve iniciar imediatamente a administração da solução.
A adição e mistura de componentes adicionais devem ser sempre realizadas antes de conectar o saco com a solução ao circuito extracorpóreo.
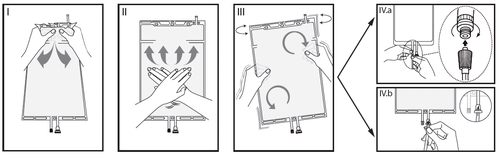
I
Imediatamente antes do uso, retire o pacote exterior do saco e descarte todos os materiais de embalagem restantes. Abra a proteção, quebrando a tampa quebradiça localizada entre as duas câmaras do saco. A tampa quebradiça permanecerá no saco.
II
Certifique-se de que todo o líquido da câmara pequena A foi transferido para a câmara grande B.
III
Enxague duas vezesa câmara pequena A, espremendo a solução misturada de volta para a câmara pequena A e, em seguida, novamente para a câmara grande B.
IV
Se a câmara pequena A estiver vazia: agite a câmara grande B para misturar completamente o seu conteúdo. Agora a solução está pronta para uso e o saco pode ser pendurado no suporte.
V
Cada um dos dois portos de acesso pode ser conectado à linha de diálise ou troca.
V.a
Se estiver usando o acesso do tipo luer, retire a tampa e conecte a extremidade macho do tipo luer lock da linha de diálise ou troca à extremidade fêmea do tipo luer receptor no saco; aperte.
Segurando com o polegar e os dedos, quebre a tampa quebradiça colorida na sua base e mova-a para trás e para frente. Não use ferramentas. Verifique se a tampa está completamente separada e se o líquido flui livremente. Durante o tratamento, a tampa permanecerá no porto do tipo luer.
V.b
Se estiver usando o porto de injeção, retire primeiro a tampa quebrando-a. O porto de injeção pode ser limpo com desinfetantes. Em seguida, perfure a vedação de borracha com uma agulha. Verifique se o líquido flui livremente.
A solução pronta para uso deve ser administrada imediatamente após a remoção do pacote exterior.
Se a solução pronta para uso não for administrada imediatamente, deve ser utilizada dentro de 24 horas, incluindo o tempo de tratamento, após a adição da solução de eletrólitos à solução tampão.
A solução pronta para uso é destinada apenas a um uso único. Deve descartar a solução não utilizada imediatamente após a administração.
Os resíduos não utilizados do medicamento ou seus resíduos devem ser eliminados de acordo com as regulamentações locais.
Folheto informativo para o utilizador
Hemosol B0 solução para hemodiálise/hemofiltragem
Cloruro de sódio/cloruro de cálcio di-hidratado/cloruro de magnésio hexa-hidratado/ácido láctico/bicarbonato de sódio
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Hemosol B0 e para que é utilizado
- 2. Informações importantes antes de usar o medicamento Hemosol B0
- 3. Como usar o medicamento Hemosol B0
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Hemosol B0
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Hemosol B0 e para que é utilizado
O medicamento Hemosol B0 é utilizado em hospitais, nas unidades de cuidados intensivos, para corrigir o desequilíbrio químico do sangue resultante da insuficiência renal. O tratamento tem como objetivo remover do sangue os produtos de metabolismo acumulados em pessoas cujos rins não funcionam corretamente.
O medicamento Hemosol B0 é utilizado em adultos e crianças de todas as idades nos seguintes tipos de tratamento:
- hemofiltragem,
- hemodiafiltragem e
- hemodiálise.
2. Informações importantes antes de usar o medicamento Hemosol B0
Quando não usar o medicamento Hemosol B0:
Se o doente for alérgico a uma das substâncias ativas ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Hemosol B0, deve discutir com o médico, farmacêutico ou enfermeiro.
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados. Eles garantirão o uso seguro do medicamento.
Antes e durante o tratamento, o sangue do doente será examinado, por exemplo, controlando o equilíbrio ácido-básico e as concentrações de sais (eletrólitos) no sangue, bem como todos os líquidos administrados (infusão intravenosa) e eliminados (excreção urinária), mesmo aqueles que não estão diretamente relacionados ao tratamento.
Devido ao fato de o Hemosol B0 não conter potássio, é necessário prestar atenção especial à concentração de potássio no sangue do doente. Se o doente tiver uma concentração baixa de potássio, pode ser necessário suplementá-lo.
Crianças
Não há precauções ou advertências especiais relacionadas ao uso deste medicamento em crianças.
Medicamento Hemosol B0 e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar, incluindo aqueles que são vendidos sem receita.
Durante o tratamento com o medicamento Hemosol B0, a concentração no sangue de outros medicamentos administrados concomitantemente pode diminuir. O médico responsável pelo tratamento pode recomendar a alteração dos medicamentos atualmente administrados.
Em particular, deve informar o médico se o doente estiver a tomar algum dos seguintes medicamentos:
- glicosídeos cardíacos (usados no tratamento de certas doenças cardíacas), pois aumentam o risco de ritmo cardíaco irregular ou paroxístico (distúrbios do ritmo cardíaco), se a concentração de potássio no sangue for baixa (hipocalemia);
- vitamina D e medicamentos que contenham cálcio, pois podem aumentar o risco de ocorrência de uma concentração elevada de cálcio no sangue (hipercalcemia).
A adição de bicarbonato de sódio (ou outra substância tampão) pode aumentar o risco de ocorrência de um excesso de bicarbonatos no sangue (alcalose metabólica).
Se o citrato for usado como anticoagulante, pode diminuir a concentração de cálcio no soro.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de usar este medicamento. Não se espera que o medicamento tenha um efeito na fertilidade, gravidez ou nos recém-nascidos/crianças amamentadas. O médico responsável pelo tratamento deve considerar a relação risco-benefício antes de administrar o medicamento Hemosol B0 à doente grávida ou durante a amamentação.
Condução de veículos e utilização de máquinas
O Hemosol B0 não tem efeito na capacidade de conduzir veículos ou utilizar máquinas.
3. Como usar o medicamento Hemosol B0
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados.
A quantidade do medicamento Hemosol B0, ou seja, a dose administrada, depende do estado clínico do doente. A dose (quantidade) será determinada pelo médico responsável pelo tratamento.
O Hemosol B0 pode ser administrado diretamente na circulação sanguínea (intravenosamente) ou por hemodiálise, durante a qual a solução flui de um lado da membrana dialítica e o sangue do outro.
Uso de uma dose maior do que a recomendada do medicamento Hemosol B0
O Hemosol B0 é um medicamento que deve ser utilizado em hospitais e pode ser administrado apenas por profissionais de saúde qualificados, e o equilíbrio de líquidos, eletrólitos e equilíbrio ácido-básico será cuidadosamente controlado no doente.
Neste caso, é muito improvável que o doente receba uma dose maior do medicamento Hemosol B0 do que a recomendada.
No entanto, se ocorrer uma sobredose, o médico responsável pelo tratamento tomará as medidas necessárias e ajustará a dose.
A sobredose pode levar a:
- uma quantidade excessiva de líquido no sangue,
- um aumento da concentração de bicarbonato no sangue (alcalose metabólica),
- e (ou) uma diminuição da concentração de sais no sangue (hipofosfatemia, hipocalemia).
Para saber mais sobre as instruções de uso do medicamento, ver o ponto "Informações destinadas apenas ao pessoal médico qualificado".
Em caso de dúvidas adicionais relacionadas ao uso deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Foram relatados os seguintes efeitos não desejados:
Frequência: desconhecida (frequência não pode ser estimada com base nos dados disponíveis)
- mudanças nas concentrações de sais minerais no sangue (distúrbios do equilíbrio eletrólito, como hipofosfatemia, hipocalemia);
- aumento da concentração de bicarbonato no soro (alcalose metabólica) ou diminuição da concentração de bicarbonato no soro (acidose metabólica);
- quantidade excessiva ou insuficiente de água no organismo (hiper-hidratação ou desidratação);
- náuseas;
- vômitos;
- cãibras musculares;
- baixa pressão sanguínea (hipotensão).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Autoridade de Regulação de Medicamentos, Produtos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode permitir a recolha de mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Hemosol B0
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não usar este medicamento após o prazo de validade impresso na parte traseira do saco e na etiqueta da caixa após: Prazo de validade. O prazo de validade refere-se ao último dia do mês indicado.
Não deve ser conservado a uma temperatura abaixo de 4°C.
Foi demonstrado que a solução pronta para uso mantém a estabilidade química e física durante 24 horas a 22°C. Do ponto de vista microbiológico, a solução pronta para uso deve ser utilizada imediatamente. Se não for utilizada imediatamente, a responsabilidade pelo tempo e condições de conservação da solução antes da administração cabe ao utilizador, e o tempo de conservação não deve exceder 24 horas, incluindo o tempo de tratamento.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Hemosol B0
As substâncias ativas antes e após a mistura são apresentadas abaixo.
Substâncias ativas antes da mistura:
1000 ml da solução contida na câmara pequena (A)contém:
Cloruro de cálcio, 2H2O
5,145 g
Cloruro de magnésio, 6H2O
2,033 g
Ácido láctico
5,4 g
1000 ml da solução contida na câmara grande (B)contém:
Bicarbonato de sódio
3,09 g
Cloruro de sódio
6,45 g
Substâncias ativas após a mistura:
A composição da solução (5000 ml) obtida após a mistura do conteúdo da câmara A (250 ml) e da câmara B (4750 ml) é a seguinte:
mmol/l
Cálcio, Ca
1,75
Magnésio, Mg
0,5
Sódio, Na
140
Cloruros, Cl
109,5
Lactatos
3
Bicarbonatos, HCO3
32
Osmolalidade teórica: 287 mOsm/l
Outros componentes são:dióxido de carbono (E 290) e água para injeção.
Como é o medicamento Hemosol B0 e o que contém o pacote
O Hemosol B0 está contido em um saco de duas câmaras. O saco está colocado em um pacote exterior transparente.
Para obter a solução pronta para uso, deve quebrar a tampa quebradiça e misturar as duas soluções.
A solução pronta para uso é transparente e incolor. Cada saco (A+B) contém 5000 ml de solução para hemofiltragem, hemodiafiltragem e (ou) hemodiálise.
Cada caixa contém dois sacos e um folheto informativo para o doente.
Titular da autorização de comercialização
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Bélgica
Fabricante
Bieffe Medital S.p.A.,
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited,
Moneen Road,
Castlebar,
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado para comercialização nos Estados-Membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
Áustria, Bélgica, Bulgária, Croácia, Chipre, República Checa, Dinamarca, Estónia, Finlândia, França, Alemanha, Grécia, Islândia, Irlanda, Letónia, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polónia, Portugal, Eslováquia, Eslovénia, Espanha, Suécia, Reino Unido (Irlanda do Norte): Hemosol B0.
Data da última revisão do folheto: setembro de 2024 -------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico qualificado
Hemosol B0 solução para hemodiálise/hemofiltragem
Precauções
Deve seguir estritamente as instruções de uso do medicamento Hemosol B0.
As soluções das duas câmaras devemser misturadas antes do uso.
A utilização de uma solução contaminada para hemofiltragem pode causar septicemia, choque e morte do doente.
Para aumentar o confort do doente, o Hemosol B0 pode ser aquecido a uma temperatura de 37°C. O aquecimento da solução antes do uso deve ser feito antes da reconstituição e apenas com uma fonte de calor seca. As soluções não devem ser aquecidas em banho-maria ou forno micro-ondas. Se a solução e o pacote o permitirem, antes da administração, deve verificar visualmente a solução para detectar a presença de partículas sólidas e alterações da cor. Não administrar se a solução não for transparente ou se a tampa quebradiça estiver danificada.
A substituição adicional de bicarbonato de sódio pode aumentar o risco de ocorrência de alcalose metabólica.
Antes de iniciar o tratamento e durante o seu curso, deve controlar estritamente o equilíbrio eletrólito e o equilíbrio ácido-básico. Como o Hemosol B0 não contém potássio, a concentração de potássio no soro deve ser monitorizada antes e durante a hemofiltragem e (ou) hemodiálise.
Pode ser necessário suplementar potássio.
À solução pode ser adicionado fosfato em uma quantidade de até 1,2 mmol/l. No caso de adição de fosfato de potássio, a concentração total de potássio não deve exceder 4 mEq/l (4 mmol/l).
A quantidade e a velocidade com que o medicamento Hemosol B0 é administrado dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-básico e do estado clínico geral do doente.
A forma de administração (dose, velocidade de infusão e volume total) do medicamento Hemosol B0 deve ser determinada pelo médico. A hemofiltragem contínua remove o excesso de líquido e eletrólitos.
Se ocorrer um distúrbio do equilíbrio de líquidos, deve monitorar estritamente o estado clínico do doente e, se necessário, corrigir o equilíbrio de líquidos.
Se o doente tiver insuficiência renal, como resultado de uma sobredose, pode ocorrer uma sobrecarga de líquidos e podem ocorrer consequências graves, como insuficiência cardíaca congestiva, distúrbios do equilíbrio eletrólito ou ácido-básico.
Como a solução não contém glicose, a sua administração pode levar à ocorrência de hipoglicemia.
Deve monitorar regularmente a concentração de glicose no sangue.
O Hemosol B0 contém bicarbonato (bicarbonato de sódio) e lactato (precursor de bicarbonato) que podem afetar o equilíbrio ácido-básico do doente. Se, durante o tratamento com a solução, ocorrer ou piorar a alcalose metabólica, pode ser necessário diminuir a velocidade de administração ou interromper a administração do medicamento.
Dosagem
A velocidade de fluxo comumente utilizada da solução de substituição na hemofiltragem e hemodiafiltragem é:
Adultos:
500-3000 ml/hora.
A velocidade de fluxo comumente utilizada da solução dialítica (dializato) na hemodiálise contínua é:
Adultos:
500-2500 ml/hora.
Nos adultos, a velocidade de fluxo combinada comumente utilizada é de aproximadamente 2000 a 2500 ml/hora, o que corresponde a um volume diário de líquido na faixa de aproximadamente 48 a 60 litros.
Crianças e jovens
A faixa de velocidade de fluxo da solução de substituição na hemofiltragem e hemodiafiltragem e da solução dialítica (dializato) na hemodiálise contínua é:
Crianças (desde recém-nascidos até jovens de 18 anos): 1000-2000 ml/hora/1,73 m2.
As velocidades de fluxo necessárias podem chegar a 4000 ml/hora/1,73 m2, especialmente em crianças mais jovens (≤10 kg). A velocidade de fluxo absoluta (em ml/hora) em crianças e jovens geralmente não deve exceder a velocidade de fluxo máxima utilizada em adultos.
Modo de uso
Para obter a solução pronta para uso, a solução de eletrólitos (câmara pequena A) deve ser adicionada à solução tampão (câmara grande B) após a quebra da tampa quebradiça, imediatamente antes do uso.
Deve ser utilizado apenas com o equipamento apropriado para o tratamento de substituição renal extracorpórea.
Durante o procedimento e a administração do medicamento ao doente, deve utilizar a técnica asséptica.
Deve ser utilizado apenas quando o pacote exterior de proteção estiver intacto, todas as soldas estiverem intactas, a tampa quebradiça estiver intacta e a solução for transparente. Deve apertar firmemente o saco para verificar a sua estanqueidade. Se detectar uma fuga, a solução deve ser descartada imediatamente, pois não é possível garantir a esterilidade.
A câmara grande B está equipada com um porto de injeção, que permite, após a reconstituição da solução, a adição de outros medicamentos necessários. O médico é responsável por avaliar a compatibilidade do medicamento adicional com o produto Hemosol B0, verificando se não ocorrem alterações da cor e (ou) precipitação de sedimento, formação de complexos insolúveis ou cristais. Antes de adicionar o medicamento, deve verificar se ele é solúvel e estável em água com um pH igual ao pH do produto Hemosol B0 (pH da solução pronta para uso é de 7,0 a 8,5). Os componentes adicionais podem não ser compatíveis com a solução. Deve ler as instruções de uso do medicamento a ser adicionado.
Deve remover o líquido do porto de injeção, segurar o saco com a parte inferior para cima, administrar o medicamento no porto de injeção e misturar completamente. Deve iniciar imediatamente a administração da solução.
A adição e mistura de componentes adicionais devem ser sempre realizadas antes de conectar o saco com a solução ao circuito extracorpóreo.
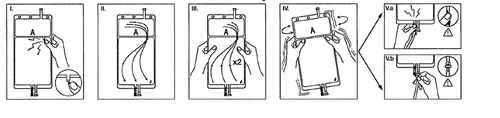
I
Imediatamente antes do uso, retire o pacote exterior do saco e descarte todos os materiais de embalagem restantes. Abra a proteção, quebrando a tampa quebradiça localizada entre as duas câmaras do saco. A tampa quebradiça permanecerá no saco.
II
Certifique-se de que todo o líquido da câmara pequena A foi transferido para a câmara grande B.
III
Enxague duas vezesa câmara pequena A, espremendo a solução misturada de volta para a câmara pequena A e, em seguida, novamente para a câmara grande B.
IV
Se a câmara pequena A estiver vazia: agite a câmara grande B para misturar completamente o seu conteúdo. Agora a solução está pronta para uso e o saco pode ser pendurado no suporte.
V
Cada um dos dois portos de acesso pode ser conectado à linha de diálise ou troca.
V.a
Se estiver usando o acesso do tipo luer, retire a tampa e conecte a extremidade macho do tipo luer lock da linha de diálise ou troca à extremidade fêmea do tipo luer receptor no saco; aperte.
Segurando com o polegar e os dedos, quebre a tampa quebradiça colorida na sua base e mova-a para trás e para frente. Não use ferramentas. Verifique se a tampa está completamente separada e se o líquido flui livremente. Durante o tratamento, a tampa permanecerá no porto do tipo luer.
V.b
Se estiver usando o porto de injeção, retire primeiro a tampa quebrando-a. O porto de injeção pode ser limpo com desinfetantes. Em seguida, perfure a vedação de borracha com uma agulha. Verifique se o líquido flui livremente.
A solução pronta para uso deve ser administrada imediatamente após a remoção do pacote exterior.
Se a solução pronta para uso não for administrada imediatamente, deve ser utilizada dentro de 24 horas, incluindo o tempo de tratamento, após a adição da solução de eletrólitos à solução tampão.
A solução pronta para uso é destinada apenas a um uso único. Deve descartar a solução não utilizada imediatamente após a administração.
Os resíduos não utilizados do medicamento ou seus resíduos devem ser eliminados de acordo com as regulamentações locais.
1. O que é o medicamento Hemosol B0 e para que é usado
O medicamento Hemosol B0 é usado em hospitais, nas unidades de cuidados intensivos, para corrigir o desequilíbrio químico do sangue causado por insuficiência renal. O tratamento visa remover os produtos do metabolismo acumulados no sangue de pessoas cujos rins não funcionam corretamente.
O medicamento Hemosol B0 é usado em adultos e crianças de todas as idades nos seguintes tipos de tratamento:
- hemofiltragem,
- hemodiafiltragem e
- hemodiálise.
2. Informações importantes antes de usar o medicamento Hemosol B0
Quando não usar o medicamento Hemosol B0:
Se o paciente for alérgico a uma das substâncias ativas ou a qualquer um dos outros componentes do medicamento (listados no ponto 6).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Hemosol B0, deve discutir com o médico, farmacêutico ou enfermeiro.
O medicamento Hemosol B0 é um medicamento que deve ser usado em um hospital e só pode ser administrado por profissionais de saúde qualificados. Eles garantirão que o medicamento seja usado com segurança.
Antes e durante o tratamento, o sangue do paciente será monitorado, por exemplo, para controlar o equilíbrio ácido-base e os níveis de sais (eletrólitos) no sangue, bem como todos os líquidos administrados (infusão intravenosa) e eliminados (urina), mesmo que não estejam diretamente relacionados ao tratamento.
Devido ao fato de o Hemosol B0 não conter potássio, é importante prestar atenção especial ao nível de potássio no sangue do paciente. Se o paciente tiver níveis baixos de potássio, pode ser necessário suplementá-lo.
Crianças
Não há precauções ou advertências especiais para o uso deste medicamento em crianças.
Interacções com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar, incluindo os que são vendidos sem receita médica.
Durante o tratamento com o medicamento Hemosol B0, o nível de outros medicamentos usados concomitantemente pode diminuir. O médico responsável pelo tratamento pode recomendar a alteração dos medicamentos atualmente usados.
Em particular, deve informar o médico se o paciente estiver tomando algum dos seguintes medicamentos:
- glicosídeos cardíacos (usados no tratamento de certas doenças cardíacas), pois aumentam o risco de ritmo cardíaco irregular ou intermitente (distúrbios do ritmo cardíaco), se o nível de potássio no sangue for baixo (hipocalemia);
- vitamina D e medicamentos que contenham cálcio, pois podem aumentar o risco de níveis elevados de cálcio no sangue (hipercalcemia).
A adição de bicarbonato de sódio (ou outra substância tampão) pode aumentar o risco de excesso de bicarbonato no sangue (alcalose metabólica).
Se o citrato for usado como anticoagulante, pode diminuir o nível de cálcio no soro.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou amamentando, achar que pode estar grávida ou planejar ter um filho, deve consultar um médico ou farmacêutico antes de usar este medicamento. Não se espera que o medicamento afete a fertilidade, gravidez ou recém-nascidos/lactentes. O médico responsável pelo tratamento deve considerar a relação risco-benefício antes de administrar o medicamento Hemosol B0 a uma paciente grávida ou em período de amamentação.
Condução de veículos e uso de máquinas
O medicamento Hemosol B0 não afeta a capacidade de conduzir veículos ou usar máquinas.
3. Como usar o medicamento Hemosol B0
O medicamento Hemosol B0 é um medicamento que deve ser usado em um hospital e só pode ser administrado por profissionais de saúde qualificados.
O volume do medicamento Hemosol B0, ou seja, a dose usada, depende do estado clínico do paciente. A dose (volume) será determinada pelo médico responsável pelo tratamento.
O medicamento Hemosol B0 pode ser administrado diretamente na corrente sanguínea (intravenosa) ou por hemodiálise, durante a qual a solução flui de um lado da membrana dialítica e o sangue do outro.
Uso de uma dose maior do que a recomendada do medicamento Hemosol B0
O medicamento Hemosol B0 é um medicamento que deve ser usado em um hospital e só pode ser administrado por profissionais de saúde qualificados, e o equilíbrio de líquidos, eletrólitos e equilíbrio ácido-base será cuidadosamente controlado no paciente.
Portanto, é muito improvável que o paciente receba uma dose maior do que a recomendada do medicamento Hemosol B0.
Se ocorrer uma superdose, o médico responsável pelo tratamento tomará as medidas necessárias e ajustará a dose.
A superdose pode levar a:
- excesso de líquido no sangue,
- aumento do nível de bicarbonato no sangue (alcalose metabólica)
- e (ou) diminuição do nível de sais no sangue (hipofosfatemia, hipocalemia).
Para obter informações sobre como usar o medicamento, ver o ponto "Informações destinadas apenas ao pessoal médico qualificado".
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar um médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Foram relatados os seguintes efeitos não desejados:
Frequência: desconhecida (frequência não pode ser estimada com base nos dados disponíveis)
- mudanças nos níveis de sais minerais no sangue (distúrbios do equilíbrio eletrolítico, como hipofosfatemia, hipocalemia);
- aumento do nível de bicarbonato no soro (alcalose metabólica) ou diminuição do nível de bicarbonato no soro (acidose metabólica);
- excesso ou falta de líquido no organismo (hiper-hidratação ou desidratação);
- náuseas;
- vômitos;
- cãibras musculares;
- pressão arterial baixa (hipotensão).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado no folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Produtos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Site da internet: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como armazenar o medicamento Hemosol B0
O medicamento deve ser armazenado em um local não visível e inacessível a crianças.
Não usar este medicamento após a data de validade impressa na parte traseira do saco e na etiqueta da caixa após: Data de validade. A data de validade refere-se ao último dia do mês indicado.
Não armazenar a uma temperatura abaixo de 4°C.
Foi demonstrado que a solução pronta para uso mantém a estabilidade química e física por 24 horas a 22°C. Do ponto de vista microbiológico, a solução pronta para uso deve ser usada imediatamente. Se não for usada imediatamente, a responsabilidade pelo tempo e condições de armazenamento antes do uso é do usuário, e o tempo de armazenamento não deve exceder 24 horas, incluindo o tempo de tratamento.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais usados. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Hemosol B0
As substâncias ativas antes e após a mistura são apresentadas abaixo.
Substâncias ativas antes da mistura:
1000 ml da solução contida na pequena câmara (A)contém:
Cloruro de cálcio, 2H2O
5,145 g
Cloruro de magnésio, 6H2O
2,033 g
Ácido láctico
5,4 g
1000 ml da solução contida na grande câmara (B)contém:
Bicarbonato de sódio
3,09 g
Cloruro de sódio
6,45 g
Substâncias ativas após a mistura:
A composição da solução (5000 ml) obtida após a mistura do conteúdo da câmara A (250 ml) e da câmara B (4750 ml) é a seguinte:
mmol/l
Cálcio, Ca
1,75
Magnésio, Mg
0,5
Sódio, Na
140
Cloruros, Cl
109,5
Lactatos
3
Bicarbonatos, HCO3
32
Osmolalidade teórica: 287 mOsm/l
Outros componentes são:dióxido de carbono (E 290) e água para injeção.
Como é o medicamento Hemosol B0 e o que contém a embalagem
O medicamento Hemosol B0 está contido em um saco de duas câmaras. O saco está colocado em uma embalagem externa transparente.
Para obter a solução pronta para uso, deve quebrar a tampa quebradiça e misturar as duas soluções.
A solução pronta para uso é transparente e incolor. Cada saco (A+B) contém 5000 ml de solução para hemofiltragem, hemodiafiltragem e (ou) hemodiálise.
Cada caixa contém dois sacos e uma bula para o paciente.
Titular da autorização de comercialização
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Bélgica
Fabricante
Bieffe Medital S.p.A.,
Via Stelvio 94,
23035 Sondalo (SO),
Itália
ou
Vantive Manufacturing Limited,
Moneen Road,
Castlebar,
County Mayo
F23 XR63
Irlanda
Este medicamento está autorizado para comercialização nos estados-membros da Área Econômica Europeia e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
Áustria, Bélgica, Bulgária, Croácia, Chipre, República Tcheca, Dinamarca, Estônia, Finlândia, França, Alemanha, Grécia, Islândia, Irlanda, Letônia, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polônia, Portugal, Eslováquia, Eslovênia, Espanha, Suécia, Reino Unido (Irlanda do Norte): Hemosol B0.
Data da última atualização do folheto: setembro de 2024
Informações destinadas apenas ao pessoal médico qualificado
Hemosol B0 solução para hemodiálise/hemofiltragem
Precauções
Deve seguir estritamente as instruções de uso/manuseio do medicamento Hemosol B0.
As soluções das duas câmaras devemser misturadas antes do uso.
O uso de uma solução contaminada para hemofiltragem pode causar sepse, choque e morte do paciente.
Para aumentar o confort do paciente, o Hemosol B0 pode ser aquecido a 37°C. O aquecimento da solução antes do uso deve ser feito antes da reconstituição e apenas com uma fonte de calor seca. As soluções não devem ser aquecidas em banho-maria ou forno de micro-ondas. Se a solução e a embalagem permitirem, antes da administração, deve-se verificar visualmente a solução para detectar a presença de partículas sólidas e alterações da cor. Não administrar se a solução não for transparente ou se o saco estiver danificado.
A adição de bicarbonato de sódio (ou outra substância tampão) pode aumentar o risco de alcalose metabólica.
Antes e durante o tratamento, deve-se controlar estritamente o equilíbrio eletrolítico e o equilíbrio ácido-base. Como o Hemosol B0 não contém potássio, o nível de potássio no soro deve ser monitorado antes e durante a hemofiltragem e (ou) hemodiálise.
Pode ser necessário suplementar potássio.
Até 1,2 mmol/l de fosfatos podem ser adicionados à solução. Se o fosfato de potássio for adicionado, a concentração total de potássio não deve exceder 4 mEq/l (4 mmol/l).
O volume e a velocidade com que o medicamento Hemosol B0 é usado dependem da concentração de eletrólitos no sangue, do equilíbrio ácido-base e do estado clínico geral do paciente.
A forma de administração (dose, velocidade de infusão e volume total) do medicamento Hemosol B0 deve ser determinada pelo médico.
A hemofiltragem contínua remove o excesso de líquido e eletrólitos.
Se ocorrer um distúrbio do equilíbrio de líquidos, deve-se monitorar estritamente o estado clínico do paciente e, se necessário, corrigir o equilíbrio de líquidos.
Se o paciente tiver insuficiência renal, a superdose pode causar sobrecarga de líquidos e consequências graves, como insuficiência cardíaca congestiva, distúrbios do equilíbrio eletrolítico ou ácido-base.
Como a solução não contém glicose, a administração pode causar hipoglicemia.
Deve-se monitorar regularmente a glicemia.
O Hemosol B0 contém bicarbonato (carbonato) e lactato (precursores de bicarbonato) que podem afetar o equilíbrio ácido-base do paciente. Se, durante o tratamento com a solução, ocorrer ou piorar a alcalose metabólica, pode ser necessário diminuir a velocidade de administração ou interromper a administração do medicamento.
Posologia
A velocidade de fluxo comumente usada da solução de substituição na hemofiltragem e hemodiafiltragem é:
Adultos:
500-3000 ml/hora.
A velocidade de fluxo comumente usada da solução dialítica (dializato) na hemodiálise contínua é:
Adultos:
500-2500 ml/hora.
Em adultos, a velocidade de fluxo total comumente usada é de aproximadamente 2000 a 2500 ml/hora, o que corresponde a um volume diário de líquido de aproximadamente 48 a 60 litros.
Crianças e adolescentes
O intervalo de velocidade de fluxo da solução de substituição na hemofiltragem e hemodiafiltragem e da solução dialítica (dializato) na hemodiálise contínua é:
Crianças (desde recém-nascidos até adolescentes até 18 anos): 1000-2000 ml/hora/1,73 m2.
As velocidades de fluxo necessárias podem ser de até 4000 ml/hora/1,73 m2, especialmente em crianças mais jovens (≤10 kg). A velocidade de fluxo absoluta (em ml/hora) em crianças e adolescentes geralmente não deve exceder a velocidade de fluxo máxima usada em adultos.
Modo de usar
Para obter a solução pronta para uso, a solução eletrolítica (pequena câmara A) deve ser adicionada à solução tampão (grande câmara B) após quebrar a tampa quebradiça, imediatamente antes do uso.
Use apenas com o equipamento apropriado para o tratamento renal extracorpóreo.
Durante o procedimento e a administração do medicamento ao paciente, use técnica asséptica.
Use apenas quando a embalagem externa de proteção estiver intacta, todos os selos estiverem intactos, a tampa quebradiça estiver intacta e a solução for transparente. Aperte firmemente o saco para verificar sua estanqueidade. Se um vazamento for detectado, a solução deve ser descartada imediatamente, pois não é possível garantir a esterilidade.
A grande câmara B tem um porto de injeção que, após a reconstituição da solução, permite a adição de outros medicamentos necessários. O médico é responsável por avaliar a compatibilidade do medicamento adicional com o Hemosol B0, verificando se ocorrem alterações de cor e (ou) precipitação, formação de complexos ou cristais insolúveis. Antes de adicionar o medicamento, verifique se ele é solúvel e estável em água com um pH igual ao pH do Hemosol B0 (pH da solução pronta para uso: 7,0 a 8,5). Os componentes adicionais podem não ser compatíveis com a solução. Deve-se consultar as instruções de uso do medicamento adicionado.
Remova o líquido do porto de injeção, segure o saco com a parte inferior para cima, administre o medicamento no porto de injeção e misture completamente. Inicie a administração da solução imediatamente.
A introdução e mistura de componentes adicionais devem ser sempre realizadas antes de conectar o saco com a solução ao circuito extracorpóreo.
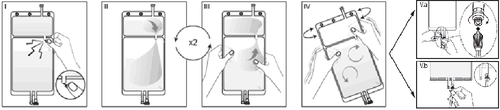
I
Retire a embalagem externa do saco e descarte todos os materiais de embalagem restantes. Abra a proteção, quebrando a tampa quebradiça localizada entre as duas câmaras do saco. A tampa quebradiça permanecerá no saco.
II
Certifique-se de que todo o líquido da pequena câmara A foi transferido para a grande câmara B.
III
Enxágue duas vezesa pequena câmara A, espremendo a solução misturada de volta para a pequena câmara A e, em seguida, novamente para a grande câmara B.
IV
Se a pequena câmara A estiver vazia: agite a grande câmara B para misturar completamente seu conteúdo. Agora a solução está pronta para uso e o saco pode ser pendurado no suporte.
V
Cada um dos dois portos de acesso pode ser conectado à linha de diálise ou troca.
V.a
Se estiver usando um acesso do tipo luer, remova a tampa, girando-a e puxando-a, e, em seguida, conecte a extremidade macho do tipo luer lock da linha de diálise ou troca à extremidade fêmea do tipo luer receptor no saco, empurrando-a e girando-a. Certifique-se de que a conexão esteja completamente encaixada e segura. Agora a conexão está aberta. Verifique se o líquido flui livremente.
Quando as linhas de diálise ou troca são desconectadas do conector do tipo luer, a conexão será fechada e o fluxo de líquido será interrompido. O porto do tipo luer é sem agulha e pode ser limpo com desinfetantes.
V.b
Se estiver usando um porto de injeção, primeiro remova a tampa quebrando-a. O porto de injeção pode ser limpo com desinfetantes. Em seguida, perfure a vedação de borracha com uma agulha. Verifique se o líquido flui livremente.
A solução pronta para uso deve ser usada imediatamente após a remoção da embalagem externa.
Se a solução pronta para uso não for usada imediatamente, deve ser usada dentro de 24 horas, incluindo o tempo de tratamento, após a adição da solução eletrolítica à solução tampão.
A solução pronta para uso é destinada apenas a um uso único. O medicamento não utilizado deve ser descartado imediatamente após a administração.
Todos os resíduos do medicamento ou seus dejetos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Requer receita médicaNão
- ImportadorBieffe Medital S.p.A. Vantive Manufacturing Limited
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Médicos online para Hemosol Bo
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Hemosol Bo – sujeita a avaliação médica e regras locais.














