
OSMOHALE POLVO PARA INHALACION (CAPSULAS DURAS)

Cómo usar OSMOHALE POLVO PARA INHALACION (CAPSULAS DURAS)
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Osmohale polvo para inhalación (cápsulas duras)
manitol
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico , incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Osmohale y para qué se utiliza
- Qué necesita saber antes de empezar a tomar Osmohale
- Cómo tomar Osmohale
- Posibles efectos adversos
- Conservación de Osmohale
- Contenido del envase e información adicional
1. Qué es Osmohale y para qué se utiliza
Osmohale es una pruebapara comprobar si usted tiene sensibilidad en las vías respiratorias o no.
Osmohale contiene el principio activo manitol.
La sensibilidad en las vías respiratorias puede ser provocada por una inflamación de éstas, lo que a veces dificulta la respiración. Las personas con sensibilidad en las vías respiratorias a menudo son muy susceptibles a factores ambientales tales como el ejercicio, el polvo, el humo y otros factores irritantes.
Su médico u otro profesional sanitario específicamente capacitado le pedirá que respire en Osmohale, utilizando un pequeño inhalador.
- En las personas que efectivamentetienen sensibilidad en las vías respiratorias, éstas se estrecharán, y posiblemente les resulte más difícil respirar.
- Las personas que notienen sensibilidad en las vías respiratoriasno experimentarán tal estrechamiento de éstas al respirar en Osmohale, y podrán continuar respirando normalmente.
Como parte de la prueba, se le pedirá que sople en un tubo que medirá el efecto de Osmohale en sus pulmones.
Este medicamento se utiliza exclusivamente para comprobar si usted tiene sensibilidad en las vías respiratorias.
2. Qué necesita saber antes de empezar a tomar Osmohale
No tome Osmohale
- si es alérgico(hipersensible) al manitol o a cualquiera de los demás componentes;
- si su capacidad pulmonarestá gravemente reducida(esto se medirá antes de la prueba);
- si actualmente tiene o ha tenido un vaso sanguíneo distendido o debilitado alrededor del corazón o el cerebro (aneurisma);
- si tiene hipertensiónque no está controlada con medicación;
- si ha tenido un infarto de miocardioen los últimos 6 meses;
- si ha tenido un accidente cerebrovascularen los últimos 6 meses.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Osmohale.
- si su capacidad pulmonares reducida(esto se medirá antes de la prueba);
- si anteriormente ha experimentado dificultad para respirar,o ha tenido respiración sibilanteo tosdurante una espirometría (estudio donde se sopla dentro de un instrumento de medición);
- si tose con sangre;
- si tiene aire en el espacio pleural entre la pared torácica y los pulmones, lo que provoca dolor en el pecho y falta de aire (neumotórax);
- si recientemente ha sido sometido a cirugía ocular, de estómagoo de tórax;
- si experimenta dolor en el pecho (angina de pecho);
- si tiene problemas para llevar a cabo la espirometría(la persona que la hace se lo informará);
- si ha tenido una infecciónen las vías respiratoriasen las últimas 2 semanas.
Si sufre falta de aire, respiración sibilante y/o tos durante la espirometría, es posible que se le administre un medicamento para mantener abiertas sus vías respiratorias, y se detendrá la prueba.
No haga ejercicios vigorososel día de la prueba, especialmente antes de llevarla a cabo, ya que podría afectar los resultados.
No fumedurante al menos 6 horas antes de la prueba, ya que podría afectar los resultados.
No tome Osmohale por cuenta propia. Osmohale sólo debe ser administrado en una clínica o laboratorio adecuado, por profesionales capacitados y familiarizados con el uso de pruebas similares y sus posibles efectos, bajo la supervisión de un médico experimentado.
Niños y adolescentes
No debe administrarse Osmohale ni realizarse la prueba en niños menores de 6 años.
No se recomienda Osmohale en pacientes de 6 a 18 años de edad, debido a la limitada información disponible sobre el uso del medicamento en esta población.
Otros medicamentos y Osmohale
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Si está utilizando otros medicamentos para el tratamiento del asma o alergias, es posible que deba suspenderlos antes de la prueba. Estos medicamentos pueden afectar la reacción de su organismo ante Osmohale. Su médico le indicará qué medicamento(s) debe suspender, y por cuánto tiempo (en general entre 6 horas y 4 días antes de la prueba).
Uso de Osmohale con alimentos y bebidas
El día de la prueba no beba café, té ni bebidas cola, ni coma chocolate u otros alimentos que contienen cafeína.
Embarazo, lactancia y fertilidad
No se someta a la prueba con Osmohale si está embarazada.
Puede utilizar Osmohale durante la lactancia.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
No se ha observado ningún efecto.
3. Cómo tomar osmohale
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Adultos
Un médico u otro profesional sanitario especialmente capacitado le administrará Osmohale mediante un inhalador y le acompañará durante el desarrollo de la prueba. No se le dejará solo.
No debe introducirse las cápsulas de Osmohale en la boca ni tragarlas.
Realización de la prueba
- Se le pedirá que se siente cómodamente en una silla.
- Inicialmente se le pedirá que sople con fuerza en un tubo (espirometría).
- A continuación se le colocará una pinza nasal, de modo que sólo pueda inspirar y exhalar por la boca.
- Tras exhalar todo el aire, se le pedirá que inspire profundamente el medicamento Osmohale, utilizando un inhalador especial.
- Se le indicará entonces que retenga la respiración durante cinco segundos antes de exhalar.
- Se le quitará la pinza nasal, y se le pedirá que respire normalmente.
- A continuación se le pedirá que vuelva a soplar con fuerza en el tubo. Esta prueba mide el efecto de Osmohale en sus pulmones.
- Los pasos 3 a 7 pueden repetirse un máximo de 9 veces, con más Osmohale dependiendo del efecto sobre sus pulmones (según lo medido en el paso 7), hasta finalizar la prueba.
- Una vez finalizado el estudio, es posible que se le administre algún medicamento para ayudarle a respirar.
Si no está seguro con respecto a cualquier parte de la prueba, o tiene alguna consulta sobre el medicamento, hable con el médico o profesional sanitario especialmente capacitado que lleve a cabo la prueba.
Si toma más Osmohale del que debe
Si piensa que tal vez se le haya administrado una cantidad excesiva del medicamento, infórmeselo de inmediato al médico o profesional sanitario que está realizando la prueba. Si ha tomado demasiado Osmohale puede sentir que no puede respirar, experimentar respiración sibilante o tos. El médico puede administrarle oxígeno o medicamentos para ayudarle a respirar.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Lista de efectos adversos
Frecuentes(pueden afectar a 1 de cada 10 personas):
- Asma
- Falta de aire
- Opresión en el pecho
- Tos
- Deseos de vomitar
- Cefalea
- Dolor de nariz y de garganta, molestias al tragar
- Goteo nasal
- Vómitos
Poco Frecuentes(pueden afectar a 1 de cada 100 personas):
- Extremidades frías
- Diarrea
- Sensación de mareo
- Sensación de nerviosismo
- Sensación de sed
- Sensación de cansancio
- Eritema y sudoración
- Ronquera
- Picor y erupción cutánea
- Prurito en los ojos
- Reducción de oxígeno en sangre
- Llagas en la boca
- Epistaxis (sangrado por la nariz)
- Dolor estomacal
- Dolor muscular y articular
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso
si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el
Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Osmohale
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto Sigre de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Osmohale
El principio activo es manitol.
Las cápsulas que son utilizadas para inhalación contienen polvo de manitol . Una cápsula contiene 0 mg, 5 mg, 10 mg, 20 mg o 40 mg de manitol.
Aspecto del producto y contenido del envase
El polvo es blanco o casi blanco.
La cápsula vacía es transparente con dos bandas blancas impresas
La cápsula de 5 mg es mitad blanca y mitad transparente, con la inscripción 5 mg.
La cápsula de 10 mg es mitad amarilla y mitad transparente, con la inscripción 10 mg.
La cápsula de 20 mg es mitad rosa y mitad transparente, con la inscripción 20 mg.
Las cápsulas de 40 mg son mitad rojas y mitad transparentes, con la inscripción 40 mg.
Las cápsulas se presentan en blísters. Un equipo para diagnóstico, embalado en una caja, consta de:
- 1 cápsula vacía
- 1 cápsula de 5 mg
- 1 cápsula de 10 mg
- 1 cápsula de 20 mg
- 15 cápsulas de 40 mg
- 1 inhalador
Titular de la autorización de comercialización
Pharmaxis Europe Limited
108 Q House Furze Road,
Sandyford, Dublin 18,
D18AY29, Irlanda
Responsable de la fabricación
MIAS Pharma Limited
Suite 1 Stafford House
Strand Road, Portmarnock
Co. Dublin, D13 WC83
Irlanda
Arvato Supply Chain Solutions SE
Gottlieb-Daimler Straβe 1
33428 Harsewinkel
North Rhine-Westphalia
Alemania
Si tiene alguna consulta sobre este medicamento, diríjase al representante local del titular de la autorización de comercialización:
Laboratorio Aldo-Unión, S.L.
Baronesa de Maldá, 73
08950 Esplugues de LL.
Barcelona
España
Tel: +34 93 372 71 11
Fax: +34 93 371 61 98
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Aridol: Finlandia, Alemania, Noruega, Suecia
Osmohale: Dinamarca, Irlanda, Países Bajos, España, Reino Unido (Irlanda del Norte)
Fecha de la última revisión de este prospecto:06/2022
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
INFORMACIÓN PARA MÉDICOS O PROFESIONALES SANITARIOS
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
Contraindicaciones
Hipersensibilidad conocida al manitol o a cualquiera de los componentes de la cápsula.
No debe administrarse Osmohale a pacientes con limitación respiratoria severa (FEV1 esperado < 50% o < 1,0 l), o afecciones que puedan verse comprometidas por la inducción de broncoespasmos o la repetición de maniobras de soplado. Entre éstas se incluyen: aneurisma cerebral o aórtico, hipertensión no controlada, infarto de miocardio o un accidente cerebrovascular en los seis meses anteriores.
Advertencias y precauciones especiales de empleo
Osmohale debe administrarse exclusivamente por inhalación. La inhalación de manitol provoca broncoconstricción. La prueba de inhalación de Osmohale sólo debe ser realizada en clínicas o laboratorios adecuados, por un médico u otro profesional sanitario debidamente capacitado para realizar pruebas de provocación bronquial y para manejar broncoespasmos agudos, y bajo la supervisión de un médico experimentado. El médico responsable, con la debida capacitación para tratar broncoespasmos agudos, lo que incluye el uso apropiado del equipo de reanimación, deberá estar lo suficientemente cerca como para responder rápidamente ante una emergencia. Se deberá contar con estetoscopio, esfigmomanómetro y oxímetro de pulso. Una vez comenzada la administración de Osmohale, no debe dejarse al paciente sin supervisión durante el procedimiento.
En el área de realización de la prueba deberá contarse con medicamentos para el tratamiento de broncoespasmos graves. Entre ellos se incluyen adrenalina para inyección subcutánea, y salbutamol u otros agonistas beta en inhaladores con dosis graduadas. Deberá contarse con oxígeno. Deberá tenerse a disposición un nebulizador de pequeño volumen para la administración de broncodilatadores.
Se deben observar las precauciones generales para la realización de espirometrías y pruebas de provocación bronquial, incluidas precauciones adicionales en pacientes con las siguientes condiciones: insuficiencia respiratoria (FEV1 basal inferior al 70% de los valores normales esperados o un valor absoluto de 1,5 l o menos en adultos), broncoconstricción inducida por espirometría, hemoptisis de origen desconocido, neumotórax, cirugía abdominal o torácica reciente, cirugía intraocular reciente, angina inestable, incapacidad de llevar a cabo una espirometría de calidad aceptable o infección del tracto respiratorio inferior o superior en las 2 semanas previas.
Si el paciente presenta asma inducida por la espirometría, o la caída del FEV1 es superior al 10% ante la administración continua tras la cápsula de 0 mg, se deberá aplicar una dosis estándar de broncodilatador y se suspenderá la provocación con Osmohale.
Ejercicios: El ejercicio físico vigoroso deberá evitarse por completo el día de la prueba, ya que puede afectar los resultados.
Fumar: Como fumar puede afectar los resultados de la prueba, se recomienda que los pacientes se abstengan de hacerlo durante un mínimo de 6 horas previas al estudio.
La prueba de Osmohale no debe utilizarse en pacientes menores de 6 años de edad, debido a su incapacidad para proporcionar mediciones espirométricas reproducibles.
La información sobre el uso de Osmohale en pacientes de 6 a 18 años de edad es limitada; en consecuencia no se recomienda el uso de Osmohale en esta población.
No se han investigado los efectos de la repetición de pruebas con Osmohale en un periodo breve; en consecuencia, se debe prestar especial consideración al uso repetido de Osmohale.
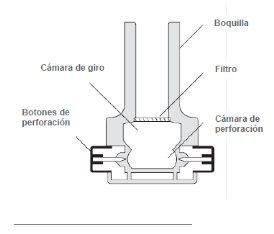
Instrucciones para el dispositivo inhalador
Estas instrucciones muestran cómo utilizar el inhalador
- Retirada de la tapa: Con ambas manos, sostenga el inhalador en posición vertical y retire la tapa.

- Apertura: Sostenga firmemente la base del inhalador con una mano, y abra el dispositivo girando la boquilla en la dirección de la flecha, tal como muestra la imagen.

- Carga: Asegúrese de tener las manos secas; retire una cápsula de la caja del inhalador y colóquela en el inhalador como muestra la ilustración.
No tiene importancia de qué lado se inserta la cápsula en la cámara.

- Cierre: Manteniendo el dispositivo en posición vertical, gire la boquilla a la posición de cierre, hasta que oiga un “clic”.

- Perforación de la cápsula: Mantenga el inhalador en posición vertical y presione simultáneamente a fondo los dos botones de perforación ubicados a los costados del dispositivo.
Hágalo una sola vez, ya que perforar la cápsula más de una vez podría provocar que se rompa o fragmente. La perforación abre orificios en la cápsula, y permite que salga el polvo durante la inhalación.

- Preparación para la inhalación: Incline el inhalador de modo que la boquilla quede ligeramente hacia abajo en un ángulo de 45 grados, tal como muestra la figura siguiente, hasta que la cápsula caiga dentro de la cámara giratoria. Mantenga el dispositivo inclinado de esta forma e indique al paciente que exhale completamente (fuera del inhalador).

- Inhalación: El paciente debe inclinar ligeramente la cabeza hacia atrás, y sosteniendo el inhalador a 45 grados, llevarlo a la boca y ajustar los labios a la boquilla. Indique al paciente que inspire rápida y profundamente para llenar los pulmones. A continuación el paciente deberá contener la respiración por cinco segundos.

Nota: Durante una inhalación correcta se deberá oír un sonido de “cascabel”, a medida que la cápsula gira dentro del inhalador.
- Exhalación: Retire el inhalador de la boca del paciente, y deje que exhale y retome la respiración normal.

- Verificación: Para vaciarse, la cápsula de Osmohale debe girar dentro del inhalador. Si tras la inhalación la cápsula no se ha vaciado, es posible que se requiera una segunda inhalación (con la misma cápsula). Verifique la cápsula tras cada inhalación.

Tenga en cuenta:
El inhalador está diseñado para UN SOLO USO (un dispositivo para cada prueba de provocación), y no debe limpiarse durante la realización de la prueba.
Deseche el inhalador tras cada provocación con Osmohale. El inhalador no debe ser esterilizado ni reutilizado, ya que podría comprometerse la integridad de los siguientes resultados de la prueba.
……………………………………………………………………………………………………..
LEA EL RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO COMPLETO ANTES DE REALIZAR ESTA PRUEBA DE PROVOCACIÓN.
Para obtener más información comuníquese con:
Titular de la autorización de comercialización:
Pharmaxis Europe Limited
108 Q House Furze Road,
Sandyford, Dublin 18,
D18AY29, Irlanda
Representante local:
Laboratorio Aldo-Unión, S.L.
Baronesa de Maldá, 73
08950 Esplugues de LL.
Barcelona
España
Tel: +34 93 372 71 11
Fax: +34 93 371 61 98
……………………………………………………………………………………………………..
{Logo}
Instrucciones para la prueba de provocación Osmohale
……………………………………………………………………………………………………..
Prueba de provocación Osmohale
Inhalador

Resultados de la prueba de provocación
Resultado positivo de la prueba de provocación con Osmohale
La respuesta positiva con Osmohale se obtiene de 2 formas:
una caída ≥ 15% del FEV1 con respecto al valor basal (usando el valor del FEV1 tras la administración de 0 mg como comparador)
una caída incremental ≥ 10% del FEV1 (entre dosis consecutivas de Osmohale)
Resultado negativo de la prueba de provocación conOsmohale
Se considera que la prueba de provocación con Osmohale da resultado negativo cuando se ha administrado al paciente una dosis acumulativa de 635 mg de Osmohale y su FEV1 no disminuye en un porcentaje ≥ 15% con respecto al valor basal.
Equipo
Equipo de Osmohale(contiene las cápsulas de Osmohale, el inhalador y el prospecto con instrucciones)
Espirómetro y boquilla
Pinza nasal
Temporizador(que pueda configurarse en 60 segundos)
Calculadora
Broncodilatador(por ejemplo salbutamol)
Deberá contarse con disponibilidad de oxígeno y demás equipos de emergencia pertinentes, conforme a los protocolos estándar para pruebas de provocación bronquial.
Puntos importantes para tener en cuenta
- El inhalador es para UN SOLO USO (un dispositivo para cada prueba de provocación), y no debe limpiarse durante la realización de la prueba. Deseche el inhalador tras cada provocación con Osmohale. El inhalador no debe ser esterilizado ni reutilizado, ya que podría comprometerse la integridad de los siguientes resultados de la prueba.
- Cuando el paciente exhala durante la prueba de provocación con Osmohale, asegúrese de que lo haga LEJOS del inhalador, para minimizar la humedad dentro del dispositivo.
- Al perforar la cápsula hágalo sólo una vez (presionando totalmente ambos botones en forma simultánea), ya que una nueva perforación podría provocar la rotura o fragmentación de la cápsula.
- El uso de guantes de goma durante la administración de la prueba y la manipulación de las cápsulas de Osmohale puede aumentar la estática e inhibir el movimiento de las cápsulas dentro del inhalador.
- Si supone que hay un problema de estática, o advierte que no se oye el ruido de la cápsula durante la inhalación de Osmohale, dé un golpe firme sobre la base del inhalador con una mano mientas sostiene el inhalador con la otra (con la boquilla orientada hacia abajo en un ángulo de 45°). Esto garantizará que la cápsula se "desencaje" de la cámara de perforación e ingrese a la cámara de giro.

- La inhalación de Osmohale puede provocar tos y/o sequedad de garganta. Se trata de un efecto adverso de rutina de la prueba de provocación bronquial.
Puede ofrecerle un vaso de agua al paciente al completar la prueba.
- En esta prueba de provocación el tiempo es crucial, y requiere que se establezca y mantenga un gradiente osmótico. Los intervalos prolongados entre las dosis pueden afectar la validez de los resultados, y debe evitárselos.
……………………………………………………………………………………………………..
Directrices para el procedimiento
PASO 1:Verifique que el paciente haya suspendido los siguientes medicamentos (Véase la tabla siguiente).
Plazos recomendados para la suspensión de medicamentos.
La falta de suspensión de los medicamentos puede afectar los resultados de la prueba de provocación con Osmohale.
Los períodos recomendados para la suspensión de los medicamentos generalmente se basan en la duración de su acción.
Tiempo de suspensión | Medicamento |
6-8 horas | AGENTES ANTIINFLAMATORIOS NO ESTEROIDES INHALADOS por ejemplo cromoglicato de sodio, nedocromil sódico |
8 horas | AGONISTAS BETA2 DE ACCIÓN RÁPIDA, por ejemplo salbutamol, terbutalina |
12 horas | CORTICOSTEROIDES INHALADOS, por ejemplo beclometasona, budesonida, fluticasona |
12 horas | BROMURO DE IPRATROPIO |
24 horas | CORTICOSTEROIDES INHALADOS MÁS AGONISTAS BETA2 DE EFECTO PROLONGADO por ejemplo fluticasona y salmeterol, budesonida y eformoterol |
24 horas | AGONISTAS BETA2 DE EFECTO PROLONGADO por ejemplo salmeterol, formoterol |
24 horas | TEOFILINA |
72 horas | BROMURO DE TIOTROPIO |
72 horas | ANTIHISTAMÍNICOS por ejemplo cetirizina, fexofenadina, loratadina |
4 días | ANTAGONISTAS DE LOS RECEPTORES DE LEUCOTRIENOS por ejemplo montelukast |
Alimentos:La ingesta de cantidades significativas de café, té, bebidas cola, chocolate u otros alimentos que contienen cafeína puede disminuir la reactividad bronquial, y se los deberá evitar por completo el día del estudio.
Otros factores que pueden afectar los resultados:El día de la prueba no se deberá fumar ni hacer ejercicios físicos vigorosos, ya que puede afectar los resultados.
PASO 2:Para la prueba el paciente deberá estar sentado. Explique el procedimiento; incluya los requisitos para una maniobra de CVF y la medición del FEV1, y el tipo de flujo inspiratorio requerido para el inhalador. Haga una demostración si se requiere.
PASO 3:Ingrese los datos del paciente en el espirómetro (edad, altura, raza, fecha de nacimiento, sexo, etc.).
PASO 4:Determine el FEV1antes de la prueba de provocación. Pida al paciente que ejecute una maniobra de CVF según las directrices de la ATS/ERS, ejecute tres maniobras aceptables, de las cuales se reproduzcan dos. Utilice el valor más alto como FEV1 previo a la prueba. El FEV1 del paciente debe ser ≥ 70% del valor esperado.
Se deben extremar precauciones con los pacientes con un FEV1 de menos del 70% del valor esperado.
PASO 5:Calcule el FEV1basal (0 mg)
- Retire la cápsula de 0 mg de Osmohale del blíster, abra el inhalador (girando como indica la flecha en el dispositivo), inserte la cápsula y cierre el dispositivo.
- Perfore la cápsula una sola vez, presionando los botones de color a ambos lados del inhalador.
- Pídale al paciente que se coloque la pinza nasal y respire por la boca.
- Incline el inhalador a 45° (con la boquilla hacia abajo). Verifique que la cápsula haya pasado de la cámara de perforación a la cámara de giro, más cercana a la boquilla.
A menudo se puede oír cómo la cápsula cae hacia adelante, o verla a través de los orificios a ambos lados del dispositivo. Entregue el inhalador al paciente, asegurándose de que lo mantenga en el mismo ángulo.
- Verifique que el paciente esté sentado en posición erguida. Pídale al paciente que exhale (fuera del inhalador), que ajuste los labios alrededor de la boquilla del inhalador y que tome una inspiración rápida y profunda hasta llenar los pulmones. Durante una inhalación correcta se deberá oír un sonido de “cascabel”, a medida que la cápsula gira dentro del dispositivo.
- Al final de la inhalación del paciente, inicie un temporizador de 60 segundos y pídale al paciente que contenga la respiración durante 5 segundos. Una vez transcurridos los 5 segundos, indique al paciente que exhale por la boca (lejos del inhalador), se quite la pinza nasal y respire normalmente.
- Cuando suene el temporizador a los 60 segundos, indique al paciente de inmediato que ejecute dos mediciones aceptables de FEV1. Estas mediciones deberán estar dentro de una variabilidad de 0.15 l (150 ml). Si la variabilidad entre las lecturas es superior a 0.15 l, indique al paciente que ejecute otra medición del FEV1. Registre la lectura más alta como el valor basal de FEV1. Si el valor más alto del FEV1 es ≥ 10% inferior al FEV1 anterior a la prueba de provocación, no continúe con ella.
- Calcule el FEV1 objetivo
Se obtiene un resultado positivo para la prueba de provocación con Osmohale cuando el FEV1 del paciente cae ≥ 15% con respecto al valor basal. Para calcular el FEV1 objetivo, multiplique el valor basal (la mayor lectura obtenida con 0 mg) obtenido anteriormente por 0,85. Registre este valor.
PASO 6:Cápsula de 5 mg
- Inserte la cápsula de 5 mg en el inhalador y perfórela como se indica en el Paso 5.
- Repita los pasos 5c – f precedentes.
- Tras la inhalación, retire la cápsula del inhalador y verifique que se haya vaciado por completo; en caso contrario, deberá hacerse una segunda inhalación de inmediato.
- Cargue la cápsula de 10 mg como preparación para la siguiente dosis.
- A los 60 segundos de la inhalación, de inmediato mida dos veces el FEV1 del paciente (se deberán satisfacer los criterios de aceptabilidad). Utilice el mayor de estos dos valores para calcular la variación del FEV1.
- Compare el valor del FEV1 con esta dosis con respecto al FEV1 objetivo. Si el valor del FEV1 es inferior o igual al valor objetivo, o si se ha producido una caída incremental ≥ 10% desde la dosis anterior, la prueba de provocación es positiva y está completa. Si no lo es, continúe de inmediato con la siguiente etapa de dosificación.
PASO 7:Cápsulas de 10 mg, 20 mg, 40 mg
Administre las dosis de 10 mg, 20 mg y 40 mg conforme a las instrucciones precedentes (en el paso 6) para la dosis de 5 mg.
PASO 8:Dosis de 80 mg (2 cápsulas de 40 mg)
- Inserte y perfore la primera cápsula de 40 mg que conforma la dosis de 80 mg.
- El paciente deberá inhalar la dosis de la misma forma que las anteriores, contener la respiración durante 5 segundos y exhalar.
- Retire la primera cápsula de 40 mg del dispositivo y verifique que se haya vaciado por completo; en caso contrario, deberá hacerse una segunda inhalación de inmediato. Haga esto tras la administración de cada una de las cápsulas.
- Tras la inhalación, cargue la segunda cápsula de 40 mg y ofrézcala al paciente de inmediato tras la exhalación.
- Indique al paciente que inhale la segunda cápsula de inmediato, para garantizar que el efecto osmótico de Osmohale sea acumulativo.
- Active el temporizador al final de la inhalación de la segunda cápsula.
- Indique al paciente que contenga la respiración durante 5 segundos antes de exhalar.
- A los 60 segundos de la inhalación de la segunda cápsula, de inmediato mida dos veces el FEV1 del paciente (se deberán satisfacer los criterios de aceptabilidad). Utilice el mayor de estos dos valores para calcular la variación del FEV1.
- Compare el valor del FEV1 con esta dosis con respecto al FEV1 objetivo. Si el valor del FEV1 es inferior o igual al valor objetivo, o si se ha producido una caída incremental ≥ 10%, la prueba de provocación es positiva y está completa. Si no lo es, continúe de inmediato con la siguiente etapa de dosificación.
PASO 9:Primera dosis de 160 mg (4cápsulas de 40 mg)
- Inserte y perfore la primera cápsula de 40 mg que conforma la dosis de 160 mg.
- El paciente deberá inhalar la dosis de la misma forma que las anteriores, contener la respiración durante 5 segundos y exhalar.
- Retire la cápsula del dispositivo y verifique que se haya vaciado por completo; en caso contrario, deberá hacerse una segunda inhalación de inmediato. Haga esto tras la administración de cada una de las cápsulas.
- Tras la inhalación, cargue la segunda cápsula de 40 mg y ofrézcala al paciente de inmediato tras la exhalación.
- El paciente deberá inhalar el contenido de la segunda cápsula, contener la respiración durante
5 segundos y exhalar.
- Tras la inhalación, cargue la tercera cápsula de 40 mg y ofrézcala al paciente de inmediato tras la exhalación.
- El paciente deberá inhalar el contenido de la tercera cápsula, contener la respiración durante 5 segundos y exhalar.
- Tras la inhalación, cargue la cuarta cápsula de 40 mg y ofrézcala al paciente de inmediato tras la exhalación.
- Indique al paciente que inhale la cuarta cápsula de inmediato, para garantizar que el efecto osmótico de Osmohale sea acumulativo.
- Active el temporizador al final de la inhalación de la cuarta cápsula.
- Indique al paciente que contenga la respiración durante 5 segundos antes de exhalar.
- A los 60 segundos de la inhalación de la cuarta cápsula, de inmediato mida dos veces el FEV1 del paciente (se deberán satisfacer los criterios de aceptabilidad). Utilice el mayor de estos dos valores para calcular la variación del FEV1.
- Compare el valor del FEV1 con esta dosis con respecto al FEV1 objetivo. Si el valor del FEV1 es inferior o igual al valor objetivo, o si se ha producido una caída incremental ≥ 10% desde la dosis anterior, la prueba de provocación es positiva y está completa. Si no lo es, continúe de inmediato con la siguiente etapa de dosificación.
PASO 10:Segunda dosis de 160 mg (4 cápsulas de 40 mg)
Administre la segunda dosis de 160 mg conforme a las instrucciones del paso 9 precedente.
PASO 11:Tercera dosis de 160 mg (4 cápsulas de 40 mg)
Administre la tercera dosis de 160 mg conforme a las instrucciones del paso 9 precedente.
Al finalizar esta dosis, se habrán administrado 635 mg. Si no se ha obtenido una respuesta positiva, la prueba de provocación deberá considerarse completa y con resultado negativo.
PASO 12:Tras la finalización de la prueba de provocación deberá administrar un broncodilatador al paciente, y controlarlo durante 15 minutos para garantizar que su FEV1 haya regresado a un valor comprendido en el 5% del nivel anterior a la prueba. (En caso de resultado negativo la administración del broncodilatador es optativa).
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a OSMOHALE POLVO PARA INHALACION (CAPSULAS DURAS)Forma farmacéutica: INYECTABLE, 25 mg edrofonio bromuro/2 mlPrincipio activo: edrophoniumFabricante: Mana Pharma S.L.Requiere recetaForma farmacéutica: INHALACIÓN PULMONAR, 0.3%/0.3%/0.3% mol/molPrincipio activo: Other diagnostic agentsFabricante: Sociedad Española De Carburos Metalicos S.A.Requiere recetaForma farmacéutica: INHALACIÓN PULMONAR, 0,28%/9,5% mol/molPrincipio activo: Other diagnostic agentsFabricante: Sociedad Española De Carburos Metalicos S.A.Requiere receta
Médicos online para OSMOHALE POLVO PARA INHALACION (CAPSULAS DURAS)
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de OSMOHALE POLVO PARA INHALACION (CAPSULAS DURAS), sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















