
KINERET 100 mg/0,67 ml solucion inyectable en jeringa precargada

Cómo usar KINERET 100 mg/0,67 ml solucion inyectable en jeringa precargada
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Kineret100mg/0,67ml solución inyectable en jeringa precargada
anakinra
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Kineret y para qué se utiliza
- Qué necesita saber antes de empezar a usar Kineret
- Cómo usar Kineret
- Posibles efectos adversos
- Conservación de Kineret
- Contenido del envase e información adicional
1. Qué es Kineret y para qué se utiliza
Kineret contiene el principio activo anakinra. Es un tipo de citocina (un agente inmunosupresor) que se usa para tratar:
- Artritis reumatoide (AR)
- La COVID‑19 en pacientes que tienen neumonía, necesitan oxígeno suplementario y tienen riesgo de insuficiencia pulmonar
- Síndromes febriles periódicos:
- Síndromes periódicos asociados a criopirina (CAPS)
- Enfermedad inflamatoria multisistémica de inicio neonatal (NOMID)/síndrome articular, cutáneo y neurológico infantil crónico (CINCA)
- Síndrome de Muckle-Wells (MWS)
- Síndrome autoinflamatorio familiar por frío (FCAS)
- Fiebre mediterránea familiar (FMF)
- La enfermedad de Still, incluida la artritis idiopática juvenil sistémica (AIJS) y la enfermedad de Still de inicio en el adulto (ESIA)
Las citocinas son proteínas producidas por nuestro cuerpo que coordinan la comunicación entre las células y ayudan a controlar la actividad celular. En la AR, los CAPS, la FMF, la enfermedad de Still y la neumonía por la COVID‑19, el cuerpo produce una cantidad excesiva de una citocina llamada interleucina‑1. Esto da lugar a efectos nocivos que provocan inflamación y causan los síntomas de la enfermedad. Normalmente, el organismo produce una proteína que bloquea los efectos nocivos de la interleucina‑1. El principio activo de Kineret es anakinra, que actúa de forma similar a la proteína natural que bloquea la interleucina‑1. Anakinra se obtiene por tecnología del ADN recombinante utilizando el microorganismo E.coli.
En AR, Kineret se usa para tratar los signos y síntomas de la enfermedad en adultos (a partir de los 18 años de edad) en combinación con otro medicamento llamado metotrexato. Kineret está destinado a pacientes cuya respuesta a la administración de metotrexato por sí sola no es suficiente para controlar la artritis reumatoide.
En la COVID‑19, Kineret se usa para tratar la hiperinflamación (más fuerte que la inflamación habitual) asociada a la enfermedad en adultos (a partir de los 18 años de edad) que tienen neumonía, necesitan oxígeno suplementario para ayudarles a respirar (flujo bajo o alto de oxígeno) y tienen riesgo de insuficiencia pulmonar.
En los CAPS, Kineret se usa para tratar los signos y síntomas de la inflamación asociada a esta enfermedad, como erupción, dolor en las articulaciones, fiebre, dolor de cabeza y cansancio, tanto en adultos como en niños (a partir de los 8 meses de edad).
En la FMF, Kineret se usa para tratar los signos y síntomas de la inflamación asociada a esta enfermedad, como fiebre recurrente, cansancio, dolor abdominal, dolor en los músculos o las articulaciones y erupción. Kineret se puede utilizar junto con colchicina, cuando corresponda.
En la enfermedad de Still, Kineret se usa para tratar los signos y síntomas de la inflamación asociada a esta enfermedad, como erupción, dolor en las articulaciones y fiebre.
2. Qué necesita saber antes de empezar a usar Kineret
No use Kineret
- si es alérgico a anakinra o a alguno de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a otros productos producidos por tecnología ADN recombinante que empleen el microorganismo E.coli
- si padece neutropenia (nivel bajo en el recuento de los glóbulos blancos) determinada tras un análisis de sangre.
Contacte con su médico inmediatamente
- si le aparece un sarpullido por todo el cuerpo, le falta la respiración, tiene pitidos al respirar, pulso rápido o sudoración después de inyectarse Kineret. Pueden ser los síntomas de que es alérgico a Kineret.
- si alguna vez ha presentado una erupción generalizada atípica o descamación cutánea después de tomar Kineret.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Kineret:
- si tiene antecedentes de infecciones recurrentes o si padece asma, ya que Kineret puede empeorar estas afecciones
- si tiene cáncer. Su médico tendrá que decidir si usted puede recibir Kineret
- si tiene antecedentes de aumento de los niveles de las enzimas hepáticas
- si necesita vacunarse. Usted no debe vacunarse con vacunas vivas mientras esté siendo tratado con Kineret.
Enfermedad de Still
- En raras ocasiones, los pacientes con enfermedad de Still, sobre todo los niños, pueden desarrollar enfermedad pulmonar, también durante el tratamiento con Kineret. El riesgo puede estar aumentado en los pacientes con síndrome de Down (trisomía 21). Los síntomas de enfermedad pulmonar pueden ser, p. ej., falta de respiración al realizar ejercicio ligero, tos matutina y dificultad para respirar. Si desarrolla signos de enfermedad pulmonar, póngase en contacto con su médico lo antes posible.
- Rara vez se ha notificado una reacción cutánea grave, DRESS (reacción medicamentosa con eosinofilia y síntomas sistémicos), asociada al tratamiento con Kineret, sobre todo en pacientes con artritis idiopática juvenil sistémica (AIJS). Solicite atención médica de inmediato si observa una erupción generalizada atípica, que puede aparecer junto con fiebre alta y aumento de tamaño de los ganglios linfáticos.
CAPS
- Se han notificado unos pocos casos de amiloidosis sistémica (una afección en la que unas proteínas anómalas se acumulan en los tejidos y los órganos) en pacientes con NOMID/CINCA, que como primera manifestación presentaron bultos bajo la piel en los lugares de la inyección (depósitos de amiloide). Estos pacientes habían estado usando anakinra en dosis altas durante varios años. Los síntomas de la amiloidosis sistémica pueden incluir hinchazón (especialmente en las piernas y los tobillos), orina espumosa, aumento o disminución en la frecuencia de micción, calambres musculares, pérdida de peso inexplicable, diarrea o estreñimiento y cansancio. Informe a su médico si nota alguno de estos síntomas.
Niños y adolescentes
- AR: El uso de Kineret en niños y adolescentes con artritis reumatoide (AR) no se ha investigado de forma exhaustiva y, por tanto, no puede recomendarse.
- COVID‑19: El uso de Kineret en niños y adolescentes con la COVID‑19 no se ha investigado y, por tanto, no puede recomendarse.
- CAPS, FMF, enfermedad de Still: El uso de Kineret no se recomienda en niños menores de 8 meses, ya que no se dispone de datos para este grupo de edad.
Otros medicamentos y Kineret
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Los medicamentos denominados inhibidores del factor de necrosis tumoral (TNF‑α), como etanercept, no deben utilizarse junto con Kineret ya que esto podría incrementar el riesgo de infecciones.
Cuando comience a usar Kineret, la inflamación crónica de su organismo disminuirá. Esto podría hacer que se deban ajustar las dosis de algunos otros medicamentos, como warfarina o fenitoína.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Kineret no ha sido probado en mujeres embarazadas. No se recomienda el uso de Kineret durante el embarazo ni en las mujeres en edad fértil que no usen un método anticonceptivo. Es importante que informe a su médico si está embarazada, si cree que podría estar embarazada o si tiene intención de quedarse embarazada. Su médico comentará con usted los posibles riesgos de tomar Kineret durante el embarazo.
Se desconoce si anakinra se excreta en la leche materna. Abandone la lactancia materna si está utilizando Kineret.
Kineret contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de 100 mg; esto es, esencialmente "exento de sodio".
3. Cómo usar Kineret
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico. Kineret se inyecta debajo de la piel (inyección subcutánea) diariamente. Debe procurar ponerse la inyección cada día a la misma hora.
La dosis recomendada es de 20 a 90 mg o 100 mg. El médico le indicará la dosis que necesita, o si necesita una dosis mayor de 100 mg.
COVID‑19: la dosis recomendada es de 100 mg inyectados debajo de la piel (subcutáneos) diariamente durante 10 días.
Autoadministración de Kineret
Su médico puede decidir que es más conveniente que se inyecte Kineret usted mismo. Su médico o enfermera le enseñarán cómo hacerlo. No intente inyectarse usted mismo si no le han explicado cómo hacerlo.
Para información sobre cómo inyectarse Kineret usted mismo o inyectárselo a su hijo, por favor lea la sección “Instrucciones para preparar y administrar una inyección de Kineret” incluida al final de este prospecto.
Si usa más Kineret del que debe
No debe tener ningún problema serio si, accidentalmente, usa más Kineret del que necesita. Sin embargo, debe contactar con su médico o farmacéutico si esto ocurriera. Si no se encuentra bien, debe contactar con su médico inmediatamente.
Si olvidó usar Kineret
Si olvidó ponerse una dosis de Kineret, debe contactar con su médico para comentar cuándo debe ponerse la dosis siguiente.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los posibles efectos adversos son similares tanto si se usa Kineret para la AR como para los CAPS, la FMF, la enfermedad de Still o la COVID‑19.
Si se presentan algunos de los siguientes efectos adversos, informe a su médico inmediatamente:
- Infecciones gravestales como neumonía (infección torácica) o infecciones en la piel pueden darse durante el tratamiento con Kineret. Los síntomas pueden ser fiebre alta persistente, temblores, tos, dolor de cabeza y enrojecimiento y dolor en la piel. Otros posibles signos de infección son fiebre de bajo grado, pérdida de peso y tos persistente.
- Las reacciones alérgicas gravesson poco frecuentes. Sin embargo, alguno de los siguientes síntomas puede indicar una reacción alérgica Kineret por la que debería buscar atención médica inmediata. No inyecte más Kineret:
- Hinchazón de la cara, lengua o garganta
- Problemas para tragar o respirar
- Sensación súbita de taquicardia o sudoración
- Picor en la piel o erupción
Efectos adversos muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- Enrojecimiento, hinchazón, aparición de cardenales o picazón en el lugar de la inyección. Generalmente estos síntomas son leves a moderados y más frecuentes al inicio del tratamiento.
- Dolor de cabeza.
- Aumento de los niveles totales de colesterol en sangre.
Efectos adversos frecuentes(pueden afectar hasta 1 de cada 10 personas):
- Neutropenia (bajo número de glóbulos blancos) determinada tras un análisis de sangre. La neutropenia puede aumentar el riesgo de que usted contraiga una infección. Los síntomas de una infección pueden ser fiebre o dolor de garganta.
- Infecciones graves como neumonía (infección torácica) o infecciones de la piel.
- Trombocitopenia (bajo número de plaquetas en la sangre).
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- Reacciones alérgicas graves que incluyen hinchazón de la cara, lengua o garganta, problemas para tragar o respirar, sensación súbita de taquicardia o sudoración, picor en piel o erupción.
- Niveles elevados de las enzimas hepáticas detectadas tras un análisis de sangre.
Efectos adversos de frecuencia no conocida(no puede estimarse a partir de los datos disponibles):
- Signos de trastornos hepáticos, como color amarillo de la piel y de los ojos, náuseas, pérdida de apetito, orina de color oscuro y heces de color muy claro.
- Si se inyecta Kineret repetidamente en el mismo lugar, existe riesgo de que se forme un bulto (depósito de amiloide) debajo de la piel. Alterne el lugar de la inyección para evitarlo.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Kineret
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
Conservar en la caja original para protegerlo de la luz.
No utilice Kineret si cree que ha estado congelado. Una vez que una jeringa se ha sacado de la nevera y ha alcanzado la temperatura ambiente (hasta 25 °C), se debe utilizar en las 72 horas siguientes o desechar. No lo guarde de nuevo en la nevera si se ha conservado a temperatura ambiente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Kineret
- El principio activo es anakinra. Cada jeringa graduada precargada contiene 100 mg de anakinra.
- Los demás componentes (excipientes) son: ácido cítrico anhidro, cloruro sódico, edetato disódico dihidratado, polisorbato 80, hidróxido sódico y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Kineret es una solución transparente, entre incolora y blanquecina que se presenta en una jeringa precargada lista para su uso. La solución puede contener partículas de proteína de aspecto entre translúcido y blanco cuya presencia no afecta a la calidad del producto.
Tamaños de envases de 1, 7 o 28 (envase múltiple con 4 paquetes de 7 jeringas precargadas) jeringas precargadas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Swedish Orphan Biovitrum AB (publ)
SE‑112 76 Stockholm
Suecia
Fecha de la última revisión de este prospecto: 11/2024
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
INSTRUCCIONES PARA PREPARAR Y ADMINISTRAR UNA INYECCIÓN DE KINERET
Esta sección contiene información sobre cómo inyectarse Kineret usted mismo o inyectárselo a su hijo. Es importante que no intente administrarse la inyección usted mismo o administrársela a su hijo si no ha sido instruido sobre cómo hacerlo por un médico, enfermero o farmacéutico. Si usted tiene alguna duda sobre cómo ponerse la inyección, consúltelo con su médico, enfermera o farmacéutico.
¿Cómo debe usted o la persona que le va a inyectar, utilizar la jeringa precargada de Kineret?
Necesitará ponerse una inyección usted mismo o ponérsela a su hijo cada día a la misma hora. Kineret se inyecta debajo de la piel. Esto se conoce como inyección subcutánea.
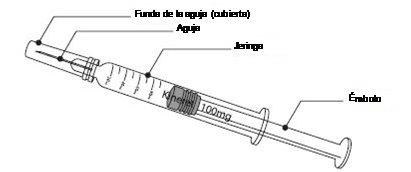
Material:
Para administrarse usted mismo o administrarle a su hijo una inyección subcutánea, necesitará:
- una jeringa precargada de Kineret;
- toallita con alcohol o similar, y
- una gasa o un apósito estériles
¿Qué debe hacer antes de ponerse usted mismo o ponerle a su hijola inyección subcutánea de Kineret?
- Saque la jeringa precargada de Kineret de la nevera.
- No agite la jeringa precargada.
- Compruebe la fecha de caducidad indicada en la etiqueta de la jeringa precargada (EXP). No la use si la fecha actual ha sobrepasado el último día del mes indicado.
- Compruebe el aspecto de Kineret. Tiene que ser una solución transparente, entre incolora y blanquecina. La solución puede contener partículas de proteína de aspecto entre translúcido y blanco cuya presencia no afecta a la calidad del producto. No utilice este medicamento si presenta un color diferente, está turbio o las partículas presentes no son entre translúcidas y blancas.
- Para una administración más cómoda, deje la jeringa precargada a temperatura ambiente durante 30 minutos aproximadamente o manténgala con cuidado en su mano cerrada durante unos minutos. No caliente Kineret de ninguna otra forma (por ejemplo, no lo ponga en el microondas ni en agua caliente).
- No retire el protector de la jeringa hasta que esté preparado para la inyección.
- Lávese las manos cuidadosamente.
- Busque una superficie cómoda, limpia y bien iluminada y coloque todo el material que necesite a su alcance.
- Asegúrese de que conoce la dosis de Kineret que le ha recetado su médico; 20 a 90 mg, 100 mg o mayor de 100 mg.
- Si su médico le ha recetado una dosis de 100 mg, vaya a la sección “¿Cómo preparar una dosis de 100mg?”.
- Si su médico le ha recetado una dosis menor, vaya a la sección “¿Cómo preparar una dosis de20a 90mg?”.
¿Cómo preparar una dosis de 100mg?
Antes de inyectarse Kineret debe hacer lo siguiente:
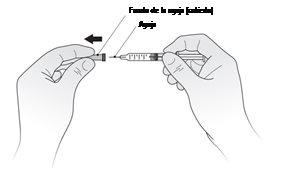
- Sostenga la jeringa y retire suavemente la cubierta de la aguja sin girarla, como se muestra en la Figura A. No toque la aguja ni empuje el émbolo. Deseche inmediatamente la cubierta de la aguja.
- Puede haber una pequeña burbuja de aire en la jeringa precargada. No es necesario eliminarla antes de la inyección. La inyección de la solución con una burbuja de aire no es perjudicial.
- Ahora ya puede usar la jeringa precargada tal como se describe en la sección “¿Dónde debe ponerse la inyección?“ y en la sección “¿Cómo ponerse la inyección?”.
 ¿Cómo preparar una dosis de 20 a 90mg?
¿Cómo preparar una dosis de 20 a 90mg?
Antes de inyectar Kineret debe hacer lo siguiente:
- Sujete la jeringa y retire suavemente la cubierta de la aguja sin girarla, como se muestra en la FiguraA. No toque la aguja ni empuje el émbolo. Deseche inmediatamente la cubierta de la aguja.
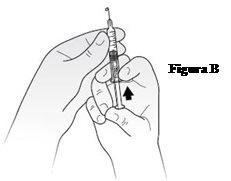
 Debe colocar la jeringa en una mano, con la aguja apuntando hacia arriba, como se muestra en la FiguraB. Coloque el pulgar en el émbolo y empuje suavemente hasta que vea aparecer una pequeña gota de líquido en la punta de la aguja.
Debe colocar la jeringa en una mano, con la aguja apuntando hacia arriba, como se muestra en la FiguraB. Coloque el pulgar en el émbolo y empuje suavemente hasta que vea aparecer una pequeña gota de líquido en la punta de la aguja.
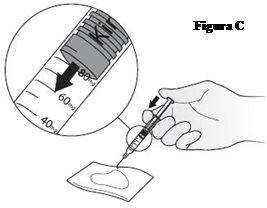
- Gire la jeringa de forma que la aguja apunte hacia abajo. Coloque una gasa o un apósito estériles en una superficie plana y sujete la jeringa encima, con la aguja apuntando hacia la gasa o el apósito, como se muestra en la FiguraC. No deje que la aguja toque la gasa o el apósito.
- Coloque el pulgar en el émbolo y apriete lentamente hasta que el frontal del émbolo llegue a la marca en la escala que se corresponda con su dosis de Kineret (su médico le habrá indicado cuál es la dosis que usted necesita). El líquido que salga será absorbido por la gasa o el apósito, tal como se muestra en la FiguraC.
- Si no ha podido obtener la dosis correcta, deseche la jeringa y utilice una nueva.
- Ahora podrá utilizar la jeringa precargada de la forma en que se describe en la sección “¿Dónde debe ponerse la inyección?” y en la sección “¿Cómo ponerse la inyección?”.
¿Dónde debe ponerse la inyección?
Los lugares más adecuados para ponerse la inyección usted mismo o ponérsela a su hijo son (ver la FiguraD):
- el abdomen (excepto la zona de alrededor del ombligo)
- la parte superior de los muslos
- la zona superior externa de los glúteos
- la zona externa superior de los brazos
AdultoNiño
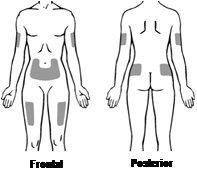
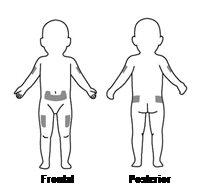
Cambie el lugar de la inyección de una vez a otra para que no tenga molestias en ninguna zona. Si la inyección se la pone otra persona, también se la puede poner en la parte posterior de los brazos.
¿Cómo ponerse la inyección?
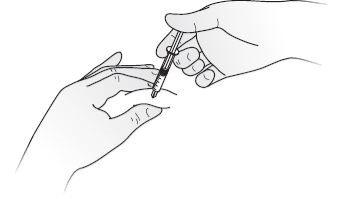
- Desinfecte la piel usando una toallita con alcohol y pellizque la piel entre el pulgar y el índice, sin apretar.
- Inserte completamente la aguja en la piel como le ha enseñado la enfermera o el médico.
- Inyecte el líquido lenta y regularmente, manteniendo siempre la piel pellizcada, como se muestra en la Figura E.
- Tras inyectar la solución, retire la aguja y suelte la piel.
- Cualquier resto de medicamento no utilizado se debe desechar. Cada jeringa solamente se debe utilizar para una inyección. No reutilice las jeringas, ya que esto puede provocar una infección.
Recuerde
Si tiene dificultad, pida ayuda y consejo a su médico o enfermero.
Cómo deshacerse de las jeringas usadas y materiales adicionales
- No vuelva a poner la cubierta en las agujas usadas.
- Mantenga las jeringas usadas fuera del alcance y de la vista de los niños.
- Nunca tire las jeringas precargadas usadas en su cubo de basura doméstica.
- Si su dosis es inferior a 100 mg, deberá verter el líquido sobrante de la jeringa en una gasa o un apósito. Tras la inyección, deseche la gasa o el apósito húmedos junto con la jeringa y limpie la superficie con un paño limpio.
- Las jeringas precargadas, así como la gasa o el apósito impregnados de solución Kineret, deben eliminarse de acuerdo con la normativa local. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPS) para la anakinra, las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
A la vista de los datos disponibles sobre el riesgo de SAM en pacientes con enfermedad de Still procedentes de ensayos clínicos, de la bibliografía y de estudios observacionales, el PRAC considera que los datos disponibles no respaldan una asociación causal entre el riesgo de SAM y anakinra. El PRAC llegó a la conclusión de que se debe modificar en consonancia la información de los productos que contienen anakinra.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
De acuerdo con las conclusiones científicas para la anakinra, el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contiene(n) anakinra no se modifica sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la(s) autorización(es) de comercialización.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a KINERET 100 mg/0,67 ml solucion inyectable en jeringa precargadaForma farmacéutica: INYECTABLE PERFUSION, 130 mgPrincipio activo: UstekinumabFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 45 mgPrincipio activo: UstekinumabFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 90 mgPrincipio activo: UstekinumabFabricante: Accord Healthcare S.L.U.Requiere receta
Médicos online para KINERET 100 mg/0,67 ml solucion inyectable en jeringa precargada
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de KINERET 100 mg/0,67 ml solucion inyectable en jeringa precargada, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes






