
BREYANZI 1,1-70 × 10E6 CELULAS/ML / 1,1-70 × 10E6 CELULAS/ML DISPERSION PARA PERFUSION

Cómo usar BREYANZI 1,1-70 × 10E6 CELULAS/ML / 1,1-70 × 10E6 CELULAS/ML DISPERSION PARA PERFUSION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el paciente
Breyanzi 1,1-70 × 106células/ml / 1,1-70 × 106células/ml dispersión para perfusión
lisocabtagén maraleucel (linfocitos T con receptor quimérico para el antígeno [CAR] positivos
viables)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Su médico le entregará una tarjeta para el paciente. Lea la tarjeta atentamente y siga las instrucciones que contiene.
- Muestre siempre la tarjeta para el paciente al médico o enfermero cuando los vea o si acude a un hospital.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Breyanzi y para qué se utiliza
- Qué necesita saber antes de que le administren Breyanzi
- Cómo se administra Breyanzi
- Posibles efectos adversos
- Conservación de Breyanzi
- Contenido del envase e información adicional
1. Qué es Breyanzi y para qué se utiliza
Qué es Breyanzi
Breyanzi contiene el principio activo lisocabtagén maraleucel, un tipo de tratamiento llamado “terapia celular genéticamente modificada”.
Breyanzi se elabora a partir de sus propios glóbulos blancos. Esto implica extraerle algo de sangre, separar los glóbulos blancos y enviarlos a un laboratorio de manera que puedan ser modificados para fabricar Breyanzi.
Para qué se utiliza Breyanzi
Breyanzi se utiliza para tratar a adultos con un tipo de cáncer de la sangre llamado linfoma que afecta a su tejido linfático y hace que los glóbulos blancos crezcan sin control. Breyanzi se utiliza para:
- el linfoma B difuso de células grandes;
- el linfoma B de alto grado;
- el linfoma B primario mediastínico de células grandes;
- el linfoma folicular.
Cómo funciona Breyanzi
- Las células que contiene Breyanzi se han modificado genéticamente para que reconozcan las células de linfoma presentes en su organismo.
- Cuando se introducen de nuevo estas células en su sangre, reconocerán y atacarán las células de linfoma.
2. Qué necesita saber antes de que le administren Breyanzi
No debe recibir Breyanzi
- si es alérgico a alguno de los componentes de este medicamento (incluidos en la sección 6). Si cree que puede ser alérgico, consulte a su médico
- si no puede recibir el tratamiento llamado quimioterapia reductora del número de linfocitos, que reduce el número de glóbulos blancos en su sangre (ver también la sección 3 “Cómo se administra Breyanzi”).
Advertencias y precauciones
Antes de recibir Breyanzi, debe informar a su médico si
- tiene problemas de pulmón o de corazón
- tiene la presión arterial baja
- tiene una infección u otras afecciones inflamatorias. La infección se tratará antes de que le administren Breyanzi
- ha recibido un trasplante de progenitores hematopoyéticos de otra persona en los últimos 4 meses. Las células trasplantadas pueden atacar al propio organismo (enfermedad injerto contra huésped), lo que provoca síntomas como erupción cutánea, náuseas, vómitos, diarrea y sangre en las heces
- nota que los síntomas del cáncer están empeorando. Estos síntomas son fiebre, sensación de debilidad, sudores nocturnos o pérdida de peso repentina
- ha padecido hepatitis B o C, o infección por el virus de la inmunodeficiencia humana (VIH)
- le han vacunado en las últimas 6 semanas o tiene previsto recibir una vacuna en los próximos meses. Consultar Vacunas vivasa continuación para más información.
Si se encuentra en alguna de las circunstancias anteriores (o no está seguro), consulte a su médico antes de que le administren Breyanzi.
Los pacientes tratados con Breyanzi pueden desarrollar nuevos tipos de cáncer. Se han notificado casos de pacientes que desarrollan cáncer, que empieza por un tipo de glóbulos blancos denominados linfocitos T, después del tratamiento con Breyanzi y medicamentos similares. Consulte a su médico si experimenta cualquier nueva inflamación de las glándulas (ganglios linfáticos) o cambios en la piel, como nuevas erupciones o bultos.
Pruebas y exploraciones
Antes de recibir Breyanzi, su médico
- examinará sus pulmones, corazón y presión arterial
- buscará signos de infección (cualquier infección se tratará antes de administrarle Breyanzi)
- buscará signos de la “enfermedad injerto contra huésped”, que puede ocurrir tras un trasplante de progenitores hematopoyéticos de otra persona
- le hará un análisis de sangre para comprobar el ácido úrico y determinar el número de células cancerosas presentes en su sangre. Esto indicará si es propenso a presentar una afección llamada síndrome de lisis tumoral. Le podrán administrar medicamentos para prevenir esta afección
- comprobará si su cáncer está empeorando
- le hará un análisis para detectar hepatitis B y C e infección por el VIH.
- Después de recibir Breyanzi
- Si presenta ciertos efectos adversos graves, deberá informar a su médico o enfermero enseguida porque puede necesitar un tratamiento para ellos. Ver “efectos adversos graves” en la sección 4
- Su médico le hará analíticas periódicas para controlar los valores del hemograma, ya que el número de células sanguíneas podría disminuir
- Debe permanecer cerca del centro de tratamiento donde ha recibido Breyanzi durante al menos 4 semanas. Ver secciones 3 y 4
- No debe donar sangre, órganos, tejidos ni células para trasplante.
Se le pedirá que se inscriba en un registro durante al menos 15 años a fin de comprender mejor los efectos de Breyanzi a largo plazo.
Niños y adolescentes
Breyanzi no debe administrarse a niños y adolescentes menores de 18 años de edad.
Otros medicamentos y Breyanzi
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento, incluso si se trata de medicamentos adquiridos sin receta.
Para obtener información sobre los medicamentos que le administrarán antes de Breyanzi, ver sección 3.
Medicamentos que afectan al sistema inmunitario
Antes de recibir Breyanzi, informe a su médico o enfermero si está tomando medicamentos que debilitan el sistema inmunitario, por ejemplo:
- corticoesteroides.
Debe hacerlo porque estos medicamentos pueden reducir el efecto de Breyanzi.
Otros medicamentos para tratar el cáncer
Algunos medicamentos para el cáncer podrían reducir el efecto de Breyanzi. Su médico valorará si necesita otros tratamientos para el cáncer.
Vacunas vivas
No debe recibir ciertas vacunas, en concreto, las llamadas vacunas vivas:
- en las 6 semanas antes de recibir el ciclo breve de quimioterapia (denominada quimioterapia reductora del número de linfocitos) que se administra con el fin de preparar el organismo para Breyanzi;
- durante el tratamiento con Breyanzi;
- después del tratamiento, mientras el sistema inmunitario se está recuperando.
Consulte a su médico si necesita recibir alguna vacuna.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de recibir este medicamento o la quimioterapia reductora del número de linfocitos. Los efectos de Breyanzi en las mujeres embarazadas o en periodo de lactancia se desconocen y pueden ser nocivos para el bebé en gestación o el lactante.
- Si está embarazada o cree que podría estar embarazada después del tratamiento con Breyanzi, consulte a su médico inmediatamente.
- Se le realizará una prueba de embarazo antes del inicio del tratamiento. Breyanzi solo se debe administrar si los resultados indican que no está embarazada.
Consulte a su médico la necesidad de anticonceptivos.
Si ha recibido Breyanzi, consulte a su médico acerca del embarazo.
Conducción y uso de máquinas
No conduzca, use máquinas ni participe en actividades en las que deba estar alerta durante al menos 8 semanas después del tratamiento. Breyanzi puede causar somnolencia, reducir el nivel de alerta y causar confusión y convulsiones (ataques epilépticos).
Breyanzi contiene sodio, potasio y dimetilsulfóxido (DMSO)
Este medicamento contiene hasta 12,5 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial. Esto equivale al 0,6 % de la ingesta diaria máxima de sodio recomendada para un adulto. Se pueden administrar hasta 8 viales de este medicamento por dosis, lo que supone un total de 100 mg de sodio o un 5 % de la ingesta diaria máxima de sodio recomendada para un adulto.
Este medicamento contiene hasta 0,2 mmol (o 6,5 mg) de potasio por dosis. Su médico tendrá en cuenta este contenido de potasio si sus riñones no funcionan correctamente o si sigue una dieta pobre en potasio.
Este medicamento también contiene DMSO que puede provocar reacciones de hipersensibilidad graves.
3. Cómo se administra Breyanzi
Tarjeta para el paciente
- Su médico le entregará una tarjeta para el paciente. Lea la tarjeta detenidamente y siga las instrucciones que contiene.
- Muéstrele siempre la tarjeta para el paciente al médico o enfermero cuando los vea o si acude a un hospital.
Donación de sangre para fabricar Breyanzi a partir de sus glóbulos blancos
Breyanzi se fabrica a partir de sus glóbulos blancos.
- Su médico le extraerá sangre a través de una vía (catéter) que se introduce en la vena. Algunos de sus glóbulos blancos se separarán de su sangre. El resto de la sangre se devolverá al organismo. Este procedimiento se denomina “leucaféresis” y puede durar de 3 a 6 horas. Quizá sea necesario repetir el proceso.
- A continuación, sus glóbulos blancos se enviarán para la fabricación de Breyanzi.
Otros medicamentos que recibirá antes de Breyanzi
- Unos días antes de recibir Breyanzi, se le administrará un ciclo breve de quimioterapia. El objetivo de esta es eliminar sus glóbulos blancos.
- Poco antes de recibir Breyanzi, se le administrará paracetamol y un medicamento antihistamínico. El objetivo de estos es reducir el riesgo de reacciones a la perfusión y fiebre.
Cómo se administra Breyanzi
- Su médico verificará que Breyanzi se ha preparado a partir de su propia sangre, comprobando que la información relativa a la identidad del paciente que aparece en las etiquetas del medicamento coincide con sus datos.
- Breyanzi se administra mediante perfusión (goteo) en una vena a través de una vía.
- Recibirá perfusiones de las células CD8 positivas, seguidas inmediatamente de perfusiones de las células CD4 positivas. El tiempo de perfusión variará, pero normalmente será inferior a 15 minutos para cada uno de los 2 tipos de células.
Después de la administración de Breyanzi
- Debe permanecer cerca del centro de tratamiento donde ha recibido Breyanzi (durante al menos 4 semanas).
- Durante la primera semana después del tratamiento, tendrá que volver al centro de tratamiento de 2 a 3 veces para que su médico pueda comprobar si el tratamiento está funcionando y ayudarle con cualquier posible efecto adverso. Ver secciones 2 y 4.
Si falta a una cita
Llame a su médico o al centro de tratamiento lo antes posible para concertar otra cita.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Informe a su médico de inmediato si experimenta alguno de los siguientes efectos adversos después del tratamiento con Breyanzi:
- fiebre, escalofríos o temblores, sensación de cansancio, latidos cardiacos rápidos o irregulares, aturdimiento y falta de aliento, que pueden ser signos de un problema grave llamado “síndrome de liberación de citocinas”
- confusión, disminución del estado de alerta (disminución de la consciencia), dificultad para hablar o hablar arrastrando las palabras, temblores, sensación de ansiedad, sensación de mareo y dolor de cabeza, que pueden ser síntomas de una afección llamada síndrome de neurotoxicidad asociada a células inmuno efectoras (ICANS, por sus siglas en inglés) o signos de problemas en el sistema nervioso
- sensación de calor, fiebre, escalofríos o tiritona, que pueden ser signos de infección.
Las infecciones pueden deberse a:
- niveles bajos de glóbulos blancos, que ayudan a combatir las infecciones, o
- niveles bajos de anticuerpos llamados “inmunoglobulinas”.
- visión borrosa, pérdida de la visión o visión doble, dificultad para hablar, debilidad o torpeza en un brazo o una pierna, un cambio en la forma de andar o problemas de equilibrio, cambios de personalidad, alteraciones en el pensamiento, la memoria y la orientación que pueden provocar confusión. Todos ellos pueden ser síntomas de una afección del cerebro grave y potencialmente mortal conocida como leucoencefalopatía multifocal progresiva (LMP). Estos síntomas pueden comenzar varios meses después de haber finalizado el tratamiento y suelen desarrollarse de manera lenta y gradual a lo largo de semanas o meses. Es importante que sus familiares o cuidadores también conozcan estos síntomas, ya que pueden darse cuenta de síntomas de los que usted no sea consciente.
- sensación de mucho cansancio, debilidad o falta de aliento, que pueden ser signos de niveles bajos de glóbulos rojos (anemia)
- sangrado o aparición de moratones con más facilidad, que pueden ser signos de niveles bajos de unas células de la sangre llamadas plaquetas.
Informe a su médico inmediatamente si experimenta alguno de los efectos adversos anteriores después de haber recibido Breyanzi, ya que puede necesitar tratamiento médico urgente.
Otros posibles efectos adversos
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
- dificultad para dormir
- presión arterial baja, incluidos signos como mareos, desmayo o alteración visual
- tos
- náuseas o vómitos
- diarrea o estreñimiento
- dolor de estómago
- hinchazón de los tobillos, los brazos, las piernas y la cara
- erupción cutánea
Frecuentes: pueden afectar hasta 1 de cada 10 personas
- problemas de equilibrio o para caminar
- presión arterial alta que puede incluir signos como dolor de cabeza muy fuerte, sudoración o problemas para dormir
- cambios en la visión
- cambios en el sabor de las cosas
- entumecimiento y hormigueo en los pies o las manos
- coágulos de sangre o problemas de coagulación de la sangre
- sangrado en el intestino
- menos cantidad de orina
- reacciones a la perfusión, como sensación de mareo, fiebre y falta de aliento
- niveles bajos de fosfatos en la sangre
- niveles bajos de oxígeno en la sangre
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
- un nuevo tipo de cáncer que comienza en un tipo de glóbulos blancos llamados linfocitos T (neoplasia secundaria de células T)
- rápida descomposición de las células cancerosas, lo que produce la liberación de productos de desecho tóxicos en el torrente sanguíneo: un signo puede ser orina de color oscuro con síntomas de náuseas o dolor en un lado del estómago
- afección inflamatoria grave: los síntomas pueden incluir fiebre, erupción cutánea, agrandamiento del hígado, el bazo y los ganglios linfáticos
- debilidad del corazón, que produce falta de aliento e hinchazón de los tobillos
- líquido alrededor de los pulmones
- ictus o mini-ictus
- convulsiones o crisis (ataques epilépticos)
- debilidad de los músculos de la cara, de las cuerdas vocales, o debilidad del cuerpo
- hinchazón del cerebro.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Breyanzi
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en las cajas y en la etiqueta del vial después de “CAD/EXP”.
Conservar congelado en la fase de vapor del nitrógeno líquido (≤–130 °C).
6. Contenido del envase e información adicional
Composición de Breyanzi
- El principio activo es lisocabtagén maraleucel. Cada vial de 4,6 ml contiene una dispersión de linfocitos T-CAR positivos viables (componente celular CD8 positivo o componente celular CD4 positivo) con una concentración de 1,1 × 106 a 70 × 106 linfocitos T-CAR positivos viables/ml de cada componente celular. Puede haber hasta 4 viales de cada uno de los componentes celulares CD8 positivo o CD4 positivo, en función de la concentración del medicamento criopreservado.
- Los demás componentes (excipientes) son Cryostor CS10 (contiene dimetilsulfóxido o DMSO), cloruro de sodio, gluconato de sodio, acetato de sodio trihidrato, cloruro potásico, cloruro de magnesio, albúmina humana, N-acetil-DL-triptófano, ácido caprílico y agua para preparaciones inyectables. Ver sección 2, “Breyanzi contiene sodio, potasio y dimetilsulfóxido (DMSO)”.
Este medicamento contiene células sanguíneas humanas modificadas genéticamente.
Aspecto del producto y contenido del envase
Breyanzi es una dispersión celular para perfusión. Se suministra en viales con una dispersión de ligeramente opaca a opaca, de incolora a amarillenta o amarillo pardo. Cada vial contiene 4,6 ml de dispersión celular del componente celular CD8 positivo o del componente celular CD4 positivo.
Titular de la autorización de comercialización
Bristol-Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Irlanda
Responsable de la fabricación
Celgene Distribution B.V.
Orteliuslaan 1000
3528 BD Utrecht
Países Bajos
BMS Netherlands Operations B.V.
Francois Aragostraat 2
2342 DK Oegstgeest
Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien N.V. Bristol-Myers Squibb Belgium S.A. Tél/Tel: + 32 2 352 76 11 | Lietuva Swixx Biopharma UAB Tel: + 370 52 369140 |
| Luxembourg/Luxemburg N.V. Bristol-Myers Squibb Belgium S.A. Tél/Tel: + 32 2 352 76 11 |
Ceská republika Bristol-Myers Squibb spol. s r.o. Tel: + 420 221 016 111 | Magyarország Bristol-Myers Squibb Kft. Tel.: + 36 1 301 9797 |
Danmark Bristol-Myers Squibb Denmark Tlf: + 45 45 93 05 06 | Malta A.M. Mangion Ltd Tel: + 356 23976333 |
Deutschland Bristol-Myers Squibb GmbH & Co. KGaA Tel: 0800 0752002 (+ 49 89 121 42 350) | Nederland Bristol-Myers Squibb B.V. Tel: + 31 (0)30 300 2222 |
Eesti Swixx Biopharma OÜ Tel: + 372 640 1030 | Norge Bristol-Myers Squibb Norway AS Tlf: + 47 67 55 53 50 |
Ελλáδα Bristol-Myers Squibb A.E. Τηλ: + 30 210 6074300 | Österreich Bristol-Myers Squibb GesmbH Tel: + 43 1 60 14 30 |
España Bristol-Myers Squibb, S.A. Tel: + 34 91 456 53 00 | Polska Bristol-Myers Squibb Polska Sp. z o.o. Tel.: + 48 22 2606400 informacja.medyczna@bms.com |
France Bristol-Myers Squibb SAS Tél: + 33 (0)1 58 83 84 96 | Portugal Bristol-Myers Squibb Farmacêutica Portuguesa, S.A. Tel: + 351 21 440 70 00 |
Hrvatska Swixx Biopharma d.o.o. Tel: + 385 1 2078 500 | România Bristol-Myers Squibb Marketing Services S.R.L. Tel: + 40 (0)21 272 16 19 |
Ireland Bristol-Myers Squibb Pharmaceuticals uc Tel: 1 800 749 749 (+ 353 (0)1 483 3625) | Slovenija Swixx Biopharma d.o.o. Tel: + 386 1 2355 100 |
Ísland Vistor hf. Sími: + 354 535 7000 | Slovenská republika Swixx Biopharma s.r.o. Tel: + 421 2 20833 600 |
Italia Bristol-Myers Squibb S.r.l. Tel: + 39 06 50 39 61 | Suomi/Finland Oy Bristol-Myers Squibb (Finland) Ab Puh/Tel: + 358 9 251 21 230 |
Κúπρος Bristol-Myers Squibb A.E. Τηλ: 800 92666 (+ 30 210 6074300) | Sverige Bristol-Myers Squibb Aktiebolag Tel: + 46 8 704 71 00 |
Latvija Swixx Biopharma SIA Tel: + 371 66164750 |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu.
-------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
Precauciones que se deben tomar antes de manipular o administrar el medicamento
Breyanzi debe transportarse dentro de la instalación en recipientes cerrados, a prueba de rotura y a prueba de fugas.
Este medicamento contiene células sanguíneas humanas. Los profesionales sanitarios que manipulen Breyanzi deben tomar las precauciones adecuadas (usar guantes, ropa de protección y protección ocular) para evitar la posible transmisión de enfermedades infecciosas.
Preparación previa a la administración
Antes dedescongelar los viales
- Confirme los datos identificativos del paciente con los identificadores del paciente que figuran en la caja de envío.
- Breyanzi está compuesto por linfocitos T-CAR positivos viables formulados como componentes celulares CD8+ y CD4+ por separado; hay un certificado de liberación para perfusión (RfIC) distinto para cada componente celular. Lea el RfIC (pegado en el interior de la caja de envío) para obtener información sobre el número de jeringas que necesitará y el volumen a administrar de los componentes celulares CD8+ y CD4+ (las etiquetas de las jeringas se proporcionan con el RfIC).
- Confirme la hora de perfusión por adelantado y ajuste la hora de inicio de la descongelación de Breyanzi de manera que esté disponible para la perfusión cuando el paciente esté preparado.
Nota:una vez que los viales de linfocitos T-CAR positivos viables (componentes celulares CD8+ y CD4+) se retiran del contenedor de almacenamiento de criopreservación, la descongelación se debe llevar a cabo hasta su finalización y las células se deben administrar en un plazo de 2 horas.
Descongelación de los viales
- Confirme los datos identificativos del paciente con los identificadores del paciente que figuran en la caja exterior y en el certificado de liberación para perfusión (RfIC).
- Saque la caja de componente celular CD8+ y la caja de componente celular CD4+ de la caja exterior.
- Abra cada caja interior e inspeccione visualmente los viales en busca de daños. Si los viales están dañados, póngase en contacto con la compañía.
- Saque con cuidado los viales de las cajas, coloque los viales sobre un protector o papel absorbente y descongele a temperatura ambiente. Descongele todos los viales al mismo tiempo.
Tenga cuidado de mantener separados los componentes celulares CD8+ y CD4+.
Preparación de la dosis
- En función de la concentración de linfocitos T-CAR positivos viables de cada componente, puede ser necesario más de un vial de cada uno de los componentes celulares CD8+ y CD4+ para completar una dosis. Se debe preparar una jeringa distinta para cada vial de componente celular CD8+ o CD4+ recibido.
Nota: el volumen a extraer y perfundir puede ser diferente para cada componente.
- Cada vial de 5 ml contiene un volumen total extraíble de 4,6 ml de linfocitos T del componente celular CD8+ o CD4+. El RfIC para cada componente indica el volumen (ml) de células que debe ser extraído en cada jeringa. Utilice la jeringa con cono Luer Lock más pequeño (1 ml a 5 ml) necesaria para extraer el volumen especificado de cada vial. No se debe utilizar una jeringa de 5 ml para volúmenes inferiores a 3 ml.
- Prepare primero la(s) jeringa(s) del componente celular CD8+.Confirme que los identificadores del paciente que figuran en la etiqueta de la jeringa del componente celular CD8+ coinciden con los identificadores del paciente que figuran en la etiqueta del vial del componente celular CD8+. Pegue las etiquetas de la jeringa del componente celular CD8+ en la(s) jeringa(s) antes de extraer el volumen requerido en la(s) jeringa(s).
- Repita el proceso para el componente celular CD4+.
Nota:es importante confirmar que el volumen extraído de cada componente celular coincide con el volumen especificado en el correspondiente certificado de liberación para perfusión (RfIC).
La extracción del volumen requerido de células de cada vial en una jeringa distinta se debe realizar siguiendo las siguientes instrucciones:
- Sujete el (los) vial(es) descongelado(s) boca arriba y gírelos boca abajo/boca arriba con cuidado para mezclar el producto celular. Si se observan grumos, continúe girándolos boca abajo/boca arriba hasta que los grumos se hayan dispersado y las células parezcan estar uniformemente resuspendidas.
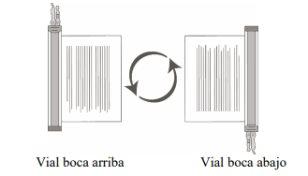
- Inspeccione visualmente el (los) vial(es) descongelado(s) en busca de daños o fugas. No utilice el vial si está dañado o si los grumos no se dispersan; póngase en contacto con la compañía. El líquido de los viales debe ser de ligeramente opaco a opaco, de incoloro a amarillento o amarillo pardo.
- Retire la tapa de polialuminio (si hay) de la parte inferior del vial y limpie el septum con una toallita con alcohol. Deje que se seque al aire antes de proceder.
NOTA:la falta de la tapa de polialuminio no afecta a la esterilidad del vial.
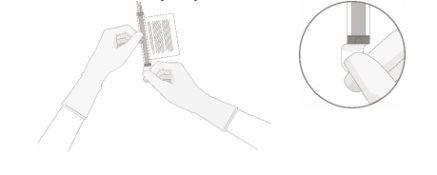
- Con el (los) vial(es) boca arriba, corte el sello por la línea del tubo en la parte superior del vial inmediatamente por encima del filtro para abrir el respiradero del vial.
NOTA:tenga cuidado de seleccionar la línea del tubo correcta con el filtro. Corte SOLO el tubo con filtro.

- Coja una aguja de calibre 20, de 1-1½ pulgadas, con la abertura de la punta de la aguja alejada del septum del orificio de extracción.
- Introduzca la aguja en el septum en un ángulo de 45°-60° para perforar el septum del orificio de extracción.
- Aumente el ángulo de la aguja gradualmente a medida que la aguja entra en el vial.
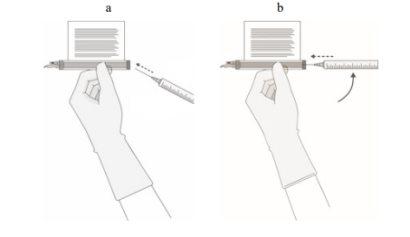
- SIN aspirar aire en la jeringa, extraiga lentamente el volumen objetivo (como se especifica en el certificado de liberación para perfusión [RfIC]).
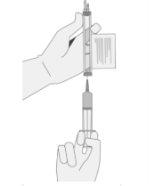
- Inspeccione cuidadosamente la jeringa para ver si hay signos de partículas extrañas antes de proceder. Si hay partículas extrañas, póngase en contacto con la compañía.
- Verifique que el volumen del componente celular CD8+/CD4+ coincide con el volumen especificado para el componente correspondiente en el certificado de liberación para perfusión (RfIC).
Una vez verificado el volumen, gire el vial y la jeringa a una posición horizontal y retire la jeringa/aguja del vial.
Separe cuidadosamente la aguja de la jeringa y ponga el tapón en la jeringa.

- Siga sujetando el vial horizontalmente y vuelva a colocarlo en la caja para evitar que se produzcan fugas del vial.
- Deseche cualquier porción no utilizada de Breyanzi.
Administración
- NOutilice un filtro reductor del número de leucocitos.
- Asegúrese de que tocilizumab y el equipo de emergencia estén disponibles antes de la perfusión y durante el periodo de recuperación. En el caso excepcional de que no haya tocilizumab debido a un desabastecimiento que figure en el catálogo de desabastecimientos de la Agencia Europea de Medicamentos, asegúrese que se dispone de medidas alternativas adecuadas en el centro, en vez de tocilizumab, para tratar el SLC.
- Antes de la perfusión, confirme que la identidad del paciente coincide con los identificadores del paciente que figuran en la etiqueta de la jeringa suministrada en el correspondiente RfIC.
- Una vez que Breyanzi ha sido introducido en las jeringas, proceda a su administración lo antes posible. El tiempo total desde la extracción de Breyanzi del contenedor de almacenamiento de criopreservación hasta la administración al paciente no debe superar las 2 horas.
- Utilice una solución inyectable de cloruro sódico de 9 mg/ml (0,9 %) intravenoso para enjuagar todas las vías de perfusión antes y después de la administración de cada componente celular CD8+ o CD4+.
- Administre primero el componente celular CD8+. Todo el volumen del componente celular CD8+ se administra por vía intravenosa a una velocidad de perfusión de aproximadamente 0,5 ml/minuto, utilizando el puerto más cercano o el brazo en Y (piggyback).
- Si se requiere más de una jeringa para una dosis completa del componente celular CD8+, administre el volumen en cada jeringa consecutivamente sin dejar tiempo entre la administración del contenido de las jeringas (a menos que haya una razón clínica para retener la dosis, p. ej., reacción a la perfusión). Una vez administrado el componente celular CD8+, enjuague la vía con solución inyectable de cloruro sódico de 9 mg/ml (0,9 %).
- Administre el componente celular CD4+ inmediatamente después de que se haya completado la administración del componente celular CD8+, siguiendo los mismos pasos y velocidad de perfusión descritos para el componente celular CD8+. Después de la administración del componente celular CD4+, enjuague la vía con solución inyectable de cloruro sódico de 9 mg/ml (0,9 %), utilizando una cantidad suficiente para enjuagar la vía y la longitud del catéter intravenoso. El tiempo de perfusión variará y normalmente será inferior a 15 minutos para cada componente.
Medidas que deben adoptarse en caso de exposición accidental
En caso de exposición accidental, deben seguirse las directrices locales sobre la manipulación de materiales de origen humano. Las superficies de trabajo y los materiales que hayan podido estar en contacto con Breyanzi deben descontaminarse con un desinfectante adecuado.
Precauciones que se deben tomar en la eliminación del medicamento
El medicamento no utilizado y todo el material que haya estado en contacto con Breyanzi (residuos sólidos y líquidos) deben manipularse y eliminarse como residuos potencialmente infecciosos de conformidad con las orientaciones locales sobre la manipulación de material de origen humano.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a BREYANZI 1,1-70 × 10E6 CELULAS/ML / 1,1-70 × 10E6 CELULAS/ML DISPERSION PARA PERFUSIONForma farmacéutica: INYECTABLE PERFUSION, 260 - 500 × 10e6 célulasPrincipio activo: Idecabtagen vicleucelFabricante: Bristol-Myers Squibb Pharma EeigRequiere recetaForma farmacéutica: INYECTABLE PERFUSION, 3,2 x 10e6 - 1 x 10e8 celulasPrincipio activo: Ciltacabtagen autoleucelFabricante: Janssen-Cilag International N.VRequiere recetaForma farmacéutica: INYECTABLE, 2,8×10e7 - 7.3×10e7 celulas/mlPrincipio activo: tabelecleucelFabricante: Pierre Fabre MedicamentRequiere receta
Médicos online para BREYANZI 1,1-70 × 10E6 CELULAS/ML / 1,1-70 × 10E6 CELULAS/ML DISPERSION PARA PERFUSION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de BREYANZI 1,1-70 × 10E6 CELULAS/ML / 1,1-70 × 10E6 CELULAS/ML DISPERSION PARA PERFUSION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes







