
Zibor

Consulta con un médico sobre la receta médica de Zibor

Cómo usar Zibor
Hoja de instrucciones del paquete: información para el usuario
Zibor 25 000 UI anty-Xa/mL solución inyectable en jeringa precargada
Bemiparin sódico
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, consulte a su médico o farmacéutico
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Zibor y para qué se utiliza
- 2. Información importante antes de usar Zibor
- 3. Cómo usar Zibor
- 4. Posibles efectos adversos
- 5. Cómo conservar Zibor
- 6. Contenido del paquete y otra información
1. Qué es Zibor y para qué se utiliza
Zibor 25 000 UI anty-Xa/mL que contiene bemiparina sódica (bemiparin sódico) como principio activo, pertenece a un grupo de medicamentos anticoagulantes de heparina de bajo peso molecular, que evitan la coagulación de la sangre en los vasos sanguíneos. Zibor se utiliza para tratar trombosis en las venas de las piernas y (o) embolia pulmonar (trombosis venosa profunda (o) tromboembolia pulmonar).
2. Información importante antes de usar Zibor
Cuándo no usar Zibor:
- Si el paciente es alérgico a la bemiparina sódica, heparina o productos similares (como enoxaparina, dalteparina, nadroparina) o a cualquiera de los demás componentes de este medicamento (enumerados en el punto 6).
- Si el paciente ha experimentado una reacción alérgica después de la administración de cualquier medicamento que contenga heparina.
- Si el paciente es alérgico a cualquier sustancia derivada de cerdos.
- Si el paciente tiene trombocitopenia inducida por heparina (TIP) - una condición en la que disminuye el número de plaquetas y se produce su agregación después de la administración de Zibor o síndrome de coagulación intravascular diseminada (SCID) en el contexto de disminución del número de plaquetas.
- Si el paciente tiene endocarditis - inflamación del revestimiento del corazón y las válvulas cardíacas.
- Si el paciente tiene tendencia a sangrado excesivo.
- Si el paciente tiene insuficiencia hepática o renal grave,
- Si el paciente tiene cambios con alto riesgo de sangrado (por ejemplo, úlcera gastroduodenal activa, angiomas y aneurismas cerebrales [aneurismas de los vasos sanguíneos cerebrales], tumores cerebrales).
- Si el paciente ha experimentado sangrado cerebral.
- Si el paciente ha sufrido una lesión o se planea una cirugía en el cerebro, la médula espinal, los ojos
y (o) oídos.
- Durante el tratamiento con Zibor, no se debe usar anestesia espinal (anestesia epidural o intratecal), ya que es peligroso. Por lo tanto, debe informar a su médico sobre el tratamiento con Zibor antes de someterse a una cirugía.
Precauciones y advertencias
Antes de comenzar a usar Zibor, debe discutirlo con su médico.
- Si el paciente tiene insuficiencia hepática.
- En caso de trastornos renales. El médico puede decidir realizar un seguimiento estricto. Si el paciente tiene una enfermedad renal grave, el médico puede recomendar una dosificación especial.
- Si el paciente tiene hipertensión arterial no controlada.
- Si el paciente ha tenido úlcera gastroduodenal en el pasado y ya no la tiene.
- Si el paciente tiene trombocitopenia - un trastorno en el que hay una cantidad pequeña de plaquetas en la sangre (células de coagulación), lo que hace que sea fácil que aparezcan moretones y sangrados.
- Si el paciente tiene cálculos renales o urinarios.
- Si el paciente tiene otros cambios orgánicos asociados con un mayor riesgo de complicaciones hemorrágicas.
- Si el paciente tiene enfermedades oculares (relacionadas con los vasos sanguíneos).
- Si el paciente tiene diabetes.
- Si los análisis de sangre muestran un nivel elevado de potasio en la sangre.
- Debe asegurarse de que su médico esté adecuadamente informado sobre la punción lumbar planificada (punción de la parte inferior de la columna vertebral para tomar líquido cefalorraquídeo para realizar análisis de laboratorio).
Zibor y otros medicamentos
Debe informar a su médico si está tomando alguno de los siguientes medicamentos:
- cualquier medicamento inyectado en el músculo, ya que durante el tratamiento con Zibor debe evitarse el uso de medicamentos inyectados en el músculo,
- otros medicamentos anticoagulantes como warfarina y (o) acenocoumarol (antagonistas de la vitamina K) utilizados para tratar o prevenir trastornos de coagulación,
- medicamentos antiinflamatorios no esteroideos, como ibuprofeno, utilizados para tratar artritis,
- medicamentos esteroideos, como prednisolona, utilizados para tratar enfermedades inflamatorias como artritis,
- medicamentos que inhiben la agregación de plaquetas, como ácido acetilsalicílico, ticlopidina o clopidogrel, utilizados para prevenir trastornos de coagulación,
- medicamentos que aumentan el nivel de potasio en la sangre, como diuréticos (medicamentos para aumentar la producción de orina) y medicamentos antihipertensivos (utilizados para reducir la presión arterial),
- medicamentos que aumentan el volumen de sangre, como dextrán,
- nitroglicerina administrada por vía intravenosa, utilizada para tratar enfermedades cardíacas.
Debe decirle a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Análisis de laboratorio
- En algunos pacientes puede ser necesario determinar el recuento de plaquetas. El médico decidirá si es necesario (por ejemplo, antes de iniciar el tratamiento, en el primer día de terapia y luego regularmente, cada 3 a 4 días, y en el momento de finalizar el tratamiento).
- En caso de que el paciente tenga ciertas enfermedades (diabetes, enfermedades renales) o esté tomando medicamentos que ahorran potasio, el médico puede recomendar determinar el nivel de potasio en la sangre.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Conducción de vehículos y uso de máquinas
Zibor no afecta la capacidad de conducir vehículos o usar máquinas.
3. Cómo usar Zibor
Este medicamento siempre debe usarse según las indicaciones de su médico. En caso de dudas, consulte a su médico o farmacéutico.
Dosis recomendada:
Adultos (18 – 64 años)
La dosis diaria de Zibor se determinará según el peso corporal del paciente.
- en pacientes con un peso corporal inferior a 50 kg, se administra una dosis de 0,2 mL (5000 UI anty-Xa).
- en pacientes con un peso corporal de 50 kg a 70 kg, se administra una dosis de 0,3 mL (7500 UI anty-Xa).
- en pacientes con un peso corporal de 71 kg a 100 kg, se administra una dosis de 0,4 mL (10 000 UI anty-Xa).
- en pacientes con un peso corporal superior a 100 kg, la dosis diaria se determinará según el peso corporal en función de la siguiente proporción: 115 UI anty-Xa/kg de peso corporal/día.
La actividad se expresa en unidades internacionales de actividad antifactor Xa (UI)
del Primer Estándar Internacional de Heparina de Bajo Peso Molecular.
Zibor se inyecta generalmente bajo la piel, generalmente en el pliegue cutáneo del abdomen o la parte superior del muslo. En el hospital, el medicamento es administrado por un médico o enfermera. Después de salir del hospital, puede ser necesario continuar el tratamiento con Zibor en casa.
- No se debe inyectar Zibor en el músculo ni mezclarlo con otros medicamentos inyectados en el músculo.
- El medicamento generalmente se administra una vez al día.
- El médico informará al paciente sobre la duración del tratamiento (generalmente durante unos 5-9 días).
- Si el médico ha recomendado el uso de Zibor por su cuenta, debe seguir estrictamente las instrucciones del médico (véase a continuación: "Cómo inyectar Zibor").
Uso en pacientes de edad avanzada (65 años o más):generalmente no hay necesidad de cambiar la dosis recomendada para otros pacientes adultos. En caso de trastornos hepáticos, debe informar a su médico, quien puede decidir realizar un seguimiento estricto. En caso de trastornos renales, debe informar a su médico, quien puede decidir realizar un seguimiento estricto. Si el paciente tiene una enfermedad renal grave, el médico puede recomendar una dosificación especial.
Uso en niños y adolescentes (menores de 18 años):no se recomienda el uso de Zibor en niños.
Cómo inyectar Zibor
Zibor nunca debe inyectarse en el músculo, ya que puede causar sangrado en los músculos.
Antes de realizar la primera inyección por su cuenta, el paciente debe recibir instrucciones detalladas sobre la técnica correcta de inyección del medicamento. Las instrucciones deben ser proporcionadas por el médico o personal médico calificado.
Debe seguir las siguientes instrucciones:
- Debe lavarse las manos cuidadosamente y sentarse o acostarse en una posición cómoda.
- Debe elegir un lugar en la parte delantera o posterior del abdomen, evitando un área de 5 cm alrededor del ombligo y lugares con cicatrices o moretones, y limpiar la piel cuidadosamente.
- Para cada inyección, debe elegir un lugar diferente, por ejemplo, alternando entre el lado izquierdo y derecho.
- Debe quitar la cubierta de la jeringa precargada de Zibor.
- Para mantener la esterilidad de la aguja, no debe tocarla con ninguna superficie.
- La jeringa precargada está lista para usar.
- Antes de la inyección, no debe presionar el émbolo para eliminar las burbujas de aire, ya que esto puede hacer que se pierda medicamento.

- Sosteniendo la jeringa precargada en una mano, con el pulgar y el dedo índice de la otra mano, debe sostener suavemente el área de la piel limpia para formar un pliegue cutáneo.
- Debe insertar toda la longitud de la aguja en el pliegue cutáneo a un ángulo de 90 grados.
- Debe presionar el émbolo mientras mantiene el pliegue cutáneo durante toda la inyección.
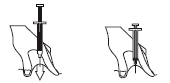
- Debe retirar la aguja sacándola hacia arriba y soltar el pliegue cutáneo.
- No debe frotar el lugar de la inyección. Esto ayudará a evitar moretones.
- No debe volver a colocar la cubierta en la jeringa precargada. Debe desecharla (primero la aguja) en un contenedor para objetos punzocortantes, cerrarlo herméticamente y colocarlo en un lugar inaccesible para los niños.
- Si siente que el efecto del medicamento es demasiado fuerte (por ejemplo, si sangra inesperadamente) o demasiado débil (falta de mejora), debe informar a su médico o farmacéutico.
Uso de una dosis mayor de la recomendada de Zibor
La administración de una dosis excesiva de Zibor puede causar sangrado. Si ocurre sangrado, debe informar inmediatamente a su médico o acudir al hospital más cercano con esta hoja de instrucciones.
Omisión de una dosis de Zibor
No debe tomar una dosis doble para compensar una dosis omitida. Debe comunicarse lo antes posible con su médico para obtener información sobre el procedimiento recomendado.
Interrupción del tratamiento con Zibor
Antes de interrumpir el tratamiento con Zibor, siempre debe consultar a su médico.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, Zibor puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de que ocurran los siguientes efectos adversos, debe interrumpir inmediatamente el tratamiento con Zibor e informar a su médico o enfermera (o acudir inmediatamente al departamento de emergencias del hospital más cercano):
Frecuentes (pueden ocurrir en 1 de cada 10 pacientes):
- Complicaciones hemorrágicas, por ejemplo, sangre en la orina y (o) heces, que pueden causar anemia hemorrágica.
Poco frecuentes (pueden ocurrir en 1 de cada 1000 pacientes):
- Reducción grave del número de plaquetas (trombocitopenia tipo II) que puede causar moretones, sangrado en la boca, encías y nariz, y erupciones cutáneas.
- Cambios cutáneos oscuros y dolorosos en el lugar de la inyección (necrosis cutánea).
- Hematoma espinal después de anestesia epidural, intratecal o punción lumbar, que puede causar daño neurológico de diferentes grados, incluyendo parálisis transitoria o persistente.
- Reacciones alérgicas graves (fiebre, escalofríos, dificultad para respirar, hinchazón de la glotis, sensación de pérdida de conciencia, sudoración, urticaria, picazón, caída de la presión arterial, sofocos, pérdida de conciencia, espasmo bronquial, edema de la glotis).
Otros efectos adversos:
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes)
- Moretones, manchas en la piel, picazón y dolor en el lugar de la inyección del medicamento.
Frecuentes (pueden ocurrir en 1 de cada 10 pacientes):
- Aumento leve y transitorio de la actividad de las aminotransferasas en los análisis de laboratorio.
Poco frecuentes (pueden ocurrir en 1 de cada 100 pacientes):
- Reducción leve y transitoria del número de plaquetas (trombocitopenia tipo I) en los análisis de laboratorio.
- Reacciones alérgicas cutáneas leves: erupciones cutáneas, urticaria, estrías en la piel.
Frecuencia desconocida (no puede estimarse a partir de los datos disponibles):
- Aumento del nivel de potasio en la sangre en los análisis de laboratorio.
Debido al uso prolongado de Zibor o medicamentos con propiedades similares, puede ocurrir osteoporosis. La frecuencia de ocurrencia es desconocida.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos de la Agencia Reguladora de Medicamentos, Al. Jerozolimskie 181C, 02-222 Varsovia, Tel.: +48 22 49 21 301, Fax: +48 22 49 21 309, sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Zibor
Debe conservar el medicamento en un lugar fuera del alcance de los niños.
No debe conservar a una temperatura superior a 25°C. No congelar.
No debe usar este medicamento si:
- el paquete protector ha sido abierto.
- el paquete protector ha sido dañado.
- el contenido de la jeringa precargada es turbio.
- contiene pequeñas partículas.
Después de abrir el paquete que contiene la jeringa precargada de Zibor, debe usarla inmediatamente.
Fecha de caducidad
No debe usar este medicamento Zibor después de la fecha de caducidad indicada en el paquete después de "Fecha de caducidad".
La fecha de caducidad es el último día del mes indicado.
Eliminación
Contenedor de dosis única.
Las jeringas precargadas usadas deben desecharse en un contenedor para objetos punzocortantes.
No debe conservar las jeringas precargadas usadas.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Zibor
- El principio activo del medicamento es bemiparina sódica.
- El otro componente es agua para inyección.
Cómo se presenta Zibor y qué contiene el paquete
El medicamento en la jeringa precargada es una solución incolora o ligeramente amarillenta, transparente, sin contaminantes visibles.
Zibor 25 000 UI está disponible en paquetes que contienen 2, 10, 30 y 100 jeringas precargadas que contienen 0,2 mL, 0,3 mL o 0,4 mL de solución para inyección.
No todos los tamaños de paquete pueden estar disponibles.
Cada jeringa precargada de 0,2 mL contiene una dosis de 5 000 UI anty-Xa de bemiparina sódica.
Cada jeringa precargada de 0,3 mL contiene una dosis de 7 500 UI anty-Xa de bemiparina sódica.
Cada jeringa precargada de 0,4 mL contiene una dosis de 10 000 UI anty-Xa de bemiparina sódica.
Título del responsable y fabricante
Responsable
GINELADIUS, S.L.
Rufino González 50,
28037 Madrid, España
+(34) 91 375 62 30
Fabricante
Laboratorios Farmacéuticos ROVI, S.A.
Julián Camarillo, 35
28037 Madrid, España
ROVI Pharma Industrial Services, S.A.
Julián Camarillo Nº 35
28037 Madrid, España
Este medicamento está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Ivor:Italia, Portugal.
Zibor:República Checa, Estonia, Irlanda, Letonia, Lituania, Polonia, Rumania, Eslovaquia, Eslovenia, Reino Unido.
Phivor:España.
Fecha de la última revisión de la hoja de instrucciones:
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorLaboratorios Farmaceuticos Rovi, S.A. Rovi Pharma industrial Services, S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a ZiborForma farmacéutica: Polvo, 500 UIPrincipio activo: Antitrombina iiiFabricante: Instituto Grifols S.A.No requiere receta
Alternativas a Zibor en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Zibor en España
Alternativa a Zibor en Ucrania
Médicos online para Zibor
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Zibor – sujeta a valoración médica y normativa local.














