
Ticagrelor Iolsten

Consulta con un médico sobre la receta médica de Ticagrelor Iolsten

Cómo usar Ticagrelor Iolsten
CARACTERÍSTICAS DEL PRODUCTO FARMACÉUTICO
1. NOMBRE DEL PRODUCTO FARMACÉUTICO
Ticagrelor Holsten, 60 mg, tabletas recubiertas
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada tableta recubierta contiene 60 mg de ticagrelor.
Lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Tableta recubierta.
Redondas (8,1 x 8,1 mm), biconvexas, tabletas rosadas con el número "60" grabado en una cara y lisa en la otra cara.
4. DATOS CLÍNICOS DETALLADOS
4.1 Indicaciones terapéuticas
El producto farmacéutico Ticagrelor Holsten, en combinación con ácido acetilsalicílico (AAS), está indicado para la prevención de eventos cardiovasculares en pacientes adultos:
- con síndrome coronario agudo (SCA) o
- con infarto de miocardio (IM) en la historia y con alto riesgo de eventos cardiovasculares (ver secciones 4.2 y 5.1).
4.2 Posología y forma de administración
Posología
Pacientes que toman el producto farmacéutico Ticagrelor Holsten deben tomar también una dosis de mantenimiento baja de ácido acetilsalicílico (AAS) de 75-150 mg al día, a menos que esté contraindicado individualmente.
Síndrome coronario agudo
El tratamiento con el producto farmacéutico Ticagrelor Holsten debe iniciarse con una dosis de carga única de 180 mg (2 tabletas de 90 mg) y continuar con una dosis de 90 mg dos veces al día.
En pacientes con SCA, la duración del tratamiento con el producto farmacéutico Ticagrelor Holsten a una dosis de 90 mg dos veces al día debe ser de 12 meses, a menos que haya indicaciones clínicas para interrumpir el tratamiento (ver sección 5.1).
La interrupción de AAS se puede considerar después de 3 meses en pacientes con SCA que han recibido un procedimiento de intervención coronaria percutánea (PCI) y que tienen un mayor riesgo de sangrado. En este caso, la administración de ticagrelor como único agente antiplaquetario debe continuar durante 9 meses (ver sección 4.4).
Infarto de miocardio en la historia
La dosis recomendada del producto farmacéutico Ticagrelor Holsten es de 60 mg dos veces al día, si se requiere un tratamiento prolongado en pacientes con IM en la historia y con alto riesgo de eventos cardiovasculares (ver sección 5.1). El tratamiento se puede iniciar sin interrupción como continuación del tratamiento inicial de 12 meses con el producto farmacéutico Ticagrelor Holsten a una dosis de 90 mg o con otro inhibidor de la receptora de ADP en pacientes con SCA y alto riesgo de eventos cardiovasculares. El tratamiento también se puede iniciar hasta 2 años después del IM o dentro de un año después de la interrupción del tratamiento con un inhibidor previo de la receptora de ADP. Los datos sobre la eficacia y seguridad del uso de ticagrelor más allá de 3 años de tratamiento prolongado son limitados.
Si se requiere un cambio de medicamento, la primera dosis del producto farmacéutico Ticagrelor Holsten debe administrarse 24 horas después de la última dosis del otro agente antiplaquetario.
Omisión de una dosis
También se debe evitar el error de dosificación. En caso de que un paciente olvide una dosis del producto farmacéutico Ticagrelor Holsten, debe tomar solo una tableta (la siguiente dosis) según el esquema de dosificación establecido.
Grupos especiales de pacientes
Pacientes de edad avanzada
No se requiere ajuste de dosis en pacientes de edad avanzada (ver sección 5.2).
Trastornos renales
No se requiere ajuste de dosis en pacientes con trastornos renales (ver sección 5.2).
Trastornos hepáticos
No se han realizado estudios sobre el uso de ticagrelor en pacientes con trastornos hepáticos graves y, por lo tanto, su uso está contraindicado en estos pacientes (ver sección 4.3). Solo hay información limitada disponible sobre el uso del producto en pacientes con trastornos hepáticos moderados. Se recomienda precaución en estos pacientes (ver secciones 4.4 y 5.2). En pacientes con trastornos hepáticos leves, no se requiere ajuste de dosis (ver sección 5.2).
Niños y adolescentes
No se ha establecido la seguridad y eficacia del uso de ticagrelor en niños menores de 18 años.
La administración de ticagrelor en niños no es adecuada para la indicación de anemia falciforme (ver secciones 5.1 y 5.2).
Vía de administración
Administración oral.
El producto farmacéutico Ticagrelor Holsten se puede tomar con o sin alimentos.
En caso de que los pacientes tengan dificultad para tragar la tableta/tabletas, las tabletas se pueden triturar en un polvo fino, mezclar con medio vaso de agua y beber inmediatamente. El vaso debe enjuagarse con agua (otro medio vaso de agua) y beberse nuevamente el contenido.
La tableta/triturada (o tabletas) mezclada con agua también se puede administrar a través de una sonda nasogástrica (CH8 o mayor). Es importante enjuagar la sonda nasogástrica con agua (medio vaso: mínimo 50 ml hasta un máximo de 125 ml) después de la administración de la mezcla.
4.3 Contraindicaciones
- Hipersensibilidad a la sustancia activa o a alguno de los excipientes enumerados en la sección 6.1 (ver sección 4.8).
- 6.1 (ver sección 4.8).
- Hemorragia activa patológica.
- Hemorragia cerebral en la historia (ver sección 4.8).
- Trastorno hepático grave (ver secciones 4.2, 4.4 y 5.2).
- Uso concomitante de ticagrelor y fuertes inhibidores del enzima CYP3A4 (por ejemplo, ketokonazol, claritromicina, nefazodona, ritonavir y atazanavir), ya que puede provocar un aumento significativo de la exposición a ticagrelor (ver sección 4.5).
4.4 Advertencias y precauciones especiales de uso
Riesgo de hemorragia
En pacientes con un mayor riesgo de hemorragia, se debe considerar la relación entre los beneficios y los riesgos de la prevención de eventos cardiovasculares (ver secciones 4.8 y 5.1). En caso de que haya indicaciones clínicas para el uso de ticagrelor, se debe administrar con precaución en los siguientes grupos de pacientes:
- Pacientes con tendencia a hemorragia (por ejemplo, debido a lesiones recientes, procedimientos quirúrgicos, trastornos de la coagulación, hemorragias activas o recientes del tracto gastrointestinal) o con un mayor riesgo de lesión. El uso de ticagrelor está contraindicado en pacientes con hemorragia activa patológica, en pacientes con hemorragia cerebral en la historia y en pacientes con trastornos hepáticos graves (ver sección 4.3).
- Pacientes que toman medicamentos que pueden aumentar el riesgo de hemorragia (por ejemplo, antiinflamatorios no esteroideos (AINE), anticoagulantes orales y/o medicamentos fibrinolíticos) administrados dentro de las 24 horas antes de la administración de la dosis de ticagrelor.
En dos estudios aleatorizados controlados con un grupo de control (TICO y TWILIGHT) en pacientes con SCA que habían recibido un procedimiento de intervención coronaria percutánea (PCI) con un stent que libera fármacos, se demostró que la interrupción de AAS después de 3 meses de terapia antiplaquetaria dual con ticagrelor y AAS, y la continuación del tratamiento con ticagrelor como único agente antiplaquetario durante 9 y 12 meses, redujo el riesgo de hemorragia y no aumentó el riesgo observado de eventos cardiovasculares graves (MACE) en comparación con la continuación de la terapia antiplaquetaria dual. La decisión de interrumpir AAS después de 3 meses y continuar con ticagrelor como único agente antiplaquetario durante 9 meses en pacientes con un mayor riesgo de hemorragia debe basarse en una evaluación clínica que tenga en cuenta el riesgo de hemorragia en relación con el riesgo de eventos trombóticos (ver sección 4.2).
La transfusión de plaquetas no revirtió el efecto antiplaquetario de ticagrelor en voluntarios sanos y es poco probable que sea clínicamente beneficiosa en pacientes con hemorragias.
La administración de desmopresina con ticagrelor no acortó el tiempo de sangrado estándar, por lo que es dudoso que sea eficaz en el tratamiento de incidentes clínicos de hemorragia (ver sección 4.5).
El tratamiento antifibrinolítico (ácido aminocaproico o ácido tranexámico) y/o el tratamiento con factor VIIa recombinante pueden aumentar la hemostasia. El ticagrelor se puede administrar nuevamente si se identifica y controla la causa de la hemorragia.
Procedimientos quirúrgicos
Se debe instruir a los pacientes para que informen a sus médicos y dentistas sobre el uso de ticagrelor antes de someterse a procedimientos quirúrgicos programados y antes de iniciar cualquier nuevo medicamento.
En el estudio PLATO, en pacientes que se sometieron a un bypass aortocoronario (CABG), se observó que en el grupo tratado con ticagrelor hubo más hemorragias que en el grupo tratado con clopidogrel, si el medicamento se interrumpió un día antes del procedimiento, pero si se interrumpió dos o más días antes del procedimiento, el número de hemorragias graves fue similar en ambos grupos (ver sección 4.8). Si un paciente debe someterse a un procedimiento quirúrgico programado y no se desea el efecto antiplaquetario, el ticagrelor debe interrumpirse 5 días antes del procedimiento (ver sección 5.1).
Pacientes con accidente cerebrovascular isquémico en la historia
Pacientes con SCA después de un accidente cerebrovascular isquémico en la historia pueden ser tratados con ticagrelor durante un máximo de 12 meses (estudio PLATO).
No se incluyeron en el estudio PEGASUS pacientes con IM en la historia y con un accidente cerebrovascular isquémico en la historia. Por lo tanto, debido a la falta de datos, no se recomienda tratar a estos pacientes durante más de un año.
Trastornos hepáticos
El uso de ticagrelor en pacientes con trastornos hepáticos graves está contraindicado (ver secciones 4.2 y 4.3). Solo hay experiencia limitada con el uso de ticagrelor en pacientes con insuficiencia hepática moderada, por lo que se recomienda precaución en estos pacientes (ver secciones 4.2 y 5.2).
Pacientes con riesgo de eventos de bradicardia
La monitorización de los parámetros de la electrocardiografía (ECG) en el estudio Holter mostró una mayor frecuencia de pausas ventriculares en la mayoría de los casos asintomáticos durante el tratamiento con ticagrelor en comparación con clopidogrel. Los pacientes con un mayor riesgo de incidentes de bradicardia (por ejemplo, pacientes sin marcapasos con síndrome del nódulo sinusal, con bloqueo auriculoventricular de segundo o tercer grado, o con síncopes relacionados con la bradicardia) fueron excluidos de los estudios principales de seguridad y eficacia del ticagrelor. Por lo tanto, debido a la experiencia clínica limitada, el ticagrelor debe administrarse con precaución en este grupo de pacientes (ver sección 5.1).
Además, se debe tener precaución al administrar ticagrelor concomitante con medicamentos que causen bradicardia. Sin embargo, no hubo evidencia de efectos adversos clínicamente significativos en el estudio PLATO después de la administración concomitante con uno o más medicamentos que causan bradicardia (es decir, 96% de beta-bloqueantes, 33% de antagonistas del calcio diltiazem y verapamilo, y 4% de digoxina) (ver sección 4.5).
En el estudio PLATO, en un subgrupo sometido a un estudio Holter, en pacientes que tomaron ticagrelor, se observaron pausas ventriculares >3 segundos en la fase aguda del SCA más frecuentemente que en pacientes que tomaron clopidogrel. El aumento en la detección de pausas ventriculares durante el tratamiento con ticagrelor fue más pronunciado en pacientes con insuficiencia cardíaca crónica que en la población general en la fase aguda del SCA, pero no en la observación de un mes de tratamiento con ticagrelor, ni en comparación con clopidogrel.
No se observaron consecuencias adversas clínicas significativas asociadas con esta disparidad (incluyendo síncopes o implantes de marcapasos) en este grupo de pacientes (ver sección 5.1).
Después de la comercialización del producto, se han notificado casos de bradicardia y bloqueos AV (ver sección 4.8), principalmente en pacientes con SCA, donde la isquemia del miocardio y los medicamentos administrados concomitante que reducen la frecuencia cardíaca o afectan la conducción cardíaca son factores potenciales que interfieren. Antes de ajustar el tratamiento, se debe evaluar el estado clínico del paciente y los medicamentos administrados concomitante como posibles causas.
Dificultad respiratoria
Pacientes tratados con ticagrelor han notificado dificultad respiratoria. La dificultad respiratoria es generalmente leve a moderada y a menudo se resuelve sin necesidad de interrumpir el medicamento. En pacientes con asma/enfermedad pulmonar obstructiva crónica (EPOC) en la historia, puede ocurrir un aumento del riesgo absoluto de dificultad respiratoria durante el tratamiento con ticagrelor. El ticagrelor debe administrarse con precaución en pacientes con asma y/o EPOC en la historia. El mecanismo de la dificultad respiratoria no se ha explicado. Si un paciente notifica nuevos incidentes de dificultad respiratoria, un aumento en la duración de los incidentes o un empeoramiento de los síntomas de dificultad respiratoria durante el tratamiento con ticagrelor, se debe realizar una evaluación diagnóstica completa y, si el paciente no tolera bien este estado, se debe interrumpir el tratamiento con ticagrelor. Se proporcionan más detalles en la sección 4.8.
Apnéa central del sueño
Después de la comercialización del producto, se han notificado casos de apnéa central del sueño, incluyendo respiración de Cheyne-Stokes. Si se sospecha apnéa central del sueño, se debe considerar una evaluación clínica adicional.
Aumento de la creatinina
Durante el tratamiento con ticagrelor, puede ocurrir un aumento de la creatinina. El mecanismo de este fenómeno no se ha establecido. Se deben realizar controles de la función renal de acuerdo con la práctica clínica habitual. En pacientes con SCA, se recomienda controlar la función renal también después de un mes de iniciar el tratamiento con ticagrelor, con especial atención a pacientes de 75 años o más, pacientes con trastornos renales moderados a graves y aquellos que toman medicamentos de la clase de los antagonistas del receptor de angiotensina (ARB).
Aumento de la uricemia
Durante el tratamiento con ticagrelor, puede desarrollarse hiperuricemia (ver sección 4.8). Se debe tener precaución en pacientes con hiperuricemia o gota en la historia.
Como medida de precaución, se desaconseja el uso de ticagrelor en pacientes con nefropatía por ácido úrico.
Púrpura trombocitopénica trombótica (TTP)
Se han notificado casos de púrpura trombocitopénica trombótica (TTP) muy raros durante el tratamiento con ticagrelor. Se caracteriza por trombocitopenia y anemia hemolítica microangiopática asociada con síntomas neurológicos, trastornos renales o fiebre. La TTP es una enfermedad potencialmente mortal que requiere un tratamiento rápido, incluyendo plasmaféresis.
Alteraciones de las pruebas de función de las plaquetas realizadas para diagnosticar trombocitopenia inducida por heparina (TIP)
En la prueba de activación de plaquetas inducida por heparina (HIPA) utilizada para diagnosticar TIP, los anticuerpos contra el complejo factor plaquetario 4/heparina en el suero del paciente activan las plaquetas de los donantes sanos en presencia de heparina.
Se han notificado resultados falsos negativos de las pruebas de función de las plaquetas (incluyendo la prueba HIPA) utilizadas para diagnosticar TIP en pacientes que toman ticagrelor. Esto se debe a la inhibición del receptor P2Y12 en las plaquetas sanas del donante por el ticagrelor presente en el suero/plasma del paciente. Se requiere información sobre el tratamiento concomitante con ticagrelor para interpretar los resultados de las pruebas de función de las plaquetas utilizadas para diagnosticar TIP.
En pacientes que desarrollan trombocitopenia inducida por heparina, se debe evaluar la relación entre los beneficios y los riesgos del tratamiento continuado con ticagrelor, considerando tanto el estado protrombótico de la TIP como el aumento del riesgo de hemorragia durante el tratamiento concomitante con anticoagulantes y ticagrelor.
Otros
Basándose en la relación observada en el estudio PLATO entre la dosis de mantenimiento de AAS y la eficacia relativa de ticagrelor en comparación con clopidogrel, no se recomienda el uso concomitante de ticagrelor y AAS en dosis de mantenimiento altas (>300 mg) (ver sección 5.1).
Interrupción prematura del tratamiento
La interrupción prematura del tratamiento con cualquier agente antiplaquetario, incluyendo el producto farmacéutico Ticagrelor Holsten, puede resultar en un aumento del riesgo de muerte por causas cardiovasculares, infarto de miocardio o accidente cerebrovascular debido a la enfermedad subyacente. Por lo tanto, se debe evitar la interrupción prematura del tratamiento.
Sodio
El producto farmacéutico Ticagrelor Holsten contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, es esencialmente "libre de sodio".
4.5 Interacciones con otros medicamentos y otras formas de interacción
El ticagrelor es principalmente un sustrato del isoencima CYP3A4 y también un inhibidor suave de este enzima. El ticagrelor también es un sustrato de la glicoproteína P (P-gp) y un inhibidor suave de la P-gp, y puede aumentar la exposición a los sustratos de la P-gp.
Efecto de los medicamentos y otros productos en el ticagrelor
Inhibidores del CYP3A4
- Inhibidores fuertes del CYP3A4: la administración concomitante de ketokonazol y ticagrelor resultó en un aumento de 2,4 veces en la C y 7,3 veces en el AUC del ticagrelor. La C y el AUC del metabolito activo se redujeron en un 89% y un 56%, respectivamente. Se prevé que otros inhibidores fuertes del CYP3A4 (claritromicina, nefazodona, ritonavir y atazanavir) tengan un efecto similar y, por lo tanto, la administración concomitante de inhibidores fuertes del CYP3A4 y ticagrelor está contraindicada (ver sección 4.3).
- Inhibidores moderados del CYP3A4: la administración concomitante de diltiazem y ticagrelor resultó en un aumento del 69% en la C del ticagrelor y un aumento de 2,7 veces en el AUC, así como una reducción del 38% en la C del metabolito activo, sin afectar su AUC. El ticagrelor no afectó los niveles plasmáticos de diltiazem. Otros inhibidores moderados del CYP3A4 (por ejemplo, amprenavir, aprepitant, eritromicina y fluconazol) pueden tener un efecto similar y, por lo tanto, también pueden administrarse concomitantemente con ticagrelor.
- Se observó un aumento de 2 veces en la exposición al ticagrelor después de consumir grandes cantidades de jugo de toronja (3 x 200 ml). No se espera que este aumento en la exposición al ticagrelor sea clínicamente significativo en la mayoría de los pacientes.
Inductores del CYP3A
La administración concomitante de rifampicina y ticagrelor redujo la C y el AUC del ticagrelor en un 73% y un 86%, respectivamente. La C del metabolito activo no se vio afectada, y su AUC se redujo en un 46%. Se prevé que otros inductores del CYP3A (por ejemplo, fenitoína, carbamazepina y fenobarbital) también reduzcan la exposición al ticagrelor. La administración concomitante de ticagrelor y fuertes inductores del CYP3A puede reducir los niveles y la eficacia del ticagrelor, por lo que no se recomienda su administración concomitante.
Ciclosporina (inhibidor de la P-gp y el CYP3A)
La administración concomitante de ciclosporina (600 mg) y ticagrelor aumentó la C del ticagrelor 2,3 veces y su AUC 2,8 veces. En presencia de ciclosporina, el AUC del metabolito activo del ticagrelor aumentó un 32% y la C se redujo un 15%.
No hay datos disponibles sobre la administración concomitante de ticagrelor y otros principios activos que sean inhibidores fuertes de la glicoproteína P (P-gp) y moderados inhibidores del CYP3A4 (por ejemplo, verapamilo, quinidina), que pueden aumentar la exposición al ticagrelor. Si no se puede evitar el tratamiento combinado, su administración concomitante requiere precaución.
Otros
Los estudios clínicos de interacción demostraron que la administración concomitante de ticagrelor con heparina, enoxaparina y AAS o desmopresina no afectó la farmacocinética del ticagrelor o su metabolito activo, o la agregación de plaquetas inducida por ADP en comparación con la administración de ticagrelor solo. Si está clínicamente indicado, los medicamentos que alteran la hemostasia deben administrarse con precaución en combinación con ticagrelor.
En pacientes con SCA tratados con morfina, se observó un retraso y una reducción en la exposición al inhibidor oral de la P2Y, incluyendo ticagrelor y su metabolito activo (reducción de la exposición al ticagrelor en un 35%). Esta interacción puede estar relacionada con la reducción de la motilidad gastrointestinal y también puede aplicarse a otros opioides. El significado clínico de esto es desconocido, pero los datos sugieren la posibilidad de una reducción en la eficacia del ticagrelor en pacientes que reciben ticagrelor y morfina concomitantemente.
En pacientes con SCA que no pueden dejar de tomar morfina y en los que se considera crucial una inhibición rápida de la P2Y, se puede considerar el uso de un inhibidor de la P2Y no oral.
Efecto del ticagrelor en otros medicamentos
Medicamentos metabolizados por el CYP3A4
- Simvastatina: la administración concomitante de ticagrelor y simvastatina resultó en un aumento del 81% en la C de la simvastatina y un aumento del 56% en su AUC, así como un aumento del 64% en la C del ácido simvastatina y un aumento del 52% en su AUC, con casos individuales de aumento de 2 o 3 veces. La administración concomitante de ticagrelor y simvastatina en dosis superiores a 40 mg al día puede resultar en efectos adversos de la simvastatina y, por lo tanto, se debe considerar en la evaluación de los beneficios potenciales de esta combinación. No se observó efecto de la simvastatina en los niveles plasmáticos de ticagrelor. El ticagrelor puede tener un efecto similar en el uso de lovastatina. No se recomienda el uso concomitante de ticagrelor y simvastatina o lovastatina en dosis superiores a 40 mg.
- Atorvastatina: la administración concomitante de atorvastatina y ticagrelor resultó en un aumento del 23% en la C y el AUC del ácido atorvastatina. Se observó un aumento similar en el AUC y la C de todos los metabolitos del ácido atorvastatina. Se considera que esto no es clínicamente significativo.
- No se puede descartar un efecto similar en otras estatinas metabolizadas por el CYP3A4. En el estudio PLATO, los pacientes tomaron varias estatinas y no hubo preocupaciones de seguridad en el 93% de todos los pacientes que participaron en este estudio.
El ticagrelor es un inhibidor moderado del CYP3A4. No se recomienda el uso concomitante de ticagrelor y sustratos del CYP3A4 con un índice terapéutico estrecho (es decir, cisaprida y alcaloides del cornezuelo), ya que el ticagrelor puede aumentar la exposición a estos medicamentos.
Sustratos de la P-gp (incluyendo digoxina, ciclosporina)
La administración concomitante de ticagrelor y digoxina aumentó la C y el AUC de la digoxina en un 75% y un 28%, respectivamente. Los niveles mínimos de digoxina aumentaron aproximadamente un 30% después de la administración concomitante con ticagrelor, con niveles máximos individuales que aumentaron hasta 2 veces. La presencia de digoxina no afectó la C y el AUC del ticagrelor y su metabolito activo. Por lo tanto, se recomienda una monitorización clínica y/o de laboratorio adecuada durante el uso concomitante de medicamentos con un índice terapéutico estrecho que dependen de la P-gp, como la digoxina y el ticagrelor.
El ticagrelor no afectó los niveles plasmáticos de ciclosporina. No se ha estudiado el efecto del ticagrelor en otros sustratos de la P-gp.
Medicamentos metabolizados por el CYP2C9
La administración concomitante de ticagrelor y tolbutamida no resultó en un cambio en los niveles plasmáticos de ninguno de estos medicamentos, lo que sugiere que el ticagrelor no es un inhibidor del CYP2C9 y es poco probable que altere el metabolismo de medicamentos como la warfarina o la tolbutamida a través del CYP2C9.
Rosuvastatina
El ticagrelor puede afectar la eliminación renal de la rosuvastatina, aumentando el riesgo de acumulación de rosuvastatina. Aunque el mecanismo no se conoce, en algunos casos, la administración concomitante de ticagrelor y rosuvastatina resultó en un empeoramiento de la función renal, un aumento de la actividad de la CPK (creatina fosfoquinasa) y rabdomiolisis.
Anticonceptivos orales
La administración concomitante de ticagrelor y levonorgestrel y etinilestradiol resultó en un aumento del 20% en la exposición al etinilestradiol, pero no afectó la farmacocinética del levonorgestrel. No se prevé un efecto clínicamente significativo en la eficacia de los anticonceptivos orales en caso de administración concomitante de levonorgestrel y etinilestradiol con ticagrelor.
Medicamentos que causan bradicardia
Debido a las pausas ventriculares y la bradicardia observadas, generalmente asintomáticas, se debe tener precaución al administrar ticagrelor concomitantemente con medicamentos que causan bradicardia (ver sección 4.4). En el estudio PLATO, no se observaron evidencias de efectos adversos clínicamente significativos después de la administración concomitante con uno o más medicamentos que causan bradicardia (es decir, 96% de beta-bloqueantes, 33% de antagonistas del calcio diltiazem y verapamilo, y 4% de digoxina).
Uso concomitante con otros medicamentos
En los estudios clínicos, el ticagrelor se administró concomitantemente con AAS, inhibidores de la bomba de protones, estatinas, beta-bloqueantes, inhibidores de la enzima convertidora de angiotensina (ECA) y antagonistas del receptor de angiotensina, que se administraron durante un período prolongado debido a la necesidad de tratar enfermedades concomitantes, así como con heparina, heparina de bajo peso molecular y antagonistas de la glicoproteína IIb/IIIa durante un período corto (ver sección 5.1). No se observaron interacciones clínicamente significativas durante el uso de estos medicamentos.
La administración concomitante de ticagrelor y heparina, enoxaparina o desmopresina no afectó el tiempo de tromboplastina parcial activada (aPTT), el tiempo de coagulación activado (ACT) o la determinación de la actividad del factor Xa. Sin embargo, debido a las posibles interacciones farmacodinámicas, se debe tener precaución al administrar ticagrelor concomitantemente con medicamentos que alteran la hemostasia.
Debido a las hemorragias cutáneas anormales observadas durante el uso de inhibidores selectivos de la recaptación de serotonina (ISRS) (es decir, paroxetina, sertralina y citalopram), se debe tener precaución al administrar ISRS concomitantemente con ticagrelor, ya que puede aumentar el riesgo de hemorragia.
4.6 Efectos sobre la fertilidad, el embarazo y la lactancia
Mujeres en edad reproductiva
Las mujeres en edad reproductiva deben usar métodos anticonceptivos adecuados para evitar el embarazo durante el tratamiento con ticagrelor.
Embarazo
No hay datos o hay datos limitados sobre el uso de ticagrelor durante el embarazo. Los estudios en animales han demostrado un efecto perjudicial en la reproducción (ver sección 5.3). No se recomienda el uso de ticagrelor durante el embarazo.
Lactancia
Los datos farmacodinámicos y toxicológicos disponibles de los estudios en animales han demostrado que el ticagrelor y sus metabolitos activos pasan a la leche (ver sección 5.3). No se puede descartar el riesgo para los recién nacidos/lactantes. Se debe tomar una decisión para interrumpir la lactancia o terminar/interrumpir el tratamiento con ticagrelor, considerando los beneficios de la lactancia para el niño y los beneficios del tratamiento para la mujer.
Fertilidad
En los animales, el ticagrelor no afecta la fertilidad de los machos o las hembras (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y usar máquinas
El ticagrelor no tiene o tiene un efecto mínimo en la capacidad para conducir y usar máquinas. Se han notificado casos de mareo y confusión en pacientes tratados con ticagrelor. Por lo tanto, los pacientes que experimenten estos síntomas deben tener precaución al conducir o usar máquinas.
4.8 Efectos adversos
Resumen del perfil de seguridad
El perfil de seguridad del ticagrelor se evaluó en los resultados de dos grandes estudios de fase 3 (PLATO y PEGASUS), que incluyeron a más de 39 000 pacientes (ver sección 5.1).
En el estudio PLATO, en pacientes que recibieron ticagrelor, se observó una mayor frecuencia de interrupción del tratamiento debido a eventos adversos que en el grupo que recibió clopidogrel (7,4% frente a 5,4%).
En el estudio PEGASUS, en pacientes que recibieron ticagrelor, se observó una mayor frecuencia de interrupción del tratamiento debido a eventos adversos en comparación con los pacientes tratados con AAS en monoterapia (16,1% en el grupo tratado con ticagrelor a una dosis de 60 mg en combinación con AAS frente a 8,5% en el grupo que recibió AAS en monoterapia). Los eventos adversos más frecuentemente notificados en pacientes tratados con ticagrelor fueron hemorragia y dificultad respiratoria (ver sección 4.4).
Tabla de eventos adversos
A continuación se presentan los eventos adversos identificados en los estudios o notificados después de la comercialización del ticagrelor (tabla 1).
Eventos adversos clasificados según la clasificación de sistemas y órganos (SOC) de MedDRA. Dentro de cada grupo SOC, los eventos adversos se ordenan según su frecuencia de aparición.
La frecuencia se define de la siguiente manera: muy frecuente (≥1/10), frecuente (≥1/100 a <1>Tabla 1 – Eventos adversos presentados según la frecuencia de aparición y la clasificación de sistemas y órganos (SOC)
| Clasificación de sistemas y órganos | Muy frecuente | Frecuente | Poco frecuente | Frecuencia no conocida |
| Tumores benignos y malignos, así como quistes y pólipos | Hemorragias del tumor | |||
| Trastornos de la sangre y del sistema linfático | Trastornos de la sangre, hemorragias | Púrpura trombocitopénica trombótica | ||
| Trastornos del sistema inmunológico | Hipersensibilidad, incluyendo edema angioneurótico | |||
| Trastornos del metabolismo y la nutrición | Hiperuricemia | Gota/ artritis gotosa | ||
| Trastornos psiquiátricos | Desorientación | |||
| Trastornos del sistema nervioso | Mareo, síncopes, cefalea | Hemorragia cerebral | ||
| Trastornos oculares | Hemorragia ocular | |||
| Trastornos del oído y del vestíbulo | Mareo de origen vestibular | Hemorragia del oído | ||
| Trastornos cardíacos | Bradicardia, bloqueo AV |
| Clasificación de sistemas y órganos | Muy frecuente | Frecuente | Poco frecuente | Frecuencia no conocida |
| Trastornos vasculares | Hipotensión | |||
| Trastornos respiratorios, torácicos y mediastínicos | Dificultad respiratoria | Hemorragias del tracto respiratorio | ||
| Trastornos gastrointestinales | Hemorragia del tracto gastrointestinal, diarrea, náuseas, dispepsia, estreñimiento | Hemorragia retroperitoneal | ||
| Trastornos de la piel y del tejido subcutáneo | Hemorragias cutáneas o en la piel, erupción, prurito | |||
| Trastornos musculoesqueléticos y del tejido conjuntivo | Hemorragias musculares | |||
| Trastornos renales y urinarios | Hemorragia del tracto urinario | |||
| Trastornos del sistema reproductor y de la mama | Hemorragias del tracto reproductor | |||
| Exploraciones | Aumento de la creatinina en sangre | |||
| Lesiones, intoxicaciones y complicaciones de procedimientos | Hemorragia postoperatoria, hemorragias traumáticas |
Descripción de eventos adversos seleccionados
Hemorragias
Resultados del estudio PLATO sobre hemorragias
El resultado general de la frecuencia de hemorragias en el estudio PLATO se presenta en la tabla 2.
Tabla 2 – Análisis de todos los eventos hemorrágicos, valores estimados mediante el método de Kaplan-Meier después de 12 meses (PLATO)
| Ticagrelor 90 mg dos veces al día N=9235 | Clopidogrel N=9186 | Valor p* | |
| Hemorragias graves en general, PLATO | 11,6 | 11,2 | 0,4336 |
| Hemorragias graves que ponen en peligro la vida o que pueden ser mortales, PLATO | 5,8 | 5,8 | 0,6988 |
| Hemorragias graves no relacionadas con CABG, PLATO | 4,5 | 3,8 | 0,0264 |
| Hemorragias graves no relacionadas con procedimientos, PLATO | 3,1 | 2,3 | 0,0058 |
| Hemorragias graves + leves en general, PLATO | 16,1 | 14,6 | 0,0084 |
| Hemorragias graves + leves no relacionadas con procedimientos, PLATO | 5,9 | 4,3 | <0,0001 |
| Hemorragias graves según la definición de TIMI | 7,9 | 7,7 | 0,5669 |
| Hemorragias graves + leves según la definición de TIMI | 11,4 | 10,9 | 0,3272 |
El ticagrelor y el clopidogrel no difirieron en cuanto a la frecuencia de hemorragias graves que ponen en peligro la vida o que pueden ser mortales según la definición de PLATO, hemorragias graves en general según la definición de PLATO, hemorragias graves según la definición de TIMI o hemorragias leves según la definición de TIMI (tabla 2). Sin embargo, se observaron más hemorragias graves y leves en general según la definición de PLATO en el grupo que recibió ticagrelor que en el grupo que recibió clopidogrel. De manera similar, cuando se excluyeron todas las hemorragias relacionadas con procedimientos, se observaron más hemorragias en el grupo que recibió ticagrelor que en el grupo que recibió clopidogrel (tabla 2). La interrupción del tratamiento debido a hemorragias no relacionadas con procedimientos ocurrió con más frecuencia en el grupo que recibió ticagrelor (2,9%) que en el grupo que recibió clopidogrel (1,2%; p<0,001).
Hemorragia relacionada con CABG:
En el estudio PLATO, en el 42% de los 1584 pacientes (12% de la cohorte) que se sometieron a un procedimiento de intervención coronaria percutánea (PCI) con un stent que libera fármacos, se observó una hemorragia grave que pone en peligro la vida o que puede ser mortal según la definición de PLATO, sin diferencias entre los grupos de tratamiento. La hemorragia después de CABG que resultó en la muerte ocurrió en 6 pacientes en cada grupo de tratamiento (ver sección 4.4).
Hemorragias no relacionadas con CABG y hemorragias no relacionadas con procedimientos:
El ticagrelor y el clopidogrel no difirieron en cuanto a la frecuencia de hemorragias graves que ponen en peligro la vida o que pueden ser mortales no relacionadas con CABG según la definición de PLATO, sin embargo, se observaron más hemorragias graves en general según la definición de PLATO, hemorragias graves según la definición de TIMI y hemorragias graves + leves según la definición de TIMI en el grupo que recibió ticagrelor. De manera similar, cuando se excluyeron todas las hemorragias relacionadas con procedimientos, se observaron más hemorragias en el grupo que recibió ticagrelor que en el grupo que recibió clopidogrel (tabla 2).
Hemorragias cerebrales:
En el estudio PLATO, se observó un mayor número de hemorragias cerebrales no relacionadas con procedimientos en el grupo que recibió ticagrelor (n=27 hemorragias en 26 pacientes, 0,3%) que en el grupo que recibió clopidogrel (n=14 hemorragias, 0,2%), incluyendo 11 hemorragias en el grupo que recibió ticagrelor y 1 en el grupo que recibió clopidogrel que resultaron en la muerte. No se observaron diferencias en cuanto a la frecuencia de hemorragias que resultaron en la muerte.
Resultados del estudio PEGASUS sobre hemorragias
El resultado general de los eventos hemorrágicos en el estudio PEGASUS se presenta en la tabla 3.
Tabla 3 – Análisis de todos los eventos hemorrágicos, valores estimados mediante el método de Kaplan-Meier
4.9 Sobredosis
Ticagrelor es bien tolerado después de una dosis única de hasta 900 mg. En un estudio de dosis única creciente, el efecto tóxico en el tracto gastrointestinal fue dependiente de la dosis. Entre las otras reacciones adversas clínicamente significativas que pueden ocurrir después de una sobredosis, se incluyen dificultad para respirar y pausas ventriculares (ver sección 4.8). En caso de sobredosis, pueden ocurrir las reacciones adversas potenciales mencionadas anteriormente y se debe considerar el monitoreo de un electrocardiograma (ECG). Actualmente, no se conoce un antídoto que revierta los efectos de ticagrelor, y ticagrelor no se elimina durante la diálisis (ver sección 5.2). El tratamiento de la sobredosis debe realizarse de acuerdo con la práctica médica estándar local. El efecto esperado de la sobredosis de ticagrelor es un aumento en el riesgo de sangrado prolongado, relacionado con la inhibición de las plaquetas. Es poco probable que la transfusión de plaquetas sea beneficiosa clínicamente en pacientes con sangrado (ver sección 4.4). Si ocurre sangrado, se debe iniciar otro tratamiento de apoyo adecuado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: medicamentos que inhiben la agregación de plaquetas, excluyendo la heparina, código ATC: B01AC24 Mecanismo de acción Ticagrelor Holsten contiene ticagrelor, que pertenece al grupo químico de ciclopentil-triazol-pirimidina (CPTP). Ticagrelor es un antagonista oral, directo, selectivo y reversible de los receptores P2Y12, que evita la activación y la agregación de las plaquetas dependientes del ADP y del receptor P2Y12. Ticagrelor no evita la unión del ADP, pero después de unirse al receptor P2Y12, evita la señalización inducida por el ADP. Dado que las plaquetas participan en la iniciación y/o progresión de las complicaciones trombóticas de la aterosclerosis, se ha demostrado que la inhibición de la función de las plaquetas reduce el riesgo de eventos cardiovasculares, como la muerte, el infarto de miocardio o el accidente cerebrovascular. Ticagrelor también aumenta las concentraciones locales de adenozina endógena al inhibir el transportador de nucleósidos equilibrado 1 (ENT-1, por sus siglas en inglés). Se ha demostrado que ticagrelor potencia las acciones dependientes de la adenozina en voluntarios sanos y pacientes con enfermedad arterial coronaria: la vasodilatación (medida como un aumento en el flujo coronario en voluntarios sanos y pacientes con enfermedad arterial coronaria; cefalea), la inhibición de la función de las plaquetas (en sangre total humana in vitro) y la dificultad para respirar. Sin embargo, la relación entre el aumento observado en la adenozina y los efectos clínicos (por ejemplo, morbilidad/mortalidad) no se ha establecido claramente. Acción farmacodinámica Inicio de la acciónEn pacientes con enfermedad arterial coronaria estable que reciben ácido acetilsalicílico, ticagrelor muestra un inicio rápido de la acción farmacológica, como se demuestra por una inhibición media de la agregación de las plaquetas (IPA) del 41% después de 30 minutos de la administración de una dosis de carga de 180 mg de ticagrelor, con un efecto máximo de IPA del 89% después de 2 a 4 horas de la administración del medicamento, que se mantiene desde las 2 hasta las 8 horas después de la administración. En el 90% de los pacientes, el grado más alto de inhibición de las plaquetas, que supera el 70%, se observa después de 2 horas de la administración del medicamento. Fin de la acciónSi se planea realizar una intervención coronaria percutánea (PCI), el riesgo de sangrado asociado con ticagrelor es mayor en comparación con clopidogrel después de suspender el tratamiento durante menos de 96 horas antes del procedimiento. Datos de cambio de terapiaEl cambio de clopidogrel a una dosis de 75 mg a ticagrelor a una dosis de 90 mg dos veces al día resulta en un aumento de la IPA en un 26,4% en números absolutos, y el cambio de ticagrelor a clopidogrel resulta en una disminución de la IPA en un 24,5% en números absolutos. Los pacientes pueden cambiar de clopidogrel a ticagrelor sin perturbar la acción antiplaquetaria (ver sección 4.2). Eficacia y seguridad en estudios clínicos Los datos clínicos que respaldan la eficacia y la seguridad de ticagrelor proceden de dos estudios de fase 3:
- del estudio PLATO [ Inhibición de las plaquetas y resultados del paciente], en el que se comparó ticagrelor con clopidogrel, con ambos medicamentos administrados en combinación con ASA (ácido acetilsalicílico) y con otros tratamientos estándar;
- del estudio PEGASUS TIMI-54 [ Prevención con ticagrelor de eventos trombóticos secundarios en pacientes con síndrome coronario agudo de alto riesgo], en el que se comparó ticagrelor en combinación con ASA con ASA en monoterapia.
Estudio PLATO (síndrome coronario agudo)El estudio PLATO incluyó a 18 624 pacientes con síndrome coronario agudo que se presentaron dentro de las 24 horas después del inicio de los síntomas de angina inestable (UA), infarto de miocardio sin elevación del segmento ST (NSTEMI) o infarto de miocardio con elevación del segmento ST (STEMI) y que habían sido tratados previamente con medicamentos, o habían sido sometidos a una intervención coronaria percutánea (PCI) o a un injerto de bypass coronario (CABG). Eficacia clínicaEn combinación con una dosis diaria de ASA, ticagrelor a una dosis de 90 mg dos veces al día mostró una ventaja sobre clopidogrel a una dosis de 75 mg al día en la prevención del punto final compuesto de muerte por causas cardiovasculares, infarto de miocardio o accidente cerebrovascular, y la diferencia se debió principalmente al número de muertes por causas cardiovasculares y de infartos de miocardio. Los pacientes recibieron clopidogrel a una dosis inicial de 300 mg (en pacientes sometidos a una intervención coronaria percutánea, la dosis inicial podía ser de 600 mg) o ticagrelor a una dosis de 180 mg. Este resultado se obtuvo temprano (reducción absoluta del riesgo [ARR] del 0,6% y reducción relativa del riesgo [RRR] del 12% en el día 30), y la eficacia del tratamiento se mantuvo durante todo el período de 12 meses, alcanzando una ARR del 1,9% en un año y una RRR del 16%. Estos resultados indican que el tiempo adecuado de tratamiento con ticagrelor a una dosis de 90 mg dos veces al día es de 12 meses (ver sección 4.2). El tratamiento de 54 pacientes con enfermedad arterial coronaria con ticagrelor en lugar de clopidogrel evitó 1 evento cardiovascular; el tratamiento de 91 pacientes evitó 1 muerte por causas cardiovasculares (ver gráfico 1 y tabla 4). Los mejores resultados del tratamiento con ticagrelor en comparación con clopidogrel se observaron de manera coherente en muchos subgrupos de pacientes, incluyendo el peso corporal, el sexo, la diabetes en su historial, los ataques isquémicos transitorios o el accidente cerebrovascular no relacionado con hemorragia o la revascularización; el tratamiento concomitante con heparina, inhibidores de la glicoproteína IIb/IIIa e inhibidores de la bomba de protones (ver sección 4.5); el diagnóstico clínico final (STEMI, NSTEMI o UA) y el plan de tratamiento previsto en el momento de la randomización (tratamiento invasivo o conservador). Con una significación estadística baja, el efecto del tratamiento varió según la región, por lo que la razón de riesgo (HR) para el punto final principal sugiere beneficios con el uso de ticagrelor en todo el mundo, excepto en América del Norte, que representa alrededor del 10% de la población total del estudio, donde el resultado de HR es más favorable para clopidogrel (presencia de interacción p = 0,045). Los análisis de factores sugieren la posibilidad de una relación con la dosis de ASA, lo que significa que se observó una disminución en la eficacia de ticagrelor con el aumento de las dosis de ASA. Las dosis de ASA para el tratamiento a largo plazo con ticagrelor deben ser de 75 a 150 mg (ver secciones 4.2 y 4.4). El gráfico 1 muestra la estimación del riesgo de ocurrencia del primer evento del punto final compuesto de muerte por causas cardiovasculares, infarto de miocardio y accidente cerebrovascular para la evaluación de la eficacia.
Gráfico 1 – Análisis del punto final clínico principal compuesto por muerte por causas cardiovasculares, infarto de miocardio y accidente cerebrovascular (PLATO)
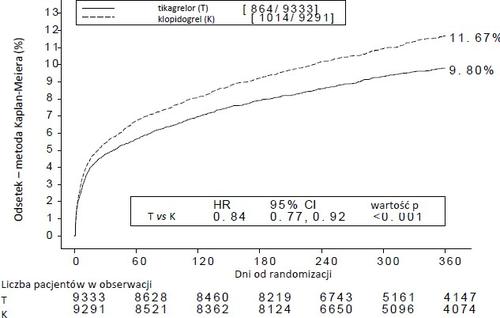
Ticagrelor redujo la frecuencia de ocurrencia del punto final compuesto principal en comparación con clopidogrel, en ambos grupos de pacientes con UA/NSTEMI y STEMI (tabla 4). Por lo tanto, el medicamento ticagrelor a una dosis de 90 mg dos veces al día, en combinación con ASA a dosis bajas, se puede utilizar en pacientes con enfermedad arterial coronaria (angina inestable, infarto de miocardio sin elevación del segmento ST [NSTEMI] o infarto de miocardio con elevación del segmento ST [STEMI]), incluyendo a aquellos que reciben tratamiento médico y a aquellos que se someten a una intervención coronaria percutánea (PCI) o a un injerto de bypass coronario (CABG).
Tabla 4 - Análisis de los puntos finales principales y secundarios de la evaluación de la eficacia (PLATO)
| Ticagrelor 90 mg dos veces al día (% de pacientes a los que se presentó el evento) N=9333 | Clopidogrel 75 mg al día (% de pacientes a los que se presentó el evento) N=9291 | ARRa (%/año) | RRRa (%)(IC del 95%) | Valor de p |
| al que se presentó el evento | al que se presentó el evento | ||||
| Muerte por causas cardiovasculares, infarto de miocardio (excepto infarto de miocardio silente) o accidente cerebrovascular | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plan de tratamiento invasivo | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plan de tratamiento conservador | 11,3 | 13,2 | 2,3 | 15 (0,3, 27) | 0,0444 |
| Muerte por causas cardiovasculares | 3,8 | 4,8 | 1,1 | 21 (9, 31) | 0,0013 |
| Infarto de miocardio (excepto infarto de miocardio silente) | 5,4 | 6,4 | 1,1 | 16 (5, 25) | 0,0045 |
| Accidente cerebrovascular | 1,3 | 1,1 |
|
| 0,2249 |
| Muerte por cualquier causa, infarto de miocardio (excepto infarto de miocardio silente) o accidente cerebrovascular | 9,7 | 11,5 | 2,1 | 16 (8, 23) | 0,0001 |
| Muerte por causas cardiovasculares, infarto de miocardio total, accidente cerebrovascular, SRI, RI, TIA o otros ATE | 13,8 | 15,7 | 2,1 | 12 (5, 19) | 0,0006 |
| Muerte por cualquier causa | 4,3 | 5,4 | 1,4 | 22 (11, 31) | 0,0003 |
| Trombosis del stent | 1,2 | 1,7 | 0,6 | 32 (8, 49) | 0,0123 |
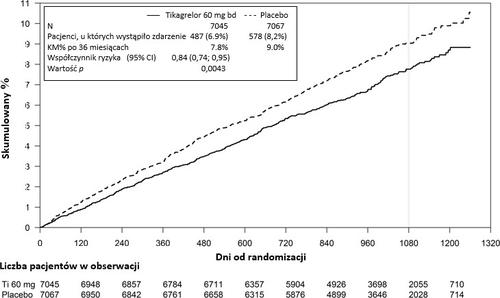
Análisis genético subestudio en el estudio PLATOLa tipificación genética para CYP2C19 y ABCB1, realizada en el estudio PLATO en 10 285 pacientes, permitió determinar la relación entre los grupos genotípicos y los resultados del estudio PLATO. La superioridad de ticagrelor sobre clopidogrel en la reducción del número de eventos cardiovasculares graves no fue significativamente dependiente del genotipo CYP2C19 o ABCB1. Al igual que en el estudio PLATO completo, el número total de hemorragias graves según la definición de PLATO no difirió entre el grupo de ticagrelor y el grupo de clopidogrel, independientemente del genotipo CYP2C19 o ABCB1. Las hemorragias graves según la definición de PLATO, no relacionadas con CABG, fueron más frecuentes en el grupo de ticagrelor que en el grupo de clopidogrel en pacientes con pérdida de uno o más alelos funcionales CYP2C19, pero similares al grupo de clopidogrel en pacientes sin pérdida de alelos funcionales. Evaluación combinada de la eficacia y la seguridadLa evaluación combinada de la eficacia y la seguridad (muerte por causas cardiovasculares, infarto de miocardio, accidente cerebrovascular o hemorragia grave según la definición de PLATO) indica que los beneficios de la eficacia de ticagrelor, en comparación con clopidogrel, no se pierden debido al número de hemorragias graves (ARR 1,4%, RRR 8%, HR 0,92; p = 0,0257) durante el período de 12 meses después del síndrome coronario agudo. Seguridad clínicaSubgrupo con estudio de Holter Con el fin de investigar la ocurrencia de pausas ventriculares y otras arritmias durante el estudio PLATO, los investigadores monitorearon con un estudio de Holter a un subgrupo de casi 3000 pacientes, de los cuales se realizaron grabaciones en aproximadamente 2000 en la fase aguda del síndrome coronario agudo y después de un mes. La variable observada principal fue la ocurrencia de pausas ventriculares ≥ 3 segundos. Se observó un mayor número de pausas ventriculares en el grupo de ticagrelor (6,0%) que en el grupo de clopidogrel (3,5%) en la fase aguda del síndrome coronario agudo; y después de un mes, 2,2% y 1,6%, respectivamente (ver sección 4.4). El aumento en la frecuencia de pausas ventriculares en la fase aguda del síndrome coronario agudo se observó más claramente en pacientes tratados con ticagrelor con insuficiencia cardíaca congestiva en su historial (9,2% en comparación con el 5,4% de los pacientes sin insuficiencia cardíaca congestiva en su historial; en el caso de clopidogrel, 4,0% de los pacientes con insuficiencia cardíaca congestiva en su historial y 3,6% de los pacientes sin insuficiencia cardíaca congestiva en su historial). Esta disparidad no se produjo después de 1 mes: 2% en comparación con 2,1% en el caso de los pacientes que recibieron ticagrelor, respectivamente con o sin insuficiencia cardíaca congestiva; y 3,8% en comparación con 1,4% en el caso del tratamiento con clopidogrel. No se encontraron consecuencias clínicas adversas asociadas con estas anormalidades (incluyendo el uso de un marcapasos) en este grupo de pacientes. Estudio PEGASUS (infarto de miocardio en su historial)El estudio PEGASUS TIMI-54 fue un estudio aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, de evaluación de puntos finales dependientes del tratamiento, que evaluó la prevención de eventos cardiovasculares mediante el uso de ticagrelor en dos dosis (90 mg o 60 mg dos veces al día) en combinación con ASA a dosis bajas (75-150 mg) en comparación con ASA en monoterapia en pacientes con infarto de miocardio en su historial y con factores de riesgo adicionales para tales eventos. Los pacientes fueron seleccionados para participar en el estudio si tenían al menos 50 años, habían tenido un infarto de miocardio en el pasado (entre 1 y 3 años antes de la randomización) y tenían al menos uno de los siguientes factores de riesgo de eventos trombóticos de etiología aterosclerótica: edad ≥ 65 años, diabetes que requiere tratamiento farmacológico, segundo infarto de miocardio, características de enfermedad coronaria multivascular o insuficiencia renal crónica no terminal. Los pacientes no fueron seleccionados para participar en el estudio si se planeaba administrar un antagonista del receptor P2Y12, dipiridamol, cilostazol o tratamiento anticoagulante durante el estudio; si tenían una condición hemorrágica o habían tenido un accidente cerebrovascular isquémico o una hemorragia intracraneal, un tumor del sistema nervioso central o una anomalía vascular intracraneal en su historial; si habían tenido una hemorragia gastrointestinal en los 6 meses anteriores o habían sido sometidos a una cirugía mayor en los 30 días anteriores. Eficacia clínica
Gráfico 2 – Análisis del punto final clínico principal compuesto por muerte por causas cardiovasculares, infarto de miocardio y accidente cerebrovascular (PEGASUS)
5.2 Propiedades farmacocinéticas
Ticagrelor muestra una farmacocinética lineal, y la exposición a ticagrelor y su metabolito activo (AR-C124910XX) es aproximadamente dependiente de la dosis, en el rango de hasta 1260 mg.
Absorción
La absorción de ticagrelor es rápida, con una mediana del tiempo de máxima concentración (tmax) de aproximadamente 1,5 horas. La formación del metabolito principal circulante AR-C124910XX (también activo) a partir de ticagrelor es rápida, con una mediana de tmax de aproximadamente 2,5 horas. Después de la administración de una dosis oral única de 90 mg de ticagrelor en ayunas a voluntarios sanos, la concentración máxima (C) es de 529 ng/ml y el área bajo la curva (AUC) es de 3451 ng*h/ml. Para el metabolito, los coeficientes relacionados con el compuesto de referencia son 0,28 para C y 0,42 para AUC.
La farmacocinética de ticagrelor y AR-C124910XX en pacientes con infarto de miocardio en su historial fue esencialmente similar a la observada en la población de pacientes con SCA. Según el análisis farmacocinético de la población en el estudio PEGASUS, la mediana de la concentración de ticagrelor en plasma (C) fue de 391 ng/ml y la AUC fue de 3801 ng*h/ml en estado estacionario después de la administración de ticagrelor a una dosis de 60 mg. En el caso de ticagrelor a una dosis de 90 mg, C fue de 627 ng/ml y AUC fue de 6255 ng*h/ml en estado estacionario.
La biodisponibilidad absoluta media de ticagrelor se estimó en un 36%. La ingesta de una comida rica en grasas aumenta la AUC de ticagrelor en un 21% y reduce la C del metabolito activo en un 22%, pero no altera la C de ticagrelor y la AUC del metabolito activo. Se considera que estos pequeños cambios tienen una importancia clínica mínima, por lo que ticagrelor puede administrarse durante las comidas o de forma independiente. Tanto ticagrelor como el metabolito activo son sustratos de la glicoproteína P (P-gp).
Ticagrelor en forma de tabletas trituradas mezcladas con agua, administradas por vía oral o mediante una sonda nasogástrica, tiene una biodisponibilidad comparable a la de la tableta administrada en su totalidad en términos de AUC y C para ticagrelor y el metabolito activo. La exposición inicial (0,5 y 1 hora después de la administración) de ticagrelor en forma de tableta triturada mezclada con agua fue mayor que la de la tableta entera (no triturada), con un perfil de concentraciones esencialmente idéntico en momentos posteriores (desde 2 hasta 48 horas).
Distribución
El volumen de distribución en estado estacionario es de 87,5 l. Ticagrelor y el metabolito activo se unen en gran medida a las proteínas del suero humano (>99,0%).
Metabolismo
La CYP3A4 es la enzima principal responsable del metabolismo de ticagrelor y la formación del metabolito activo, y sus interacciones con otros sustratos del isoencima CYP3A incluyen tanto la activación como la inhibición.
El metabolito principal de ticagrelor, AR-C124910XX, también es activo, como se determinó en estudios in vitro, en los que se une al receptor de plaquetas ADP P2Y.
La exposición sistémica al metabolito activo es de aproximadamente el 30-40% de la exposición a ticagrelor.
Eliminación
La vía principal de eliminación de ticagrelor es el metabolismo hepático. Después de la administración de ticagrelor marcado con radioisótopos, la recuperación media de la radioactividad fue de aproximadamente el 84% (57,8% en las heces y 26,5% en la orina). El ticagrelor y el metabolito activo recuperados en la orina en ambos casos fueron menos del 1% de la dosis administrada. La vía principal de eliminación del metabolito activo es probablemente la excreción en la bilis. El tiempo medio de vida es de aproximadamente 7 horas para ticagrelor y 8,5 horas para el metabolito activo.
Grupos especiales de pacientes
Pacientes de edad avanzada
En los análisis farmacocinéticos de la población, en pacientes de edad avanzada (≥75 años) con SCA se observó una exposición mayor a ticagrelor (un 25% mayor para C y AUC) y al metabolito activo en comparación con pacientes más jóvenes. Se considera que estas diferencias no son clínicamente significativas (ver sección 4.2).
Niños y adolescentes
Hay datos limitados disponibles sobre niños y adolescentes con anemia falciforme (ver sección 4.2 y 5.1).
En el estudio HESTIA 3, a pacientes de 2 a menos de 18 años, que pesaban de ≥12 a ≤24 kg, de >24 a ≤48 kg y >48 kg, se les administró ticagrelor en forma de tabletas de 15 mg que se desintegran en la boca, en dosis de 15, 30 y 45 mg dos veces al día, respectivamente. El análisis farmacocinético de la población mostró que el AUC medio varió de 1095 ng*h/ml a 1458 ng*h/ml, y la C media varió de 143 ng/ml a 206 ng/ml en estado estacionario.
Sexo
En las mujeres se observó una exposición mayor a ticagrelor y al metabolito activo que en los hombres. Se considera que estas diferencias no son clínicamente significativas.
Trastornos renales
En pacientes con trastornos renales graves (aclaramiento de creatinina <30 ml min), la exposición a ticagrelor fue un 20% menor, y al metabolito activo 17% mayor que en pacientes con función renal normal.
En pacientes con enfermedad renal terminal en diálisis, los valores de AUC y C de ticagrelor a una dosis de 90 mg administrada en un día sin diálisis fueron un 38% y un 51% mayores, respectivamente, que en pacientes con función renal normal. Un aumento similar de la exposición se observó cuando se administró ticagrelor antes de la diálisis (un 49% y un 61%, respectivamente), lo que indica que ticagrelor no se elimina mediante diálisis. La exposición al metabolito activo aumentó en menor medida (AUC un 13-14%, y C un 17-36%). La acción de ticagrelor que inhibe la agregación de plaquetas fue independiente de la diálisis en pacientes con enfermedad renal terminal y similar a la de pacientes con función renal normal (ver sección 4.2).
Trastornos hepáticos
La C y la AUC de ticagrelor fueron un 12% y un 23% mayores, respectivamente, en pacientes con trastornos hepáticos leves en comparación con sujetos sanos correspondientes, sin embargo, la acción de ticagrelor que inhibe la agregación de plaquetas fue similar en ambos grupos. No es necesario ajustar las dosis en pacientes con trastornos hepáticos moderados. No se han realizado estudios sobre el uso de ticagrelor en pacientes con insuficiencia hepática grave, y no hay información disponible sobre su farmacocinética en pacientes con trastornos hepáticos moderados. En pacientes con un aumento inicial moderado o grave de uno o dos parámetros hepáticos, la concentración de ticagrelor en suero fue similar o ligeramente mayor que en pacientes sin un aumento inicial de estos parámetros. No es necesario ajustar la dosificación en pacientes con trastornos hepáticos moderados (ver secciones 4.2 y 4.4).
Diferencias raciales
En pacientes de origen asiático se observó una biodisponibilidad media un 39% mayor en comparación con pacientes de raza caucásica. En pacientes que se identifican como de raza negra, la biodisponibilidad de ticagrelor es un 18% menor que en pacientes de raza caucásica. En estudios de farmacología clínica en japoneses, se observó una exposición un 40% mayor (y un 20% después del ajuste por peso corporal) a ticagrelor (C y AUC) en comparación con sujetos de raza caucásica. La exposición en pacientes que se identifican como de raza latina fue similar a la de pacientes de raza caucásica.
5.3 Datos preclínicos de seguridad
Los datos preclínicos proceden de estudios farmacológicos convencionales de ticagrelor y su metabolito principal, que se refieren a la seguridad de la farmacoterapia, los estudios de toxicidad después de la administración única y múltiple, y la genotoxicidad potencial, y no muestran un riesgo inaceptable de efectos adversos en humanos.
Después de una exposición equivalente a las condiciones clínicas en varias especies de animales, se observó irritación del tracto gastrointestinal (ver sección 4.8).
En hembras de rata a las que se administró ticagrelor en dosis altas, se observó un aumento en la frecuencia de tumores uterinos (adenocarcinomas) y un aumento en la frecuencia de adenomas hepáticos. El mecanismo de la formación de tumores uterinos en ratas probablemente se debe a una alteración del equilibrio hormonal, que puede llevar a la formación de tumores en ratas. El mecanismo de la formación de adenomas hepáticos es probablemente específico de los roedores y se debe a un aumento de la actividad enzimática en el hígado. Por lo tanto, se considera poco probable que estos casos de carcinogénesis tengan relevancia para humanos.
En ratas se observaron pequeñas anomalías del desarrollo después de la administración de dosis tóxicas a hembras embarazadas (margen de seguridad 5,1). En fetos de conejos se observó un pequeño retraso en la maduración del hígado y el desarrollo del esqueleto cuando se administraron dosis altas a hembras embarazadas sin signos de toxicidad en las hembras embarazadas (margen de seguridad 4,5).
Los estudios en ratas y conejos mostraron un efecto tóxico en la reproducción, con una pequeña reducción del aumento de peso de las hembras embarazadas y una reducción de la supervivencia de los neonatos y un peso al nacer menor, así como un retraso en el crecimiento.
Ticagrelor causó ciclos irregulares (en su mayoría prolongados) en hembras de rata, pero no afectó la fertilidad total en machos y hembras de rata. Los estudios farmacocinéticos realizados con ticagrelor marcado con radioisótopos mostraron que tanto el compuesto en sí como sus metabolitos se excretan en la leche de rata (ver sección 4.6).
6. Datos farmacéuticos
6.1 Lista de excipientes
Núcleo de la tableta
Hipromelosa (E464)
Mannitol (E421)
Celulosa microcristalina (E460)
Carboximetilcelulosa sódica
Estearato de magnesio (E470b)
Cubierta de la tableta
Hipromelosa (E464)
Dióxido de titanio (E171)
Macrogol 400 (E1521)
Talco (E553b)
Óxido de hierro rojo (E172)
6.2 Incompatibilidades farmacéuticas
No aplica.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Este producto farmacéutico no requiere condiciones de conservación especiales en una temperatura determinada; conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del embalaje
Blister transparente de PVC/PVDC/Aluminio y/o blister transparente de PVC/PE/PVDC/Aluminio en una caja de cartón.
Blister de película (con símbolos de sol/luna o sin ellos) en cajas de cartón de 14, 15, 20, 28, 30, 56, 60, 90, 98, 100, 168, 195, 196 y 200 tabletas recubiertas.
No todas las tallas de embalaje deben estar en circulación.
6.6 Precauciones especiales para la eliminación
Todo el producto farmacéutico no utilizado o sus residuos deben eliminarse de acuerdo con los requisitos locales.
7. Titular de la autorización de comercialización
Autorización de comercialización
Holsten Pharma GmbH
Hahnstraße 31-35
60528 Frankfurt del Meno
Alemania
8. Número de autorización de comercialización
Número de autorización:
9. Fecha de la primera autorización de comercialización
Y fecha de renovación de la autorización
Fecha de la primera autorización de comercialización:
10. Fecha de aprobación o revisión del texto de la ficha técnica
Del producto farmacéutico
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGenepharm S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Ticagrelor IolstenForma farmacéutica: Comprimidos, 60 mgPrincipio activo: TicagrelorRequiere recetaForma farmacéutica: Comprimidos, 90 mgPrincipio activo: TicagrelorRequiere recetaForma farmacéutica: Comprimidos, 60 mgPrincipio activo: TicagrelorFabricante: Krka, d.d., Novo mestoRequiere receta
Alternativas a Ticagrelor Iolsten en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Ticagrelor Iolsten en Hiszpania
Alternativa a Ticagrelor Iolsten en Ukraina
Médicos online para Ticagrelor Iolsten
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Ticagrelor Iolsten – sujeta a valoración médica y normativa local.














