
Mirtor
Consulta con un médico sobre la receta médica de Mirtor

Cómo usar Mirtor
Hoja de instrucciones del paquete: información para el paciente
Atención! Debe conservar la hoja de instrucciones. La información en el embalaje primario está en un idioma extranjero.
Mirtor, 30 mg, tabletas que se disuelven en la boca
Mirtazapina
Debe leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Mirtor y para qué se utiliza
- 2. Información importante antes de tomar Mirtor
- 3. Cómo tomar Mirtor
- 4. Posibles efectos adversos
- 5. Cómo conservar Mirtor
- 6. Contenido del embalaje y otra información
1. Qué es Mirtor y para qué se utiliza
Mirtor pertenece a un grupo de medicamentos conocidos como antidepresivos.
Mirtor se utiliza para tratar la depresión en adultos.
Mirtor comienza a actuar después de 1-2 semanas de tratamiento, y después de 2-4 semanas se produce
una mejora en el estado de ánimo. Si después de 2-4 semanas de tratamiento no se produce una mejora o el paciente se siente
peor, debe consultar a un médico. Se proporciona más información en el punto 3 de la sección "Cuándo puede
esperarse una mejora en el estado de ánimo".
2. Información importante antes de tomar Mirtor
Cuándo no debe tomar Mirtor:
- si el paciente es alérgico a la mirtazapina o a alguno de los demás componentes de este medicamento (enumerados en el punto 6). En tal caso, antes de tomar Mirtor, debe ponerse en contacto con un médico lo antes posible.
- si actualmente o en el pasado reciente (en las últimas 2 semanas) se han tomado medicamentos del grupo de inhibidores de la monoaminooxidasa (IMAO).
Advertencias y precauciones
Antes de comenzar a tomar Mirtor, debe discutirlo con un médico o farmacéutico.
Antes de comenzar a tomar Mirtor, debe informar a su médico:
Si el paciente ha experimentado alguna vez una erupción cutánea grave o descamación de la piel, ampollas y (o)
úlceras en la boca después de tomar Mirtor.
Niños y adolescentes
Por lo general, Mirtor no debe administrarse a niños y adolescentes menores de 18 años,
ya que no se ha demostrado su eficacia en ellos. También debe tenerse en cuenta que en pacientes menores de 18 años
hay un mayor riesgo de efectos adversos, como intentos de suicidio, pensamientos suicidas y hostilidad (principalmente agresividad,
comportamiento rebelde y enfado), cuando toman medicamentos de esta clase. Sin embargo, un médico puede recetar Mirtor a pacientes
de esta edad si lo considera necesario. Si un médico ha recetado Mirtor a un paciente menor de 18 años y surgen dudas,
debe consultarse con el médico. En el caso de pacientes menores de 18 años que toman Mirtor, debe informarse al médico si alguno
de los síntomas mencionados anteriormente se desarrolla o empeora. El efecto a largo plazo de Mirtor en la seguridad relacionada con el crecimiento,
la pubertad y el desarrollo cognitivo en este grupo de edad no se ha demostrado hasta ahora. Además, en este grupo de edad, después de la administración de mirtazapina, se han observado con más frecuencia que en pacientes adultos un aumento significativo de peso.
Pensamientos suicidas y empeoramiento de la depresión
Los pacientes con depresión pueden experimentar sometimes pensamientos de autolesión o suicidio.
Estos síntomas o comportamiento pueden empeorar al comienzo del tratamiento con medicamentos antidepresivos,
ya que estos medicamentos comienzan a actuar generalmente después de aproximadamente 2 semanas, a veces más tarde.
Estos síntomas son más probables en:
- pacientes que ya han experimentado pensamientos de autolesión o suicidio en el pasado;
- jóvenes adultos. Los datos de los estudios clínicos muestran un aumento del riesgo de comportamiento suicida en personas menores de 25 años con trastornos psiquiátricos que están siendo tratados con medicamentos antidepresivos. Debe ponerse en contacto con un médico o ir al hospital de inmediato si se producen pensamientos de autolesión o suicidio.
Puede ser útil informar a los familiares o amigossobre la depresión y pedirles que lean esta hoja de instrucciones. El paciente puede pedir que se le informe cuando notes que la depresión o
la ansiedad empeoran o se producen cambios preocupantes en el comportamiento.
También debe tener especial cuidado al tomar Mirtor
- Si se producen o han producido: (Debe informar a su médico sobre la presencia de las siguientes enfermedades antes de comenzar a tomar Mirtor, si no lo ha hecho antes.)
- convulsiones. Si se producen convulsiones o aumenta su frecuencia durante el tratamiento, debe suspenderse el medicamento y ponerse en contacto con un médico de inmediato;
- enfermedades hepáticas, incluyendo la ictericia. Si se produce ictericia, debe suspenderse el medicamento y ponerse en contacto con un médico de inmediato;
- enfermedades renales;
- enfermedades cardíacaso baja presión arterial;
- esquizofrenia. Debe ponerse en contacto con un médico de inmediato si se producen síntomas psicóticos como pensamientos paranoides que empeoran o aumentan de frecuencia;
- depresión maníaca(períodos alternos de estado de ánimo elevado/estimulación y depresión). Si se siente una estimulación excesiva, debe suspenderse el medicamento y ponerse en contacto con un médico de inmediato;
- diabetes(puede ser necesario ajustar la dosis de insulina o otros medicamentos hipoglucémicos);
- enfermedades oculares, como la presión intraocular elevada (glaucoma);
- dificultades para orinar, que pueden deberse a una hiperplasia prostática;
- ciertos trastornos cardíacosque pueden causar cambios en el ritmo cardíaco, infarto de miocardio reciente, insuficiencia cardíaca o tratamiento con ciertos medicamentos que pueden causar alteraciones del ritmo cardíaco.
- Si se producen síntomas de infección, como fiebre de origen desconocido, dolor de garganta, úlceras en la boca, debe suspenderse el medicamento, consultar a un médico de inmediato y realizar un análisis de sangre. En casos raros, estos síntomas pueden ser indicativos de trastornos de la producción de glóbulos sanguíneos por la médula ósea. Estos síntomas son raros, generalmente se producen después de 4-6 semanas de tratamiento.
- Los pacientes ancianos suelen ser más sensibles, especialmente a los efectos adversos de los medicamentos antidepresivos.
- Se han notificado reacciones cutáneas graves, incluyendo el síndrome de Stevens-Johnson (SJS), la necrolisis epidérmica tóxica (TEN), la reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS) durante el tratamiento con mirtazapina. Si el paciente nota alguno de los síntomas descritos en el punto 4 en relación con estas reacciones cutáneas graves, debe suspenderse el medicamento y consultar a un médico de inmediato. Si el paciente ha experimentado alguna vez reacciones cutáneas graves en el pasado, no debe reiniciar el tratamiento con mirtazapina.
Mirtor y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
No debe tomar Mirtor en combinación con:
- inhibidores de la monoaminooxidasa (IMAO), ni antes de que hayan transcurrido dos semanas desde la última dosis de IMAO. Tampoco debe comenzar a tomar IMAO antes de que hayan transcurrido dos semanas desde la última dosis de Mirtor. Los inhibidores de la IMAO incluyen moklobemida, tranylcipromina (medicamentos antidepresivos), selegilina (utilizada en el tratamiento de la enfermedad de Parkinson).
Debe tener cuidado al tomar Mirtor en combinación con:
- otros medicamentos antidepresivos, como los ISRS, venlafaxina y L-triptófano o triptanes(utilizados en el tratamiento de la migraña), tramadol(medicamento analgésico), buprenorfina, linezolid(antibiótico), sales de litio(utilizadas en el tratamiento de ciertos trastornos psiquiátricos), metileno azul(utilizado para reducir los niveles altos de metemoglobina en la sangre) y preparados que contienen hierba de San Juan(preparados herbales utilizados en el tratamiento de la depresión). En pacientes que toman solo Mirtor o en terapia combinada con estos medicamentos, puede producirse muy raramente un síndrome serotoninérgico. Algunos de sus síntomas son fiebre repentina, sudoración, aumento de la frecuencia cardíaca, diarrea, (movimientos musculares no controlados) espasmos musculares, escalofríos, aumento de los reflejos, ansiedad, cambios de humor, pérdida de conciencia. Debe ponerse en contacto con un médico de inmediato si se producen varios de estos síntomas.
- el medicamento antidepresivo nefazodona. Puede aumentar los niveles de Mirtor en la sangre. Debe informar a su médico sobre la ingesta de este medicamento. Puede ser necesario reducir la dosis de Mirtor, y después de suspender el tratamiento con nefazodona, aumentar la dosis de Mirtor.
- medicamentos utilizados para tratar la ansiedad y el insomnio, como las benzodiazepinas.
- medicamentos utilizados para tratar la esquizofrenia, como la olanzapina.
- medicamentos utilizados para tratar la alergia, como la cetirizina.
- medicamentos utilizados para tratar el dolor intenso, como la morfina. Mirtor en combinación con estos medicamentos puede aumentar la somnolencia.
- medicamentos utilizados para tratar infecciones, como los antibióticos (eritromicina), los medicamentos antifúngicos (como el ketconazol) y los medicamentos utilizados para tratar el VIH/SIDA (como los inhibidores de la proteasa del VIH) y los medicamentos utilizados para tratar las úlceras gástricas (como la cimetidina). Si se comienzan a tomar estos medicamentos al mismo tiempo que Mirtor, los niveles de Mirtor en la sangre pueden aumentar. Debe informar a su médico sobre la ingesta de estos medicamentos. Puede ser necesario reducir la dosis de Mirtor, y después de suspender el tratamiento con estos medicamentos, aumentar la dosis de Mirtor.
- medicamentos antiepilépticos, como la carbamazepina y la fenitoína.
- medicamentos utilizados para tratar la tuberculosis, como la rifampicina. En combinación con Mirtor, estos medicamentos pueden reducir los niveles de Mirtor en la sangre. Debe informar a su médico sobre la ingesta de estos medicamentos. Puede ser necesario aumentar la dosis de Mirtor, y después de suspender el tratamiento con estos medicamentos, reducir la dosis de Mirtor.
- medicamentos anticoagulantes, como la warfarina. Mirtor puede aumentar el efecto de la warfarina. Debe informar a su médico sobre la ingesta de estos medicamentos. En el caso de tratamiento combinado con Mirtor, se recomienda el monitoreo de la coagulación sanguínea.
- medicamentos que pueden afectar el ritmo cardíaco, como ciertos antibióticos y medicamentos antipsicóticos.
Mirtor con alimentos y alcohol
Beber alcohol mientras toma Mirtor puede causar somnolencia. Es mejor evitar
consumir alcohol durante el tratamiento con Mirtor.
Mirtor se puede tomar con o sin comida.
Página 3 9Embarazo y lactancia
Si la paciente está embarazada, o en período de lactancia, cree que puede estar embarazada o planea tener
un hijo, debe consultar a un médico o farmacéutico antes de tomar este medicamento.
Las experiencias limitadas sobre el uso de Mirtor en mujeres embarazadas no muestran un aumento del riesgo. Sin embargo, debe tenerse cuidado al tomar el medicamento durante el embarazo.
Si Mirtor se toma durante el embarazo o poco antes del parto, se recomienda la observación del recién nacido debido a la posible aparición de efectos adversos.
Medicamentos similares (del grupo de inhibidores de la recaptación de serotonina - ISRS) tomados por mujeres embarazadas pueden aumentar el riesgo de que el niño desarrolle una enfermedad grave llamada hipertensión pulmonar persistente del recién nacido (PPHN), que causa respiración acelerada y cianosis en el niño. Estos síntomas suelen aparecer en el primer día de vida del niño. Si esto sucede, debe ponerse en contacto de inmediato con la partera y (o) el médico.Conducción de vehículos y manejo de maquinaria
Mirtor puede reducir la alerta y la capacidad de concentración. Durante el tratamiento con Mirtor, debe
evitar realizar tareas potencialmente peligrosas que requieran una atención constante, como conducir vehículos o manejar maquinaria. Si un médico ha recetado Mirtor a un paciente menor de- 18 años, debe asegurarse de que el medicamento no altere la concentración y la alerta del paciente antes de que participe en el tráfico (por ejemplo, al conducir una bicicleta).
Mirtor contiene aspartamo, una fuente de fenilalanina
Este medicamento contiene aspartamo, que es una fuente de fenilalanina. Cada tableta que se disuelve en la boca de 30 mg contiene 6 mg de aspartamo. El aspartamo puede ser perjudicial para los pacientes con fenilcetonuria. Es una enfermedad genética rara en la que la fenilalanina se acumula en el organismo debido a su eliminación anormal.
3. Cómo tomar Mirtor
Este medicamento debe tomarse siempre según las indicaciones de un médico o farmacéutico. En caso de dudas,
debe consultar a un médico o farmacéutico.
Mirtor está disponible en las siguientes dosis: 15 mg, 30 mg y 45 mg.Dosificación
La dosis inicial recomendada es de 15 o 30 mg al día. Después de varios días de tratamiento, el médico puede recomendar
aumentar la dosis a la más adecuada para el paciente (de 15 a 45 mg al día). Por lo general, se utiliza la misma dosis de medicamento en pacientes de diferentes edades. Sin embargo, los pacientes ancianos o aquellos con enfermedades renales y hepáticas pueden requerir una dosis diferente de Mirtor.Cuándo tomar Mirtor
Mirtor debe tomarse todos los días a la misma hora, preferiblemente en una sola dosis
por la noche, antes de acostarse. Sin embargo, el médico puede recomendar tomar dos dosis divididas en el transcurso del día - una por la mañana, otra por la noche antes de dormir. La dosis más grande debe tomarse por la noche, antes de acostarse.Información sobre la ingesta de tabletas que se disuelven en la boca:
Las tabletas de Mirtor deben tomarse por vía oral.
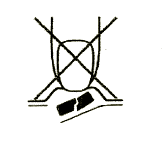
1. No debe partir la tableta que se disuelve en la boca
Para evitar partir la tableta que se disuelve en la boca, no debe presionar el paquete que contiene la tableta (Figura A).
Figura A
Página 4 9
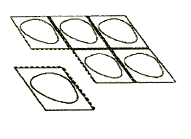
2. Debe separar el paquete con la tableta
Cada blister contiene 6 paquetes con tabletas, separados por una línea de perforación. Debe doblar el blister y separar un paquete a lo largo de la línea de perforación (Figura 1).
Figura 1
3. Debe abrir el paquete
Debe abrir cuidadosamente el paquete que cubre la tableta, comenzando por la esquina marcada con una flecha (Figuras 2 y 3).
Figura 2
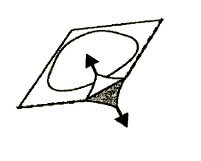
Figura 3
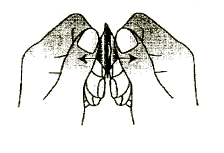
4. Debe sacar la tableta que se disuelve en la boca
Debe sacar la tableta que se disuelve en la boca con la mano seca del paquete y colocarla en
la lengua. (Figura 4).Figura 4
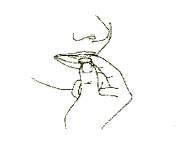
Página 5 9
La tableta se disuelve rápidamente y puede ser tragada sin necesidad de beber agua.Cuándo puede esperarse una mejora en el estado de ánimo
Puede esperarse los primeros signos de efecto del medicamento después de 1-2 semanas de tratamiento, y después de 2-4
semanas puede producirse una mejora en el estado de ánimo.
Es importante que durante las primeras semanas de tratamiento se discuta con el médico los efectos del medicamento
Mirtor:- Después de 2 a 4 semanas desde el inicio del tratamiento con Mirtor, debe discutir con el médico los efectos del tratamiento hasta el momento. Si no hay respuesta clínica adecuada, el médico puede aumentar la dosis. Después de otras 2 a 4 semanas, debe discutir nuevamente con el médico los efectos del tratamiento. El tratamiento debe continuar hasta que los síntomas desaparezcan por completo, lo que generalmente dura de 4 a 6 meses.
Uso de una dosis mayor de la recomendada de Mirtor
En caso de que el paciente o alguien más haya tomado una dosis mayor de la recomendada de Mirtor, debe
ponerse en contacto con un médico de inmediato.
Los signos esperados de sobredosis de Mirtor (sin otros medicamentos y sin alcohol) son somnolencia,
desorientación y taquicardia. Los signos de sobredosis del medicamento pueden incluir cambios en el ritmo cardíaco (taquicardia, ritmo cardíaco irregular) y (o) síncopes. Estos pueden ser signos de trastornos cardíacos potencialmente mortales llamados "torsades de pointes".Olvido de una dosis de Mirtor
En caso de que se olvide tomar una dosis que debe tomarse una vez al día
- no debe tomar una dosis doble para compensar la tableta olvidada. Debe tomar la siguiente dosis a la hora habitual.
Si, por otro lado, el medicamento debe tomarse dos veces al día
- en caso de que se olvide la dosis matutina, debe tomarse junto con la dosis vespertina;
- en caso de que se olvide la dosis vespertina, no debe tomarse junto con la dosis matutina; debe omitirse y continuar con el tratamiento tomando las dosis habituales por la mañana y por la noche;
- en caso de que se olviden ambas dosis, no debe intentar compensarlas; debe omitirlas. Al día siguiente, debe continuar con el tratamiento tomando las dosis habituales por la mañana y por la noche.
Suspensión del tratamiento con Mirtor
Debe dejar de tomar Mirtor solo siguiendo las instrucciones de un médico.
No debe dejar de tomar el medicamento demasiado pronto, ya que puede causar una recaída en la enfermedad. Si se produce una mejora, debe discutirla con un médico. El médico le informará cuándo puede dejar de tomar el medicamento.
La suspensión repentina del tratamiento con Mirtor, incluso si los síntomas de la depresión han desaparecido, puede causar náuseas, mareos, ansiedad o dolor de cabeza. Estos síntomas no se producen durante la suspensión gradual del medicamento. El médico le informará cómo reducir gradualmente las dosis del medicamento.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a un médico o farmacéutico.4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de que se produzcan alguno de los siguientes efectos adversos graves, debe suspenderse el tratamiento con mirtazapina y ponerse en contacto con un médico de inmediato.
No muy frecuentes(pueden producirse en menos de 1 de cada 100 personas):
Página 6 9- aumento del estado de ánimo y actividad mental (mania)
Raros(pueden producirse en menos de 1 de cada 1.000 personas):
- ictericia; puede indicar trastornos de la función hepática (ictericia)
Frecuencia desconocida(la frecuencia no puede determinarse a partir de los datos disponibles):
- signos de infección, como fiebre repentina e inexplicable, dolor de garganta y úlceras en la boca (agranulocitosis). En casos raros, la mirtazapina puede causar trastornos de la producción de glóbulos sanguíneos (supresión de la médula ósea). En algunas personas, puede producirse una menor resistencia a las infecciones, ya que la mirtazapina puede causar una disminución temporal del número de glóbulos blancos (granulocitopenia). En casos raros, la mirtazapina puede causar una disminución del número de glóbulos blancos y rojos, así como del número de plaquetas (anemia aplásica), disminución del número de plaquetas (trombocitopenia) o aumento del número de glóbulos blancos (eosinofilia)
- convulsiones (epilepsia)
- combinación de síntomas como fiebre inexplicable, sudoración, aumento de la frecuencia cardíaca, diarrea, (movimientos musculares no controlados) espasmos musculares, escalofríos, aumento de los reflejos, ansiedad, cambios de humor, pérdida de conciencia y aumento de la salivación. En casos muy raros, estos síntomas pueden indicar el desarrollo de un síndrome serotoninérgico
- pensamientos de autolesión o suicidio
- reacciones cutáneas graves:
- manchas rojizas que parecen un blanco o placas redondas, a menudo con ampollas centrales en el tronco, descamación de la piel, úlceras en la boca, garganta, nariz, genitales y ojos. La aparición de estas reacciones cutáneas graves a menudo está precedida de fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrolisis epidérmica tóxica).
- erupción cutánea generalizada, fiebre alta y ganglios linfáticos inflamados (síndrome de DRESS o síndrome de hipersensibilidad a medicamentos)
Otros efectos adversos posibles incluyen:
Muy frecuentes(pueden producirse en más de 1 de cada 10 personas):
- aumento del apetito y del peso
- calma o somnolencia
- dolor de cabeza
- sequedad en la boca
Frecuentes(pueden producirse en menos de 1 de cada 10 personas):
- letargo
- mareos
- convulsiones o temblores
- náuseas
- diarrea
- vómitos
- estreñimiento
- erupciones cutáneas o exantemas
- dolores en las articulaciones, dolores musculares
- dolores de espalda
- mareos o síncopes al cambiar de posición corporal (hipotensión ortostática)
- hinchazón (generalmente en los tobillos o pies) debido a la acumulación de líquidos (edema)
- fatiga
- sueños vívidos
- desorientación
- ansiedad
- trastornos del sueño
- trastornos de la memoria, que en la mayoría de los casos desaparecen después de suspender el tratamiento
No muy frecuentes(pueden producirse en menos de 1 de cada 100 personas):
Página 7 9- sensaciones cutáneas anormales, como ardor, picazón, entumecimiento o hormigueo (parestesias)
- síndrome de piernas inquietas
- síncopes
- entumecimiento de la boca (anestesia bucal)
- hipotensión
- pesadillas
- agitación
- alucinaciones
- necesidad imperiosa de moverse
Raros(pueden producirse en menos de 1 de cada 1.000 personas):
- movimientos musculares involuntarios o espasmos (convulsiones mioclónicas)
- comportamiento agresivo
- dolores abdominales y náuseas, que pueden indicar pancreatitis
Frecuencia desconocida(la frecuencia no puede determinarse a partir de los datos disponibles):
- sensaciones anormales en la boca (parestesias bucales)
- edema bucal
- edema generalizado
- edema localizado
- deficiencia de sodio en la sangre
- secreción anormal de la hormona antidiurética
- reacciones cutáneas graves (pénfigo, eritema multiforme)
- sonambulismo (somnambulismo)
- trastornos del habla
- niveles elevados de creatina quinasa en la sangre
- dificultades para orinar (retención urinaria)
- dolores musculares, rigidez y (o) debilidad
- oscurecimiento o decoloración de la orina (rabdomiolisis)
- niveles elevados de prolactina en la sangre (hiperprolactinemia, incluyendo síntomas de crecimiento mamario y (o) secreción de leche por los pezones)
- erección prolongada o dolorosa
Efectos adversos adicionales en niños y adolescentes
Los siguientes efectos adversos se han observado con frecuencia en los estudios clínicos con niños menores de 18 años: aumento significativo de peso, urticaria y aumento de los triglicéridos en la sangre.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad,
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Al notificar los efectos adversos, se pueden recopilar más datos sobre la seguridad del medicamento.5. Cómo conservar Mirtor
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe tomar este medicamento después de la fecha de caducidad indicada en el embalaje.
La fecha de caducidad es el último día del mes indicado.
Página 8 9
No hay instrucciones especiales para el almacenamiento.
No debe tomar este medicamento si nota algún cambio de color o otros signos de deterioro.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.6. Contenido del embalaje y otra información
Qué contiene Mirtor
- El principio activo del medicamento es la mirtazapina. Cada tableta que se disuelve en la boca contiene 30 mg de mirtazapina.
- Los demás componentes del medicamento son crospovidona (tipo B), manitol (E 421), celulosa microcristalina, aspartamo (E 951), aroma a fresa y guaraná, aroma a menta, dióxido de silicio coloidal anhidro, estearato de magnesio.
Cómo se presenta Mirtor y qué contiene el embalaje
Tableta que se disuelve en la boca de 30 mg: blanca, redonda, con el número "37" en una cara y la letra "A" en la otra.
30 (5x6) o 90 (15x6) tabletas en blisters de PVC/PA/Al/Poliéster en caja de cartón.
Para obtener información más detallada, debe consultar al titular de la autorización de comercialización o al importador paralelo.Título de la autorización de comercialización en la República Checa, país de exportación:
Orion Corporation, Orionintie 1, FI-02200 Espoo, Finlandia
Fabricante:
Orion Corporation Orion Pharma, Orionintie 1, FI-02200 Espoo, Finlandia
Importador paralelo:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Reempaquetado por:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Número de autorización en la República Checa, país de exportación: 30/415/06-CNúmero de autorización de importación paralela: 90/23 Fecha de aprobación de la hoja de instrucciones: 19.05.2023
[Información sobre la marca registrada]
Página 9 9
- País de registro
- Principio activo
- Requiere recetaSí
- Titular de la autorización de comercialización (TAC, MAH)Orion Corporation
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a MirtorForma farmacéutica: Comprimidos, 15 mgPrincipio activo: mirtazapinaRequiere recetaForma farmacéutica: Comprimidos, 30 mgPrincipio activo: mirtazapinaRequiere recetaForma farmacéutica: Comprimidos, 45 mgPrincipio activo: mirtazapinaRequiere receta
Alternativas a Mirtor en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Mirtor en Іспанія
Alternativa a Mirtor en Україна
Médicos online para Mirtor
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Mirtor – sujeta a valoración médica y normativa local.









