
Maxitrol

Consulta con un médico sobre la receta médica de Maxitrol

Cómo usar Maxitrol
Hoja de instrucciones del paquete: información para el paciente
Atención: conserve esta hoja de instrucciones. La información en el paquete primario está en un idioma extranjero.
Maxitrol, (1 mg + 3500 UI + 6000 UI)/ml, gotas para los ojos, suspensión
Dexametasona + sulfato de neomicina + sulfato de polimixina B
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Maxitrol y para qué se utiliza
- 2. Información importante antes de usar Maxitrol
- 3. Cómo usar Maxitrol
- 4. Posibles efectos adversos
- 5. Cómo conservar Maxitrol
- 6. Contenido del paquete y otra información
1. Qué es Maxitrol y para qué se utiliza
Maxitrol se utiliza para tratar enfermedades inflamatorias de los ojos que pueden estar acompañadas de
infección.La inflamación del ojo puede ser causada por una infección o otros factores que afectan el ojo o lesiones en el ojo.
Maxitrol es un medicamento combinado que contiene componentes antibacterianos y corticosteroides.
Los corticosteroides (en este caso, dexametasona) se utilizan para prevenir y reducir la inflamación del ojo. Los medicamentos antibacterianos en las gotas (en este caso, sulfato de neomicina y sulfato de polimixina B) son efectivos contra la mayoría de las bacterias que causan infecciones del ojo.
2. Información importante antes de usar Maxitrol
Cuándo no usar Maxitrol:
- si el paciente es alérgicoal sulfato de neomicina, sulfato de polimixina B, dexametasona o a cualquier otro componente de este medicamento (enumerado en el punto 6),
- si el paciente tiene:
- herpes simple en la córnea, varicela, sarampión o cualquier otra infección viral del ojo,
- infección fúngica del ojo,
- infección parasitaria del ojo no tratada,
- infección tuberculosa del ojo,
- infección piógena del ojo no tratada.
Advertencias y precauciones
Para uso exclusivo en los ojos.
- En algunos pacientes puede ocurrir sensibilidad a los antibióticos tópicos aminoglucósidos, como la neomicina. Si ocurren síntomas de sensibilidad, debe suspenderse el uso del medicamento y consultar inmediatamente a un médico (véase el punto 4). Las reacciones de sensibilidad pueden ocurrir en forma de picazón local o enrojecimiento de la piel, reacciones alérgicas graves (anafilácticas) o reacciones cutáneas graves. Estas reacciones cutáneas pueden ocurrir durante el uso de otros antibióticos tópicos o sistémicos de la misma familia (aminoglucósidos).
- Además, el uso tópico de neomicina puede causar enrojecimiento, irritación y sensación de incomodidad en la piel.
- En pacientes que han experimentado síntomas de sensibilidad a la neomicina tópica, también puede ocurrir sensibilidad a otros antibióticos.
- Si durante el tratamiento con Maxitrol el paciente está tomando otros antibióticos, debe consultar a un médico, ya que el uso concomitante de Maxitrol con otros antibióticos puede causar efectos adversos graves.
- En pacientes que han estado tomando corticosteroides oculares durante períodos prolongados puede ocurrir: - aumento de la presión intraocular. Es importante controlar regularmente la presión en el ojo durante el uso de este medicamento. Esto es especialmente importante en niños, ya que el aumento de la presión intraocular causado por los corticosteroides puede ser mayor y ocurrir antes en niños que en adultos. Es importante consultar a un médico, especialmente en el caso de niños. El riesgo de aumento de la presión intraocular y (o) cataratas también es mayor en pacientes con antecedentes de diabetes. - desarrollo del síndrome de Cushing causado por el medicamento que entra en la sangre. Es importante consultar a un médico si el paciente experimenta hinchazón y aumento de peso, especialmente en el tronco y la cara, ya que estos son los primeros síntomas de la enfermedad conocida como síndrome de Cushing. La supresión de la función suprarrenal puede ocurrir como resultado de la interrupción del uso prolongado o intensivo de Maxitrol. Es importante consultar a un médico antes de que el paciente decida interrumpir el tratamiento. Este riesgo es especialmente importante en niños y en pacientes que están tomando ritonavir o cobicistat.
- En caso de que el paciente experimente empeoramiento o aparición de síntomas de infección del ojo, debe consultar inmediatamente a un médico. Los pacientes que están tomando Maxitrol pueden tener una respuesta inmune reducida a las infecciones del ojo, incluidas las infecciones bacterianas y fúngicas resistentes a los antibióticos.
- En pacientes que están tomando corticosteroides y medicamentos antiinflamatorios no esteroideos (AINE) pueden ocurrir problemas de curación de lesiones en la superficie del ojo.
- Si el paciente tiene enfermedades que pueden causar adelgazamiento de la córnea o esclera, debe informar a su médico.
Si el paciente experimenta visión borrosa u otros trastornos de la visión, debe consultar a un médico.
Si el paciente tiene glaucoma, el tiempo de tratamiento debe limitarse a dos semanas, a menos que el médico lo indique de otra manera.
El medicamento debe usarse durante el tiempo que el médico lo haya indicado.Si los síntomas de la enfermedad empeoran o no mejoran, debe consultar a un médico.
Niños
No se ha documentado la seguridad y eficacia de Maxitrol en niños, por lo que no se recomienda su uso en este grupo de edad.
Maxitrol y otros medicamentos
El paciente debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los medicamentos sin receta.
Es especialmente importante informar al médico si el paciente está tomando:
- medicamentos antiinflamatorios no esteroideos (AINE) tópicos. El uso concomitante de un medicamento esteroideo y un AINE puede causar problemas de curación de heridas en el ojo;
- ritonavir o cobicistat, ya que pueden aumentar la concentración de dexametasona en la sangre.
Si el paciente está tomando otros medicamentos para los ojos, debe esperar al menos 5 minutos entre las administraciones de los diferentes medicamentos. Los ungüentos para los ojos deben usarse al final.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
El medicamento no es recomendado durante el embarazo o la lactancia.
Conducción de vehículos y uso de máquinas
Maxitrol no tiene efecto o tiene un efecto mínimo en la capacidad de conducir vehículos o usar máquinas.
Durante un tiempo después de la administración de Maxitrol, la visión puede estar borrosa. No debe conducir vehículos ni usar máquinas hasta que este efecto desaparezca.
Maxitrol contiene cloruro de benzalconio
El medicamento contiene 0,04 mg de cloruro de benzalconio por mililitro (0,04 mg/ml).
El cloruro de benzalconio puede ser absorbido por las lentes de contacto blandas y cambiar su color. Debe retirar las lentes de contacto antes de administrar las gotas y esperar al menos 15 minutos antes de volver a colocarlas.
El cloruro de benzalconio también puede causar irritación en los ojos, especialmente en personas con síndrome del ojo seco o trastornos de la córnea (la capa transparente del frente del ojo). Si ocurren sensaciones anormales en el ojo, picazón o dolor en el ojo después de usar el medicamento, debe consultar a un médico.
3. Cómo usar Maxitrol
Maxitrol debe usarse siempre según las indicaciones de su médico. En caso de dudas, debe consultar a su médico o farmacéutico.
Maxitrol está indicado exclusivamentepara administración en los ojos; una sola botella de medicamento debe ser usada por un solopaciente.
Si después de retirar la tapa, el cuello de seguridad está suelto, debe retirarlo antes de usar el medicamento.
Se recomienda cerrar el párpado y presionar suavemente con el dedo el conducto nasolagrimal (conducto lagrimal). Esto ayuda a reducir la absorción del medicamento en la sangre después de su administración en forma de gotas para los ojos.
Dosis recomendada
En enfermedades de curso leve, se administran de una a dos gotas en el saco conjuntival (sacos conjuntivales) de cuatro a seis veces al día.
En casos graves, se administran de una a dos gotas cada hora. El medicamento se administra en dosis cada vez más bajas, y después de que los síntomas de la inflamación hayan desaparecido, se suspende su uso.
El médico determinará el tiempo de tratamiento. No debe interrumpir el tratamiento de manera prematura.
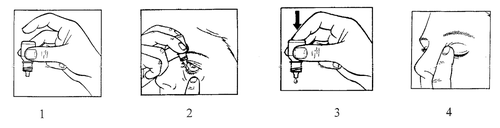
- 1. Preparar el frasco de Maxitrol y un espejo.
- 2. Lavar las manos.
- 3. Agitar el frasco.
- 4. Retirar la tapa.
- 5. Tomar el frasco con la mano y dirigirlo hacia arriba con la base, sosteniéndolo con el pulgar y el dedo índice (figura 1).
- 6. Inclinar la cabeza hacia atrás. Doblar el párpado inferior hacia abajo con un dedo limpio, de modo que se forme una "bolsa" entre el párpado y el globo ocular. La gota debe caer en esta bolsa (figura 2).
- 7. Acercar la punta del frasco al ojo. Para facilitar la tarea, puede usar un espejo.
8. No tocar la punta del gotero con el ojo, el párpado, el área alrededor del ojo ni otras superficies.
No seguir esta recomendación puede causar infección de las gotas.
- 9. Presionar suavemente la base del frasco para que salga una sola gota de Maxitrol (figura 3).
- 10. Después de administrar Maxitrol, retirar el dedo que sostenía el párpado inferior. Cerrar el ojo y presionar con el dedo el ángulo del ojo en el área de la nariz (figura 4). Esto ayuda a prevenir que el medicamento se absorba en el cuerpo.
- 11. Si es necesario administrar gotas en ambos ojos, debe repetir los pasos anteriores para el segundo ojo.
- 12. Inmediatamente después de usar el medicamento, cerrar la botella.
- 13. Debe usar una sola botella de medicamento al mismo tiempo.
Si la gota no cae en el ojo,debe repetir el intento de administración correcta.
Uso de una dosis mayor de la recomendada de Maxitrol
En caso de sobredosis local de Maxitrol, debe enjuagar el ojo (ojos) con agua tibia.
No debe usar el medicamento hasta la próxima dosis programada.
Olvido de la administración de Maxitrol
En caso de que se olvide una dosis, debe tomar la siguiente dosis programada. Sin embargo, si falta poco tiempo para la próxima dosis, debe omitir la dosis olvidada y regresar al esquema de administración normal. No debetomar una dosis doble para compensar la dosis olvidada.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a un médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Si el paciente experimenta reacciones alérgicas, incluidas erupciones cutáneas, hinchazón de la cara, los labios, la lengua y (o)
la garganta, que pueden causar dificultades para respirar o tragar, o si ocurren otros efectos adversos graves, debe suspender el uso de Maxitrol y consultar inmediatamente a un médico o a la sala de emergencias del hospital más cercano.
Durante el uso de Maxitrol, se han observado los siguientes efectos adversos:
No muy frecuentes(pueden ocurrir con menos frecuencia de 1 de cada 1000 pacientes): inflamación de la córnea, aumento de la presión intraocular, picazón en los ojos, sensación de incomodidad en los ojos, irritación en los ojos.
Frecuencia desconocida(la frecuencia no puede determinarse a partir de los datos disponibles):
hipersensibilidad, dolor de cabeza, úlceras en la córnea, visión borrosa, hipersensibilidad a la luz, dilatación de la pupila, caída del párpado, dolor en los ojos, hinchazón en los ojos, sensación de cuerpo extraño en los ojos, enrojecimiento en los ojos, lagrimeo excesivo, reacciones cutáneas graves (síndrome de Stevens-Johnson), visión borrosa, crecimiento excesivo del vello en el cuerpo (especialmente en mujeres), debilidad muscular y pérdida de masa muscular, estrías púrpuras en la piel, aumento de la presión arterial, irregularidades menstruales o ausencia de menstruación, cambios en la cantidad de proteínas y calcio en el cuerpo, supresión del crecimiento en niños y adolescentes, así como hinchazón y aumento de peso, especialmente en el tronco y la cara (enfermedad conocida como síndrome de Cushing) (véase el punto 2 "Advertencias y precauciones").
Notificación de efectos adversos
Si ocurren cualquier efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, calle de Alcalá, 56, 28071 Madrid, teléfono: +34 91 596 34 00, fax: +34 91 596 34 01, sitio web: www.aemps.gob.es.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
En caso de que se produzca un empeoramiento de alguno de los síntomas o si ocurren otros síntomas no mencionados en esta hoja de instrucciones, debe informar a su médico.
5. Cómo conservar Maxitrol
Para evitar la contaminación de las gotas, el frasco debe desecharse después de 4 semanas desde la primera apertura. La fecha de apertura del frasco debe anotarse en el espacio indicado a continuación.
Fecha de primera apertura:
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe conservarse a una temperatura superior a 25°C. No debe conservarse en el refrigerador.
El paquete debe conservarse cerrado herméticamente. Debe conservarse en posición vertical.
No debe usar este medicamento después de la fecha de caducidad indicada en el paquete. La fecha de caducidad es el último día del mes indicado.
No debe desechar los medicamentos por el desagüe ni en los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Maxitrol
Los principios activos del medicamento son:
Dexametasona 1 mg/ml
Sulfato de neomicina 3500 UI/ml
Sulfato de polimixina B 6000 UI/ml
Los excipientes son: cloruro de sodio, polisorbato 20, cloruro de benzalconio, hipromelosa, agua purificada.
Se agregan pequeñas cantidades de ácido clorhídrico concentrado y (o) hidróxido de sodio para ajustar el pH adecuado.
Cómo se presenta el medicamento y qué contiene el paquete
Maxitrol tiene la forma de una suspensión no transparente de color blanco a amarillo claro.
Está disponible en un frasco de tipo DROPTAINER de 5 ml con un gotero y una tapa, en una caja de cartón.
Para obtener información más detallada, debe consultar al titular de la autorización de comercialización o al importador paralelo.
Título de la autorización de comercialización en Bélgica, país de exportación:
Novartis Pharma NV, Medialaan 40, B-1800 Vilvoorde, Bélgica
Fabricante:
Novartis Pharma GmbH, Roonstrasse 25, 90429 Núremberg, Alemania
SA ALCON-COUVREUR NV, Rijksweg 14, B-2870 Puurs, Bélgica
Siegfried El Masnou, S.A., Camil Fabra 58, 08320 El Masnou, Barcelona, España
Novartis Farmacéutica, S.A., Gran Vía de les Corts Catalanes, 764, 08013 Barcelona, España
Importador paralelo:
InPharm Sp. z o.o.
ul. Strumykowa 28/11
03-138 Varsovia
Reempaquetado por:
InPharm Sp. z o.o. Services sp. k.
ul. Chełmżyńska 249
04-458 Varsovia
Número de autorización en Bélgica, país de exportación:BE038911
Número de autorización de importación paralela:
Fecha de aprobación de la hoja de instrucciones: 14.11.2023
[Información sobre la marca registrada]
- País de registro
- Principio activo
- Requiere recetaSí
- Titular de la autorización de comercialización (TAC, MAH)Novartis Pharma NV
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a MaxitrolForma farmacéutica: Gotas, (3 mg + 1 mg)/mlPrincipio activo: dexamethasone and antiinfectivesFabricante: Rafarm S.A.Requiere recetaForma farmacéutica: Gotas, (5 mg + 1 mg)/mlPrincipio activo: dexamethasone and antiinfectivesFabricante: Dr. Gerhard Mann Chem. - Pharm. Fabrik GmbHRequiere recetaForma farmacéutica: Ungüento, (5 mg + 0.3 mg)/gPrincipio activo: dexamethasone and antiinfectivesFabricante: Dr. Gerhard Mann Chem. - Pharm. Fabrik GmbHRequiere receta
Alternativas a Maxitrol en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Maxitrol en Ukraine
Alternativa a Maxitrol en Spain
Médicos online para Maxitrol
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Maxitrol – sujeta a valoración médica y normativa local.














