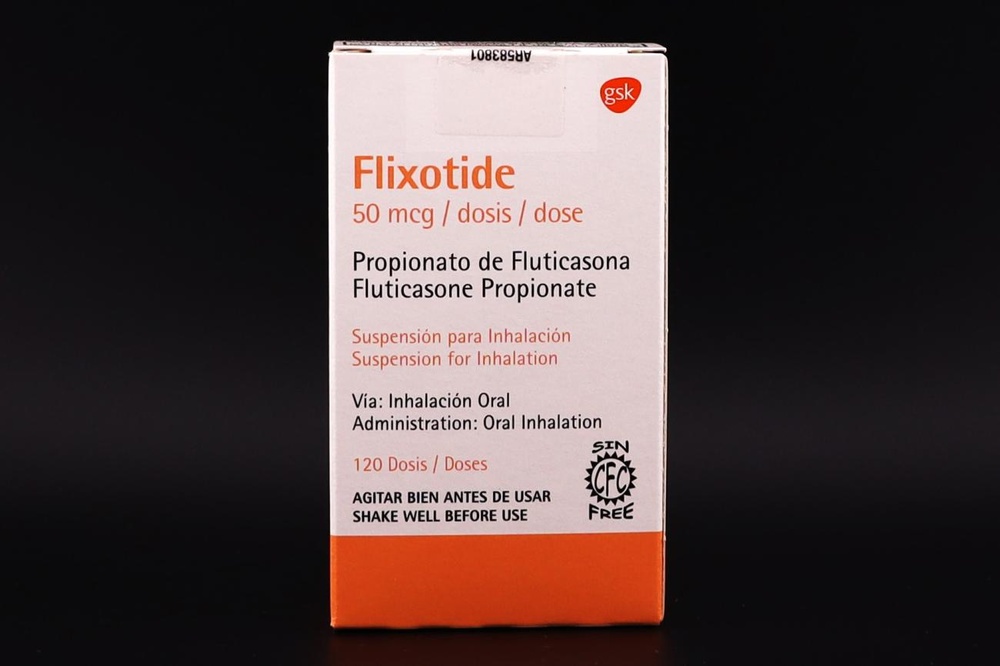
Flixotide

Consulta con un médico sobre la receta médica de Flixotide

Cómo usar Flixotide
Hoja de instrucciones del paquete: información para el paciente
Flixotide, 0,5 mg/2 ml, suspensión para nebulización
Flixotide, 2 mg/2 ml, suspensión para nebulización
Fluticasona propionato
Es importante leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Flixotide y para qué se utiliza
- 2. Información importante antes de tomar Flixotide
- 3. Cómo tomar Flixotide
- 4. Posibles efectos adversos
- 5. Cómo conservar Flixotide
- 6. Contenido del paquete y otra información
1. Qué es Flixotide y para qué se utiliza
Flixotide, suspensión para nebulización, pertenece a un grupo de medicamentos utilizados en el tratamiento del asma bronquial. El principio activo del medicamento, fluticasona propionato, es un esteroide con efecto antiinflamatorio local en los pulmones.
Indicaciones para el uso de Adultos y adolescentes mayores de 16 años:
El medicamento se utiliza para prevenir el asma bronquial grave en pacientes que requieren dosis altas de esteroides inhalados o orales. El inicio del tratamiento con fluticasona propionato inhalado en muchas personas permite reducir las dosis o suspender completamente los esteroides orales.
Niños de 4 a 16 años:
Tratamiento de exacerbaciones del asma bronquial.
2. Información importante antes de tomar Flixotide
Cuándo no tomar Flixotide
- si el paciente es alérgico a la fluticasona propionato o a cualquier otro componente del medicamento (enumerados en el punto 6).
Precauciones y advertencias
Si los síntomas del asma empeoran o la enfermedad se vuelve incontrolable, es decir, si se produce un aumento de la respiración silbante o es necesario utilizar más inhalaciones de un medicamento inhalado de acción rápida para facilitar la respiración, el paciente debe continuar tomando el medicamento y contactar inmediatamente a su médico, quien evaluará su estado de salud y recomendará el tratamiento adecuado.
El medicamento Flixotide no debe utilizarse para interrumpir un ataque agudo de asma. Para este fin, debe utilizarse un medicamento inhalado de acción rápida que el paciente debe llevar consigo siempre.
Flixotide está diseñado para su uso diario y regular.
Flixotide no puede reemplazar a los esteroides orales o intravenosos en situaciones de emergencia.
En caso de tratamiento prolongado con Flixotide, puede producirse una supresión de la producción natural de hormonas esteroides por las glándulas suprarrenales. Esto puede causar una disminución de la densidad ósea, cataratas, glaucoma, aumento de peso, redondez de la cara (aspecto lunar), hipertensión, retraso en el crecimiento de los niños y adolescentes. El médico controlará regularmente si el paciente presenta alguno de estos efectos adversos y se asegurará de que el paciente esté tomando la dosis más baja de Flixotide que controle el asma.
Durante el tratamiento con fluticasona propionato en dosis recomendadas, la función de la corteza suprarrenal suele ser normal. Sin embargo, en personas que han sido tratadas previamente con esteroides orales, pueden ocurrir síntomas de disfunción de la corteza suprarrenal. El tratamiento prolongado con dosis altas de esteroides inhalados puede causar una supresión de la función de la corteza suprarrenal. Los niños y adolescentes menores de 16 años que toman dosis altas (generalmente ≥1000 microgramos al día) de fluticasona propionato son un grupo de alto riesgo. Es muy raro que ocurran síntomas adversos en caso de tratamiento prolongado con dosis altas de Flixotide o en caso de interrupción repentina del tratamiento o reducción de la dosis. Los síntomas adversos también pueden ocurrir en caso de infecciones o en períodos de estrés intenso (por ejemplo, accidente, lesión o cirugía).
Los síntomas no suelen ser característicos y pueden incluir dolor abdominal, fatiga, pérdida de apetito, náuseas y vómitos, pérdida de peso, dolor de cabeza, confusión, hipotensión, disminución de la glucosa en sangre y convulsiones. Para prevenir la aparición de estos síntomas, el médico puede recetar corticosteroides adicionales para su uso en ese momento.
Debido a la posibilidad de disfunción de la corteza suprarrenal, los pacientes que están siendo tratados con esteroides orales y que son cambiados a fluticasona propionato inhalado deben estar bajo supervisión especial, y la función de la corteza suprarrenal debe ser monitoreada.
Después de iniciar el tratamiento con fluticasona propionato, la reducción de las dosis de esteroides sistémicos debe realizarse de manera gradual, y los pacientes deben llevar consigo una "tarjeta de esteroides" que indique la necesidad de administrar esteroides sistémicos adicionales en situaciones de estrés.
El reemplazo de esteroides orales por medicamentos inhalados puede revelar síntomas de alergia, como rinitis alérgica o erupciones cutáneas, que previamente habían sido tratados con esteroides sistémicos. El médico recetará el tratamiento adecuado.
Se han notificado casos muy raros de aumento de la glucosa en sangre (véase el punto 4) y el médico debe tener en cuenta esto al recetar Flixotide a pacientes con diabetes en su historial.
No debe interrumpirse bruscamente el tratamiento con fluticasona propionato.
Si el paciente está siendo tratado actualmente o ha sido tratado previamente por tuberculosis, debe informar a su médico.
Si el paciente experimenta visión borrosa o otros trastornos de la visión que puedan ser causados por cataratas o glaucoma, debe contactar a su médico.
Flixotide y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluyendo aquellos que se venden sin receta.
Es especialmente importante informar a su médico sobre los siguientes medicamentos:
- esteroides en tabletas o inyecciones
- ritonavir o medicamentos que contienen cobicistat, utilizados en el tratamiento de VIH
- ketconazol o itraconazol, utilizados en el tratamiento de infecciones fúngicas.
El médico evaluará si puede tomar Flixotide con estos medicamentos. Algunos de ellos pueden aumentar los efectos de Flixotide y el médico puede querer monitorear su estado de salud con cuidado (incluyendo algunos medicamentos para el VIH: ritonavir, cobicistat).
Con Flixotide solo se pueden tomar los medicamentos que su médico haya recetado.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de tomar este medicamento.
El médico evaluará si la paciente puede tomar Flixotide durante este período.
Conducción de vehículos y uso de maquinaria
Es poco probable que los posibles efectos adversos asociados con Flixotide afecten la capacidad de conducir vehículos o operar maquinaria.
3. Cómo tomar Flixotide
Este medicamento siempre debe tomarse según las indicaciones de su médico. No debe tomar una dosis mayor que la recetada. En caso de dudas, debe consultar a su médico.
Flixotide en forma de suspensión para nebulización está diseñado exclusivamente para inhalación, no para administración oral o inyección.
El medicamento debe administrarse en forma de aerosol producido por un nebulizador neumático, según las indicaciones de su médico. No se recomienda el uso de nebulizadores ultrasónicos para la inhalación de Flixotide, suspensión para nebulización.
Como la administración inhalada del medicamento depende de muchos factores, debe seguir las instrucciones del fabricante del nebulizador.
Se recomienda inhalar el medicamento mediante un tubo para inhalar, para evitar el riesgo de cambios atróficos en la piel de la cara en caso de administración prolongada de fluticasona propionato con una máscara facial. En caso de uso de una máscara facial, la piel de la cara en contacto con ella debe protegerse con una crema o lavarse cuidadosamente después de la inhalación.
Dosificación
Adultos y adolescentes mayores de 16 años- 0,5 a 2,0 mg dos veces al día, estrictamente según las indicaciones del médico.
Niños y adolescentes de 4 a 16 años- 1,0 mg dos veces al día, estrictamente según las indicaciones del médico.
No debe administrarse Flixotide, 2 mg/2 ml, suspensión para nebulización en niños menores de 16 años. No hay datos clínicos sobre la dosificación recomendada en este grupo de edad.
Grupos especiales de pacientes:no es necesario reducir la dosis en pacientes ancianos o con alteraciones renales o hepáticas.
Modo de administración
Antes de usar, agitar bien el contenido del recipiente sacudiéndolo varias veces. Para abrir, girar la parte superior móvil del recipiente y separarla.
Se recomienda inhalar el medicamento mediante un tubo para inhalar (véase el manual de instrucciones del nebulizador).
Dilución:Flixotide, suspensión para nebulización puede diluirse con una solución al 0,9% de cloruro de sodio para inyección con el fin de facilitar el uso de pequeños volúmenes del medicamento o si se recomienda una administración más prolongada.
No debe desecharse la suspensión no utilizada del nebulizador.
Dependiendo del diseño del nebulizador, el aerosol puede escapar del dispositivo hacia el exterior.
Por este motivo, no debe realizarse la inhalación con un nebulizador en espacios cerrados sin posibilidad de ventilación. Esto es especialmente importante en salas de hospital, donde a menudo varios pacientes utilizan nebulizadores al mismo tiempo.
Uso de una dosis mayor de la recomendada de Flixotide
En caso de administración de una dosis mayor de la recomendada de Flixotide, debe contactar inmediatamente a su médico o farmacéutico para obtener consejo.
Es importante tomar las dosis del medicamento según las indicaciones del médico. No debe aumentar ni reducir la dosis sin consultar a su médico.
La administración de dosis mayores de las recomendadas de fluticasona propionato puede causar una supresión transitoria de la función de la corteza suprarrenal.
La administración prolongada de dosis mayores de las recomendadas de fluticasona propionato puede llevar a una insuficiencia de la corteza suprarrenal.
Omision de la administración de Flixotide
Es muy importante tomar la dosis recomendada del medicamento todos los días, lo que garantizará la máxima eficacia del tratamiento.
En caso de olvido de una dosis, debe tomar el medicamento lo antes posible. Luego, continuar con el tratamiento según las indicaciones.
No debe tomar una dosis doble para compensar la dosis olvidada.
Interrupción del tratamiento con Flixotide
Es muy importante tomar Flixotide todos los días, hasta que su médico no indique lo contrario. No debe interrumpir bruscamente el tratamiento con Flixotide, ya que los síntomas de la enfermedad pueden empeorar y pueden ocurrir trastornos hormonales en el organismo.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Flixotide puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
A continuación, se presentan los efectos adversos observados en pacientes que tomaron Flixotide.
Reacciones alérgicas: debe buscar ayuda médica de inmediato
Reacciones alérgicasa Flixotide, que ocurren con una frecuencia no muy común (pueden ocurrir en 1 de cada 100 pacientes que toman el medicamento).Se caracterizan por síntomas como:
- erupciones cutáneas (urticaria) o enrojecimiento.
Reacciones alérgicasa Flixotide, que ocurren muy raramente (pueden ocurrir en menos de 1 de cada 10.000 pacientes que toman el medicamento), y en una pequeña proporción de pacientes, estas reacciones pueden desarrollarse en una condición grave, incluso amenazante para la vida, si no se tratan. Se caracterizan por síntomas como:
- edema (principalmente de la cara, labios, boca, lengua o garganta), que puede causar dificultades para tragar o respirar,
- aparición repentina de dificultades para respirar o empeoramiento repentino de la respiración silbante (broncoespasmo),
- aparición repentina de debilidad o mareo (que puede causar caídas o pérdida de conciencia).
En caso de aparición de estos síntomas, debe interrumpir el tratamiento y contactar inmediatamente a su médico, quien recetará el tratamiento adecuado.
Otros efectos adversos:
Muy frecuentes efectos adversos( pueden ocurrir en más de 1 de cada 10 pacientes):
- infecciones por hongos (boletos dolorosos, amarillentos) en la boca y la garganta, dificultades para tragar. Puede ser útil enjuagar la boca con agua y escupirla después de la inhalación. El médico puede recetar un medicamento antifúngico adicional para tratar las infecciones por hongos.
Frecuentes efectos adversos( pueden ocurrir en 1 de cada 100 pacientes):
- ronquera, pérdida de voz. Puede ser útil enjuagar la boca con agua y escupirla después de la inhalación.
- neumonía, notificada en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
- moretones más fáciles.
Infrecuentes efectos adversos( pueden ocurrir en 1 de cada 1.000 pacientes):
- infecciones por hongos en el esófago.
Muy infrecuentes efectos adversos( pueden ocurrir en menos de 1 de cada 10.000 pacientes):
- Flixotide puede afectar la producción normal de hormonas esteroides en el organismo, especialmente en caso de administración de dosis altas del medicamento durante un período prolongado. Los síntomas incluyen: retraso en el crecimiento de los niños y adolescentes, disminución de la densidad ósea, cataratas, glaucoma, aumento de peso, redondez de la cara (aspecto lunar), hipertensión, Cushing.
- aumento de la glucosa en sangre (hiperglucemia). En pacientes con diabetes, puede ser necesario controlar más frecuentemente la glucosa en sangre y ajustar la dosis de los medicamentos antidiabéticos que se están tomando.
- dolor en las articulaciones.
- dispepsia.
- ansiedad, trastornos del sueño y cambios en el comportamiento, incluyendo hiperactividad y irritabilidad. La aparición de estos efectos es más probable en niños.
Efectos adversos con frecuencia desconocida( la frecuencia no puede determinarse a partir de los datos disponibles):
- depresión y agresión. La aparición de estos efectos es más probable en niños.
- hemorragia nasal.
- visión borrosa.
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en la hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: 901 00 62 50
Fax: 91 596 24 88
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización o a su representante.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Flixotide
Conservar a una temperatura inferior a 30 °C. Proteger de la luz, no congelar.
Conservar en un lugar inaccesible para los niños.
Conservar en posición vertical. Agitar antes de usar.
No utilizar este medicamento después de la fecha de caducidad indicada en el paquete después de: EXP.
La fecha de caducidad es el último día del mes indicado.
El número de lote del medicamento figura en el paquete después de: Lote.
Después de abrir la bolsa, conservar el producto en recipientes de plástico, protegiéndolo de la luz, durante un máximo de 28 días.
El medicamento debe desecharse si no se ha utilizado inmediatamente después de abrir el recipiente de plástico.
No debe desecharse el medicamento por el desagüe o en los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Flixotide, suspensión para nebulización?
- El principio activo del medicamento es fluticasona propionato (micronizado). 2 ml de suspensión (1 recipiente de plástico) contienen respectivamente 0,5 mg o 2 mg (miligramos) de fluticasona propionato (micronizado).
- Los demás componentes son: polisorbato 20, laurilsulfato de sorbitano, fosfato de sodio dihidrogenado, fosfato de sodio disódico, cloruro de sodio, agua para inyección.
Cómo es Flixotide, suspensión para nebulización, y qué contiene el paquete?
10 recipientes (2 bolsas de 5 recipientes) en una caja de cartón.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización:
GlaxoSmithKline (Ireland) Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Irlanda
Fabricante:
GlaxoSmithKline Trading Services Limited
12 Riverwalk,
Citywest Business Campus
Dublin 24,
Irlanda
Para obtener información más detallada, debe consultar a un representante del titular de la autorización de comercialización:
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
tel. (0-22) 576 9000
{Logo del titular de la autorización de comercialización}
Fecha de la última actualización de la hoja de instrucciones: noviembre 2020
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGlaxoSmithKline Trading Services Limited
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FlixotideForma farmacéutica: Polvo, 250 mcg/dosis inh.Principio activo: fluticasoneRequiere recetaForma farmacéutica: Polvo, 500 mcg/dosis inh.Principio activo: fluticasoneRequiere recetaForma farmacéutica: Polvo, 50 mcg/dosis inh.Principio activo: fluticasoneRequiere receta
Alternativas a Flixotide en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Flixotide en Україна
Alternativa a Flixotide en Іспанія
Médicos online para Flixotide
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Flixotide – sujeta a valoración médica y normativa local.